软骨发育不全
软骨发育不全是一种短肢侏儒症。achondroplasia这个词的字面意思是“没有软骨形成”。软骨是一种坚韧但柔韧的组织,在早期发育过程中构成了大部分骨骼。软骨发育不全是类似于另一个名为骨骼疾病软骨发育不良,但是它的功能软骨发育不全往往更严重。
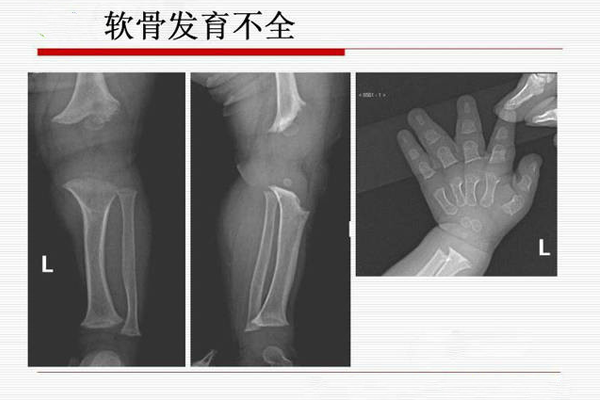
所有患有软骨发育不全的人身材矮小。具有软骨发育不全的成年男性的平均身高为131厘米,成年女性的平均身高为124厘米。软骨发育不全的特征包括平均大小的躯干,短臂和腿,上臂和大腿特别短,肘部活动范围有限,头部扩大前额突出。手指通常较短,无名指和中指可能发散,手三指外观。患有软骨发育不全的人通常具有正常的智力。
通常与软骨发育不全相关的健康问题包括呼吸暂停、肥胖和复发性耳部感染。在儿童时期,患有这种疾病的个体通常会发生明显的永久性脊柱前凸,一些受影响的人也会出现脊柱后凸畸形和背部疼痛。
软骨发育不全的潜在严重并发症是椎管狭窄,脊柱狭窄与腿部疼痛,刺痛和虚弱有关,可导致行走困难。
软骨发育不全的另一个罕见但严重的并发症是脑积水,可导致头部大小增加和相关的大脑异常。
影响人群
软骨发育不全是最常见的短肢侏儒症,比例为1/15,000至1/40,000名新生儿中。
致病原因
软骨发育不全是由称为成纤维细胞生长因子受体(FGFR3)的基因突变引起的。
对于大多数患者,没有明显的病史家族史,在散发性软骨发育不全的情况下,父亲年龄的增加可能是一个促成因素。
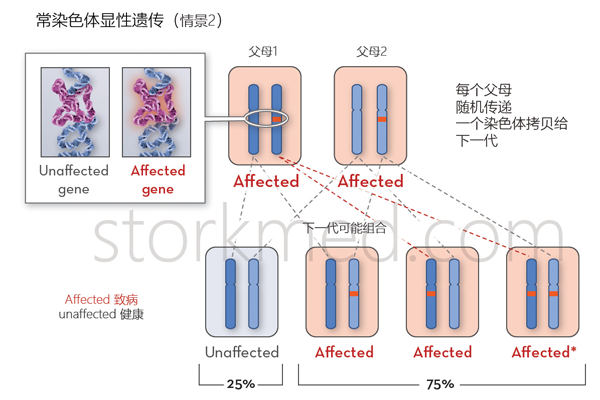
软骨发育不全的家族性病例遵循常染色体显性遗传模式。
常染色体显性遗传
异常基因可以从父母中遗传,或者可以是受影响个体中突变(改变)基因的结果。每次怀孕,将异常基因从受影响的父母传给后代的风险为50%,男性和女性的风险相同。
生育干预
如果是遗传性的软骨发育不全是可以通过三代试管婴儿技术进行生育干预。
软骨病是短肢侏儒症的最常见形式。患病个体的身材矮小是由于四肢的根茎缩短,特征性的额叶与额突和中面部发育不全,腰椎前凸过大,肘关节伸展受限,膝内翻和三叉戟手引起的(Bellus等,1995年摘要)。
软骨发育不全(ACH)是由4p16.3号染色体上的成纤维细胞生长因子受体3基因(FGFR3; 134934)的杂合突变引起的。
Phenotype-Gene Relationships
| Location | Phenotype | Phenotype MIM number |
Inheritance | Phenotype mapping key |
Gene/Locus | Gene/Locus MIM number |
|---|---|---|---|---|---|---|
| 4p16.3 | Achondroplasia | 100800 | AD | 3 | FGFR3 | 134934 |
▼ 临床特征
过去,许多导致身材矮小的疾病被不恰当地称为软骨发育不全,这种骨软骨发育不良的表型是如此独特,并且在出生时在临床和放射学上很容易识别,因此不应发生混淆。它的特点是躯干长,狭窄,四肢短,尤其是在近端(根茎)段,头额大,额头凸起,中脸发育不全和手的三叉戟构造。大多数关节(尤其是膝盖)的超伸性很常见,但是肘部的伸展和旋转受到限制。胸腰段长臂猿通常在出生时就出现,但是当孩子开始走动时通常会被夸大的腰椎前凸取代。轻度至中度肌张力低下很常见,运动里程碑通常会延迟。除非脑积水或其他中枢神经系统并发症出现,否则智力是正常的。在13位软骨发育不良的婴儿中,Hecht等(1991)发现认知发展是平均水平,与通常被延迟的运动发展无关。值得注意的是,智力低下与多导睡眠图检测到的呼吸功能障碍的证据有关。
在儿童中,典型的放射学特征是,椎间距离的缩小而不是正常的扩大,并且ch状groove槽。同样在儿童中,骨epi骨化中心在干physi端上表现出回旋支或人字形座。肢体缩短在肱骨等近端段尤其明显。因此,描述根茎(“根肢”)。Langer等人提出了真正的软骨发育不全的放射学特征以及与该病的自然病程有关的许多信息(1967)在对101个案例的研究基础上,由Hall(1988)提出。
真正的大脑畸形发生在软骨发育不全中,据推测表明该基因除了单独作用于骨骼外,还具有其他作用(Dennis等,1961)。在某些情况下,颅底与大脑之间的比例失调会导致内部脑积水。脑积水可能是由于乙状窦狭窄在狭窄的颈椎孔水平引起的颅内静脉压力增加引起的(Pierre-Kahn等,1980)。霍尔等(1982)指出,软骨发育不良的胎儿的大头会增加分娩时颅内出血的风险。他们建议在处理软骨发育不全的婴儿时,应在出生时,2、4和6个月大时进行超声检查,以确定心室大小,是否存在脑积水以及可能存在颅内出血。他们的印象是,某些软骨发育不良者仅具有巨脑畸形,其他具有真正的沟通性脑积水,而另一些则具有扩张的心室而无脑积水。Nelson等(1988)的结论是,脑干受压在软骨发育不全中很常见,可能部分解释了呼吸功能异常。
保利等(1984年)将注意力集中在软骨发育不全婴儿突然意外死亡的风险上。尽管不受控制且具有回顾性,但他们的研究表明,在生命的第一年死亡人数过多,其中大部分或全部归因于颅颈交界处的异常。Hecht等(1987年)表明,软骨发育不全婴儿的额外死亡风险可能接近7.5%,这主要是由于颈髓受压所致。保利等(1995)对53例婴儿进行了颈髓交界压迫的风险的前瞻性评估,其中5例被认为具有足够的颅颈交界压迫需要进行手术减压。术中观察显示颈脊髓明显异常,所有接受手术的儿童均显示神经功能明显改善。枕下减压需求的最佳预测指标包括检查时下肢过度反射或阵挛,多导睡眠图检查显示的中央性呼吸不足以及软骨发育不良儿童的平均气孔测量值低于平均水平。
Lachman(1997)从临床和放射学的角度回顾了骨骼发育异常的神经系统异常。确定了三个重要的主要群体:(i)软骨发育不全(成年期的颅颈连接问题,椎管狭窄和成年期神经源性c行);(ii)II型胶原病(上颈椎的解剖和功能问题);(iii)颅管和硬化性骨发育不良(骨过度生长,有孔眼阻塞问题)。
为了检测脊髓病,Boor等人(1999)记录了正中神经刺激后的30名软骨发育不全患者的体感诱发电位(SEPs)。除传统技术外,他们还使用了非头颅参比电极来记录在颅颈交界处产生的皮层下波形N13b和P13。这些发现与临床状况和MRI结果相关。SEPs的敏感性对于宫颈压迫为0.89,对于脊髓软化症为0.92,对于有临床症状的患者为1.0。没有假阳性结果。皮层下的SEP比传统的记录更敏感。
Hecht等(1988)回顾了软骨发育不全的肥胖问题,认为这是一个主要问题,无论其潜在原因是什么,都会加重与腰椎管狭窄相关的发病率,并导致非特异性关节问题和这种情况下可能的早期心血管疾病死亡率。Hunter等使用来自不同国家的409名白种人患有软骨发育不全的患者的数据(观察到1147次)(1996)开发了这些患者的身高体重(W / H)曲线。他们表明,在大约75厘米的高度上,正常和软骨发育不良儿童的平均W / H曲线几乎相同。在此高度之后,软骨发育不良患者的W / H曲线高于普通人群的W / H曲线。亨特等(1996) 有人认为,Quetelet指数是3至6岁的软骨发育不良患者体重超重的最佳估计,而Rohrer指数是6至18岁患者的体重过剩的最佳估计。
软骨发育不良基因的纯合性导致骨骼的严重紊乱,其放射学变化在质量上与通常的杂合性软骨发育不良有所不同。早期死亡是由于小胸廓的呼吸窘迫和脑积水引起的神经功能缺损(Hall等,1969)。杨等(1977)报道纯合子上颈椎病。
霍顿等(1988)发现found骨和生长板软骨在组织学上具有正常的外观,并且主要基质成分通过免疫染色表现出正常的分布。然而,形态学研究表明,生长板比正常人短,并且纯合子比杂合性软骨发育不良的缩短更大,表明基因剂量效应。Stanescu等(1990)报道了来自一例纯合软骨发育不良的胫骨上软骨的组织化学,免疫组织化学,电子显微镜和生化研究。未定义具体异常。Aterman等(1983)尽管杂合子几乎没有变化,但对纯合子软骨发育异常的显着组织学变化表达了困惑。他们指出,尚未进行几周或几个月大的杂合子的组织学研究。他们认为,由于所谓的PHA(假定纯合性软骨发育不全)和体盲侏儒症(187600)之间存在相似性,因此后一种情况的某些情况可能是由于软骨发育不良位点的特别严重的突变所致。
Young等(1992年)描述了先天性脊柱干pi发育异常(SEDC;183900)的父亲和软骨发育不全的母亲的后代中的致命性短肢侏儒症。Young等(1992)建议婴儿是两个显性基因的双重杂合子,而不是复合杂合子。人们认为SEDC和软骨发育不全不太可能是等位基因,因为有证据表明,大多数(如果不是全部)SEDC病例是由II型胶原基因(COL2A1; 120140)的突变引起的,而该基因已被排除在外。软骨发育不全的突变。
软骨发育不良位点的等位基因可能导致软骨发育不良(146000)的证据来自观察到一个软骨发育不良的父亲和发育不良的母亲的后代中推测的遗传复合物,这些骨骼发育异常,骨骼的放射学异常更为严重。相比于软骨发育不全中通常所见的那些(McKusick等,1973;Sommer等,1987),并且其严重性不如ACH纯合子。哈金斯等(1999年)报道了一个8个月大的软骨发育不全/ hypochondroplasia的女孩,其父亲在FGFR3基因中存在G380R软骨发育不全突变(134934.0001),其母亲患有N450K软骨发育不全突变(134934.0010)。Chitayat等(1999年)同时报道了一个患有软骨发育不全/软骨发育不良的婴儿男孩,其母亲患有G380R突变,父亲患有N450K突变。分子分析证实了两个孩子的复合杂合性,他们表现出的中间表型比杂合状态下的任何一种情况都更严重,但不如纯合ACH严重。
在维也纳病理解剖学博物馆中发现的成人遗传性骨骼发育异常的介绍中,Beighton等人(1993)描绘了一个患有软骨发育不全的61岁男性的骨骼,该男性死于横断性脊髓炎。伦道夫等(1988)报道了一名发展为经典强直性脊柱炎的软骨发育不良患者(106300)。两种疾病之间没有根本联系。观察的重要性主要是表明软骨发育不良的背部问题可能是由潜在疾病以外的原因引起的。
亨特等(1998)展示了来自对软骨发育不良的193个人的多中心研究的数据。他们发现89.4%的儿童在出生后的头2年内至少有一次中耳炎发作;在出生后第一年患有中耳炎的99名儿童中,有24名感染了几种病毒。所有人均患有慢性中耳炎。78.3%的人在生活中的某个时刻需要插入通风管。1至2岁的85名患者中有30名,而2至3岁的70名患者中有26名接受了至少一套通气管。在生命中的某个时候,有38.3%的人发现了一定程度的传导性听力损失,其中大多数是在4岁以后发现的。38.8%的个体进行了扁桃体切除术,头4年的累积率为8.8%和25%的8岁以下儿童。在18.6%的人中发现了言语延迟,并且有10.9%的人有发音困难。这些人中只有9.5%接受了言语治疗。53.8%的人发现了正畸问题;这些人中只有3.2%在生命的头10年内出现。
亨特等(1998)发现有10.5%的人有心室分流。除了其中一个程序外,所有程序都是在青春期之前完成的。到4岁的儿童中有6.8%进行了子宫颈髓腔减压手术;但是,此手术也适用于许多年龄较大的儿童,青少年和成人,总共有16.5%的人接受过这种手术。据报告,到4岁时,呼吸暂停的比例为10.9%,总体为16.1%。
亨特等(1998年)将胫骨弯曲定义为膝盖之间的距离大于5 cm,且腿部伸直且脚踝并列。使用这些标准,他们发现到5岁时,有9.7%的人患有胫骨弓。这种情况在整个儿童时期一直持续到成人生活,在某个时候共有41.6%的人受到影响。这些人中有21.6%进行了胫骨截骨术。到10岁时,有8.9%的人的腿出现神经系统症状;然而,到第六个十年,有77.9%的人有这些症状。共有24.1%的患者进行了椎管狭窄手术,另外18%的患者进行了诊断但未进行手术。这些手术大多数是在40岁以上的个体中进行的。亨特等(1998)结论是中耳疾病及其伴有听力损失的风险比以前报道的更为频繁,并且尽管许多软骨发育不全的患者出现语言延迟,但只有少数接受语言治疗。早期子宫颈髓腔减压的速度与之前报道的相当,但是相当比例的患者需要在儿童期以后进行此类干预。亨特等(1998年)还得出结论,到青少年时期,许多患者会出现神经系统疾病,这在成年后占多数。
塔斯克等(1998)伦敦大奥蒙德街儿童医院的17位软骨发育不全患者的心肺功能和睡眠功能异常。确定了三个不同的病因学组:第1组具有中等程度的面部发育不全,导致相对的腺扁桃体肥大;第2组患有颈静脉孔狭窄,由于颈静脉高压导致肌肉上气道阻塞和进行性脑积水。第3组有上呼吸道肌肉阻塞,无因舌下管狭窄伴或不伴有大孔加压而导致的脑积水。此外,在第3组患者中倾向于发生胃食管反流是导致气道疾病发展的重要因素。第1组患者仅发生阻塞性睡眠呼吸暂停,并在腺扁桃体切除术后表现出明显的症状改善。第2组患者因脑积水的手术治疗而出现中枢性呼吸暂停;该组阻塞性睡眠呼吸暂停似乎对腺扁桃体切除术无反应,但对夜间持续的气道正压通气无反应。第3组患者患有进行性肺心病,阻塞性和中枢性睡眠呼吸暂停,以及胃食管反流,气道病变小,需要多种治疗方式,包括大孔减压。
Pauli和Modaff(1999)在接受骨发育不良诊所定期评估的126名软骨发育不良儿童中,有4名(3.2%)他们发现右侧颞骨异常涉及到颈球上方没有屋顶,并且球突出到中耳腔。在2例患者中,注意到鼓膜后出现深蓝灰色变色,并且颞骨CT扫描证实存在单侧颈动脉球裂开。在第三例患者中,在探索性鼓室切开术中观察到一个大的裂开的颈静脉球;在第四例患者中,在尝试进行开颅手术和放置管子期间出现轻度出血后,CT扫描显示没有颈动脉球状骨覆盖。疑似鼓室下裂的第五例患者在鼓膜下四分之一深部呈深蓝色,但在报告时尚未进行确认性研究。保利和莫达夫(1999) 指出颈椎球根裂开与临床有关,特别是在开髓手术时难以控制的出血方面,并且与患有软骨发育不全的儿童的其他原因不明的听力下降,耳鸣和可听见的挫伤有关。
雷诺兹等(2001)回顾性回顾了71例软骨发育不全婴儿的临床和计算机断层扫描数据。他们发现婴儿肌张力低下与大孔的大小之间没有相关性。这些结果表明没有直接的关系,并且椎间孔的大小不会影响低渗的严重性。他们得出结论,婴儿软骨发育不全的低渗症的唯一合理解释是FGFR3致病性突变的主要作用(134934),该突变在大脑中表达。
Van Esch和Fryns(2004)描述了一个9岁男孩患有软骨发育不全的黑棘皮病,这是由于FGFR3中存在经典的gly380-arg突变(134934.0001)。
Wynn等(2007年)报道了对软骨发育不全的死亡率进行了为期42年的随访研究。该研究包括来自Hecht等人较早的死亡率研究的718软骨发育不全患者(1987年)和另外75名软骨发育不全的人。在整个随访期间,死亡率相似。所有年龄段的总体死亡率和特定年龄段的死亡率仍然明显增加。成人意外和神经系统疾病相关的死亡人数增加。25岁至35岁之间与心脏病有关的死亡率是普通人群的10倍以上。该ACH人群的总生存期和平均预期寿命降低了10年。
▼ 遗传
软骨发育不全是作为常染色体显性遗传,具有基本上完全的外显率。大约八分之八的病例是新突变的结果,有效生殖适应度大大降低。
Penrose(1955)指出了父本年龄对突变的影响。斯托尔等(1982年)报道了通过LPA(美国小人物),APPT(法国小人物协会)确定的零星病例中较高的父亲年龄。汤普森等(1986)发现,平均而言,软骨发育不全的严重程度倾向于随着父母年龄的增加而降低。令人怀疑的是,隐性软骨发育不全形式与优势形式没有区别。在大多数有关隐性遗传的报告中,有关诊断的文献不足。
Tiemann-Boege等(2002年)进行了直接的分子测量,在精子中生殖系突变频率,以检验父本年龄对突变影响的假说。他们使用来自不同年龄供体的精子DNA,确定了导致软骨发育不良的FGFR3基因(134934.0001)中1138G-A突变的频率。突变频率随年龄增加的幅度不足以解释为什么年长的父亲有更大的机会生下这种情况的孩子。考虑了许多替代方法来解释这种差异,包括选择携带突变的精子或年龄依赖性增加的致突变前病变,这些病变在精子中未修复且在研究中使用的PCR检测效率低下。
Cohn和Weinberg(1956)报告了患双胞胎的同胞双胞胎(这可能是软骨发育不全,例如200600。)Chiari(1913)报告了受影响的一半同胞,其父亲患有软骨发育不良。两位堂兄的母亲无疑是软骨发育不良的姐妹,他们无疑患有软骨发育不全(Wadia,1969)。大多数显性动物显示出足够的变异性,以根据减少的外在表现来解释诸如此类的观察结果,但软骨发育不全的情况并非如此。
性腺镶嵌症(或精原突变)是正常父母患病同胞的可能解释。鲍恩(Bowen,1974)描述了性腺马赛克的可能例子。正常父母的两个女儿患有软骨发育不全。其中一个女儿有两个孩子,其中一个孩子也具有软骨弹性。Fryns等(1983)报道了正常父母所生的3个软骨发育不良的姐妹。Philip等(1988年)描述了一个男人的案例,这个男人有2个不同的女人,有3个女儿患有典型的软骨发育不全。
亨德森等(2000年)报道了平均发育水平的父母出生的软骨发育不良的同胞。两个孩子均具有1138G-C因果突变(134934.0002);在未患病母亲的28%的外周血白细胞中也发现了这种情况。因此,作者假设她是该突变的生殖系和体细胞镶嵌体。
Sobetzko等(2000)还报道了父母未受影响的兄弟姐妹的软骨发育不全。同胞共享经典的1138G-A突变(134934.0001),还共享来自未受影响父亲的4p单倍型。尚无父本精子,无法证实性腺镶嵌症的证据。
受影响的表亲可能是由于2个孤立突变的巧合所致。麦克库西克(McKusick)认为,在Fitzsimmons(1985)报道的第二个堂兄中,就是这种情况。Reiser等(1984)回顾了6个家族意外复发的家庭,并假设这些复发仅仅是2个孤立偶然事件的结果。Dodinval和Le Marec(1987)报告了2个家庭,每个家庭有2例软骨发育不良。在一个家庭中,一个女孩和她的大姨妈受到了影响;另一个是男性和女性的堂兄。发芽花叶病和父系年龄效应似乎都以补充精原细胞的方式为基础,这一特征使雄性和雌性的配子发生区分开来。如概述Clermont(1966)认为,精原细胞经历了一些有丝分裂分裂,然后才开始进行导致成熟精子的减数分裂分裂。有丝分裂分裂的一些产品被送回“细胞库”以补充精原细胞的供应。因此,DNA复制过程中发生的突变会积累起来,为父本年龄效应和生发镶嵌提供基础。Hoo(1984)提出,在父母正常的同胞中,小的插入移位是复发性软骨发育不全的可能机制。在讨论“男性驱动的进化”以及男性突变率普遍高于女性的证据时,Crow(1997)指出在一个30岁的男人中产生精子细胞所需的细胞分裂数目估计为400;不考虑年龄,产生卵子的细胞分裂数为24。如果突变率与细胞分裂成正比,则男女之比应等于17。实际上,数据显示出更高的比率,好像突变率以比复制次数所预测的更高的速率增加-不是如果转录的保真度和修复机制的效率随着年龄的增长而降低,这是令人惊讶的。Ellegren和Fridolfsson(1997)对雄性和雌性鸟类的研究似乎支持鸟类DNA序列的雄性驱动进化。
结合软骨发育不良的临床特征,讨论了ACH基因纯合子的严重表型和软骨发育不良代表等位基因疾病的可能性。
Langer等(1993年)描述了一个病人的软骨发育不良和假性软骨发育不良双重杂合性(177170)。伍兹等(1994)描述了一个家庭,父亲患有假软骨发育不良,母亲患有软骨发育不良,两个女儿受到双重影响,儿子仅患有软骨发育不良。出生时,这两个女儿似乎患有软骨发育不良。后来,固定腰椎长臂猿的发展,脊柱异常的影像学改变,手部关节松弛度的增加以及步态和手部姿势的特征使假性软骨发育不全的表现变得明显。
Flynn和Pauli(2003)描述了第四例,其放射学发现与Langer等人描述的完全相同(1993)和伍兹等(1994)。他们评论说,最初所有先证者仅患有软骨发育不良的事实不足为奇,因为在受影响的个体中,直到2岁以后,通常无法识别假软骨发育不良特征。Langer等人描述的病人(1993)在7.5岁时发展为腰椎管狭窄。Woods等人的报告中的两个同胞(1994年)有足够严重的孔大口狭窄,导致高度颈椎病,需要减压。
Flynn和Pauli(2003)描述了一个家庭,其中先证者,她的母亲和她的祖父都是软骨发育不良和I型成骨不全症的双重杂合子(166200)。影像学和临床检查证明了这两种情况的特征,没有哪一种比每种疾病单独的杂合子所期望的突出。
由于性腺镶嵌症,在父母不受影响的软骨发育不良儿童的同胞中发生软骨发育不良的风险可能高于突变率的两倍,但尚未测定。梅特勒和弗雷泽(Mettler and Fraser,2000)从加拿大的11个遗传学中心收集了数据,得出的估计数为443:1,即0.02%。
Stoll和Feingold(2004)进行了分析,以确定先天性异常儿童的父母中较高的癌症风险是否表明致畸和致癌之间存在联系。在软骨发育不全中,新的突变是父系起源的,这提出了“突变”基因存在于男性减数分裂和两性的体细胞,有丝分裂细胞中的假设,这可能有助于癌症的发生。通过对76名男性和72名女性患有软骨发育不良的男性进行的问卷调查,Stoll和Feingold(2004)发现,父亲的祖母和祖母患癌症(56)明显多于母亲的祖父和祖母(24)(卡方= 14.80,p小于0.001 )。
Natacci等人在健康无血缘父母第一次和第三次怀孕的三个同胞中发现了同胞(2008)鉴定了FGFR3基因中的G380R突变的杂合性(134934.0001)。在亲本的淋巴细胞DNA中未发现该突变。但是,对这位37岁父亲的精子样本的DNA分析显示G380R突变。作者说,这是第二个报道的生发花叶病,在随后的概念中引起软骨发育不良的病例。
▼ 测绘
Strom(1984)和Eng等(1985)声称发现软骨发育不全的II型胶原基因异常。如果存在这样的缺陷,则由于玻璃体中存在II型胶原蛋白,可能会导致软骨发育不全的眼部异常。SED先天性更可能是II型胶原蛋白结构缺陷的候选者,因为它是将骨骼发育异常与玻璃体变性和耳聋相结合的显性疾病(对II型胶原蛋白的抗体的实验研究表明,这种胶原蛋白类型存在于中耳); 随后,实际上在SEDC的COL2A1基因中发现了缺陷。Eng等人的报告(1985)之所以在1986年将其撤回是因为“在C. Strom和C. Eng的实验室中生成的指趾被不正确地组合,因此不能用于支持该文章的结论。” Francomano和Pyeritz(1988)在分析49个患病人群和2个多重家庭的基因组DNA时,使用跨越该基因的探针,将COL2A1排除为软骨发育不全的突变位点。在Southern印迹分析中未见大的重排,并且在多重家族中的连锁研究表明软骨发育不良和COL2A1等位基因的不一致遗传。Ogilvie等人以前曾提出过反对与COL2A1连锁的证据(1986)。根据他们的研究,Finkelstein等(1991)结论认为,硫酸软骨素蛋白聚糖核心蛋白(CSPGP)基因座处的突变不会引起软骨发育不良或假软骨发育不良(177170)。
爱德华兹等(1988)评论了在神经纤维瘤病基金会全国会议上的一份报告,该报告涉及2名患有软骨发育不全和神经纤维瘤病的个体(162200),其易位涉及17号染色体的长臂。在这两种情况下,断点均位于与通过连锁研究定位神经纤维瘤病基因;还提到了第三例同时发生的软骨发育不全和神经纤维瘤病。Korenberg等(1989)和Pulst等(1990)通过连锁分析证明了软骨发育不良基因座在人染色体17上神经纤维瘤病-1基因两侧的两组标记之间没有定位(1991)在患有软骨发育不全的婴儿中观察到了产前神经母细胞瘤,并提示软骨发育不全基因可能位于1号染色体的短臂上,而神经母细胞瘤基因座(见256700)位于该染色体上。
通过使用DNA标记的连锁研究,Velinov等(1994)和Le Merrer等(1994)将软骨发育不全和软骨发育不良的基因定位到4号染色体短臂的远端区域(4p16.3)。Francomano等(1994年)同样使用18个具有软骨发育不良的多代家族和该区域的8个匿名二核苷酸重复多态性标记,将ACH基因定位于4p16.3。没有发现遗传异质性的证据。重组家族的分析将ACH基因座定位在D4S43和端粒之间的2.5 Mb区域。
▼ 分子遗传学
一旦软骨发育不全的基因通过连锁分析分配给4p16.3(勒Merrer等人,1994。 ; 沃立诺夫等人,1994。 ; 。Francomano等人,1994),致病突变由候选基因方法鉴定和内报告第一个映射报告的6个月。Shiang等人鉴定了成纤维细胞生长因子受体3(134934)基因的突变(1994年),并由Rousseau等人孤立完成(1994)。FGFR3基因先前已被对应到与ACH基因和亨廷顿病基因相同的区域4p16.3。Shiang等人研究了16条受软骨发育不良影响的染色体中15条的突变(1994)相同,是在cDNA的核苷酸1138(134934.0001)上的G到A过渡。在核苷酸1138处没有G到A转换的唯一其他受ACH影响的染色体4上的突变在此同一位置发生了G到C的转化(134934.0002)。两种突变均导致在成熟蛋白的380位(位于FGFR3的跨膜结构域)中的精氨酸残基取代了甘氨酸。该突变位于CpG二核苷酸中。卢梭等(1994)在所有研究的病例中发现G380R突变:17例散发病例和6例无关家族性病例。由于突变率高,可能已经预测软骨发育不良基因很大,许多突变中的任何一个都可能导致相同或相似的(软骨发育不良)表型。显然不是这样。没有关于患有软骨发育不良的柱头的Wolf-Hirschhorn综合征(194190)患者的报道,这一事实可能表明该表型是由于除单倍机能不全之外的某些机制所致,例如,代表显性负性或功能获得性作用(Shiang等人(1994)和Rousseau等人(1994)的孤立工作 分别在7月29日的《细胞》杂志和9月15日的《自然》杂志上有报道。)
贝勒斯等(1995)发现154个不相关的软骨素中的150个在FGFR3基因的核苷酸1138处具有从G到A的转变(134934.0001),而3个具有从G到C的转变(134934.0002)。全部153个具有gly380-arg取代;在一个个体(非典型病例)中,缺少了gly380-arg取代。FGFR3基因的核苷酸1138是当时发现的人类基因组中最易变的核苷酸。Superti-Furga等(1995)报道了一个患有软骨发育不全的新生儿的病例,其未携带核苷酸1138上的突变,将甘氨酸-380变为精氨酸,但发生了突变,导致附近的甘氨酸被半胱氨酸取代(134934.0003)。
分离并研究了FGFR3基因,寻找亨廷顿氏病基因。发现FGFR3 mRNA在胚胎小鼠组织中的分布比FGFR1(136350)和FGFR2(176943)mRNA 更受限制。在发育中的中枢神经系统之外,发现所有骨的前软骨软骨中都存在最高水平的FGFR3 mRNA,并且在软骨内骨化过程中,在静止的软骨中检测到了FGFR3,但在肥大的软骨中未检测到(Peters等,1993)。)。甘氨酸到精氨酸的取代将对疏水跨膜结构域的结构,功能或两者都有重大影响,并且最有可能对受体的功能产生重大影响。6个ACH纯合子中有5个是G-A过渡纯合子,而6个散发病例中的每一个,包括2个纯合子的亲本,都是1138A等位基因和野生型等位基因的杂合子。胎儿和成年大脑中存在FGFR3转录本(在任何组织中含量最高)这一事实可能与软骨畸形中的大头畸形有关(Dennis等,1961)。
通过交替使用2个不同的外显子,FGFR3编码基因产物的至少2个同工型,所述2个外显子编码第三个免疫球蛋白结构域(IgIII)的后半部分,这主要负责配体结合特异性。亚型优先被各种成纤维细胞生长因子激活。
臀部等(2006)报道了一个荷兰婴儿,患有严重的软骨发育不全,由同一等位基因上的FGFR3基因的2个从头突变引起:常见的G380R突变(134934.0001)和L377R(134934.0027)。等位基因特异性PCR分析证实这2个突变是顺式的。从出生开始,由于上呼吸道阻塞,肺发育不全和子宫颈髓核受压,该患儿出现了严重的呼吸困难,并伴有多次缺氧。他最终成为呼吸机依赖者,并于4个月大时死亡。
霍顿(Horton,2006年)回顾了关于软骨发育不全的基本缺陷性质的研究。在1994年FGFR3突变被确定为软骨发育不全的基础后,注意力转向了该突变如何干扰线性骨生长。FGFR3受体的生化研究与小鼠基因敲除实验相结合,揭示FGFR3是软骨细胞在生长板中增殖和分化的负调节剂,软骨发育不良和相关疾病的突变激活了该受体。因此,它们可以被视为功能获得性突变。
Heuertz等(2006)在25位软骨发育不良和1位软骨发育不良的患者中筛选了FGFR3基因的18个外显子,其中常见突变G380R和N540K被排除在外。作者确定了7个新的错义突变,包括在软骨发育不全患者中的1个(S279C; 134934.0030)。Heuertz等(2006年)指出6个细胞外突变中有4个产生了额外的半胱氨酸残基,并与严重的表型有关。
▼ 诊断
诊断基于典型的临床和放射学特征;对严重软骨发育不良的描述可能是任意的。
导致软骨发育不全的突变数量非常有限且易于检测(1个PCR和1个限制性酶切),为有风险的家庭中父母纯合子的ACH纯合子的产前诊断提供了一种简单的方法。 1138A或1138C等位基因(Shiang等,1994)。Shiang等(1994)表示认为,除了对纯合的ACH胎儿进行高危妊娠筛查外,“禁止对ACH突变进行诊断测试的其他任何应用”。贝勒斯等(1994)在妊娠10周和4天时通过绒毛膜绒毛取样进行了产前诊断,父母双方均患有软骨发育不良。父母和胎儿在更常见的G到A过渡中均显示为杂合子。纯合子软骨发育不全被排除。
▼ 临床管理
在第一届软骨发育不良国际研讨会(Nicoletti等,1988)以及Horton和Hecht(1993)的会议上,对随访和治疗的建议进行了回顾。建议包括:使用针对软骨发育不良的生长曲线测量生长和头围(Horton等,1978);严重狭窄的情况下,应进行仔细的神经系统检查(包括CT,MRI,体感诱发电位和多导睡眠图检查),并进行手术扩大大孔。处理频繁的中耳感染和牙齿拥挤;从幼儿期开始控制肥胖的措施;生长激素疗法(Horton等,1992)(仍处于实验阶段)和四肢骨骼延长;胫骨截骨术或腓骨生长板骨physi切除术可矫正双腿弯曲;腰椎椎管切除术治疗椎管狭窄,通常表现在成年初期;剖宫产分娩软骨发育不全的孕妇;并通过超声波对胎儿进行产前检测。
亨特等(1996年)建议软骨发育不良的儿童应将软骨发育不良的儿童的身高曲线保持在平均体重的1 SD之内。
胡佛峰等(2007年)开发了体重的年龄,从出生到16岁的软骨发育不良儿童的性别特定生长曲线。这些图表是根据对334例软骨发育不良的个体进行的纵向回顾性单观察者队列研究而构建的。研究人员提出,这些图表可以与Horton等人开发的年龄图表结合使用(1978年)和Hunter等人开发的高度图的权重(1996)。
Shohat等(1996)研究了重组人生长激素(hGH)处理对软骨发育不良和软骨发育不良个体的生长速度和比例的影响。他们在24个月内研究了15位个体,包括6个月的观察,12个月的hGH治疗(0.04 mg / kg /天)以及治疗后6个月的生长率测定。与治疗前(4.0 +/- 1.0 cm /年,P小于0.01)和治疗后时期(3.1 +/- 1.3 cm; P小于0.001)。在4名患有软骨发育不良的儿童中,hGH治疗期间在治疗前和治疗后的生长速率分别为7.0 +/- 2.4 cm /年和4.9 +/- 1.5 cm /年。在achondroplasts中 只有较低部分的增长率显着增加(从1.1 +/- 1.6厘米/年增加到3.1 +/- 1.2厘米/年,P小于0.02)。出乎意料的是,这种治疗似乎对四肢的影响似乎不比对躯干生长的影响小,因此,在治疗的1年中,不会增加身体的比例。
沃特斯等(1995)研究了软骨发育不全阻塞性睡眠呼吸暂停的治疗结果。治疗包括腺扁桃体切除术,减肥和鼻罩持续气道正压通气(CPAP)。他们观察到睡眠结构紊乱的测量得到改善,并且神经功能得到改善的一些证据。
Weber等(1996年)研究了重组人生长激素治疗6例2至8岁青春期前软骨发育不良儿童的效果。给他们皮下给予0.1 IU / kg /天的GH剂量。在治疗的一年中,三名患者的生长速度从1.1厘米/年增加到2.6厘米/年,而其他患者均未发现变化。除2名患者的骨龄略有增加外,试验期间未观察到任何副作用。他们的发现证实了对GH治疗反应的个体差异。
霍顿(Horton,2006)回顾了软骨发育不良研究的里程碑。随着软骨发育不良的分子发病机理的出现,人们的兴趣转向了旨在抵消过度活跃受体影响的疗法。一种策略涉及为FGFR3酪氨酸激酶选择化学抑制剂。第二种依赖阻断抗体来干扰FGF配体与FGFR3的结合(Aviezer等,2003)。第三种可能性涉及Yasoda等人证实的C型利钠肽(CNP; 600296)(2004)下调生长板软骨细胞中FGF诱导的MAP激酶信号通路的激活,并抵消小鼠软骨发育不良的影响。
在软骨发育不全和圆锥体不典型增生(187600)中,椎管和大孔大管狭窄可引起严重的神经系统并发症。松下等(2009年)观察到在纯合子软骨发育不全和蜕膜不典型增生的人类病例以及软骨发育不良的小鼠模型中,脊柱和颅底过早发生软骨病。在这两个物种中,早熟软骨闭合与增加的骨形成有关。小鼠中Fgfr3的软骨细胞特异性激活可导致合软骨过早闭合,并增强了合软骨周围的成骨细胞分化。软骨细胞中的FGF信号传导增加了骨形态发生蛋白(Bmp)配体(例如BMP7、112267)mRNA表达,并降低了Bmp拮抗剂(例如头蛋白,602991)以MAPK依赖性方式表达mRNA,提示Bmp信号传导在增加的骨形成中起作用。增强的骨形成将加速骨化中心的融合并限制软骨内骨的生长。作者提出,杂合性软骨发育不全患者的椎管和孔大口狭窄可能通过闭合性早熟症发生。如果是这种情况,那么对于软骨发育不全的这些并发症,任何促进生长的治疗都必须在闭合软骨病的时间之前进行。
C型利钠肽(CNP)通过抑制促分裂原活化蛋白激酶(MAPK)的途径拮抗FGFR3下游信号。Lorget等(2012)报道了39个氨基酸的CNP类似物(BMN 111)的药理活性,由于其对中性内肽酶(NEP; 120520)消化的抵抗性,具有延长的血浆半衰期。在软骨发育不全的人类生长板软骨细胞中,Lorget等(2012)证明细胞外信号调节激酶1(ERK1; 601795)和2(ERK2; 176948)的磷酸化减少,证实该CNP类似物抑制FGF介导的MAP激酶活化。同时,Lorget等(2012年)分析了Fgfr3(Y367C / +)小鼠的表型,并显示了该小鼠模型中与软骨发育不相关的临床特征的存在。Lorget等(2012年)发现,在Fgfr(Y367C)杂合小鼠中,用CNP类似物治疗可显着恢复骨骼生长。他们还观察到,骨骼的轴向和附件长度增加,与侏儒症相关的临床特征有所改善,包括颅骨变平坦,咬伤减少,胫骨和股骨变直以及生长板缺损的矫正。Lorget等(2012年)得出的结论是,他们的研究结果提供了概念证明,即NNE耐药CNP类似物BMN 111可能使患有软骨发育不良和软骨发育不良的个体受益。
Savarirayan等(2019)报道了每天一次皮下注射对35例5至14岁的软骨发育不全的儿童进行的vosoritide(C型利尿钠肽的生物类似物)的2期剂量确定和扩展研究的结果。所有患者均发生不良事件(最常见的是注射部位反应),而35名患者中有4名发生了严重不良事件。6例患者因不良事件而停止治疗。在治疗的前6个月中,观察到剂量年增长速度的剂量依赖性增加,直至剂量为15 mcg / kg,在剂量为15和30 mcg / kg的情况下,观察到持续增长长达42个月。 。15 mcg / kg剂量之间的疗效或安全性没有差异,这支持选择较低剂量进行进一步评估。
▼ 人口遗传学
由于误诊,对软骨发育不良的患病率的早期估计无疑是不正确的。例如,华莱士等(1970)报道了2例女性同胞为软骨发育不全的例子。均在新生儿期死亡,除软骨营养不良,中心性唇疱疹,肺发育不良和脑积水外,均显示。如果没有影像学检查,就不可能确定这种疾病的性质,但肯定不是真正的软骨发育不全。Jeune窒息性胸肌营养不良(208500),斜方肌侏儒症(187600)和软骨发育不全都可能。
使用现代诊断标准,Gardner(1977)估计突变率为0.000014。Orioli等(1986)报道了349,470例出生(活产和死产)中骨骼发育异常的频率。软骨发育不全的患病率在0.5至1.5 / 10,000例之间。突变率估计为每代每配子1.72至5.57 x 10(-5)。所述范围是在某些情况下诊断不确定性的结果(体态不典型增生/软骨发育不全的患病率在0.2至0.5 / 10,000例之间。成骨不全症的患病率是0.4 / 10,000例。仅发现1例灾难性发育异常。)在丹麦的Fyn县,安德森和豪格(1989)通过研究14岁以下出生的所有儿童,确定了广泛性骨发育不良的患病率。他们称其为“出生时点流行”的指趾表明,软骨发育不全不如普遍认为的(每100,000人中有1.3例),而成骨不全症(21.8),多发性phy骨发育不良(9.0),软骨发育不良(6.4)。 ,骨质疏松症(5.1)和斜方不典型增生(3.8)更为常见。斯托尔等(1989年)发现每代配子的突变率为3.3 x 10(-5)。在西班牙,Martinez-Frias等人(1991年)发现每10万活产中的软骨发育不全的频率为2.53。常染色体显性畸形综合症的总患病率为每100,000例活产12.1。
Waller等使用美国7个基于人口的出生缺陷监测计划的数据(2008年)估计了软骨发育不全和断肢不典型增生的患病率,并提供了父辈年龄与这些状况之间关联的数据。软骨发育不良的患病率为每10,000例活产0.36至0.60(1 / 27,780-1 / 16,670例活产)。叠光不典型增生的患病率为每10,000例活产0.21至0.30(1 / 33.330-1 / 47,620)。数据表明,垂体不典型增生的发病率是软骨发育不良的三分之一至二分之一。这些条件在整个监测程序中的流行率差异与随机波动一致。在得克萨斯州,与年轻父亲相比,年龄在25-29,30-34,35-39岁以及40岁以上的父亲的后代软骨发育不良和不育症的发生率显着增加。
▼ 历史
具有历史意义的是哈迪-温伯格法律界的威恩伯格(Weinberg,1912年)在Rischbieth和Barrington收集的数据中指出,零星案件的发生率往往比最后一胎高。丹麦的Morch(1941)和Hobaek(1961)进行的研究是全面人口研究的早期实例。
Kozma(2006)描述了一些古埃及侏儒症的最早生物学证据,其历史可追溯到公元前4500年。由于炎热,干燥的气候以及自然和人为的木乃伊化,埃及是软骨发育不全的主要考古信息来源。
Bernal和Briceno(2006)研究了大约2500年前存在于当今哥伦比亚和厄瓜多尔边界的Tumaco-La Tolita文化的陶器,并描述了由头部,胸部和手臂组成的小雕像。颅骨变形,前额突出,鼻梁低,下颌前突和颈短,提示软骨发育不全。Bernal和Briceno(2006)认为这些人工制品是最早的疾病艺术表现形式之一。
Kozma(2008)对古埃及的骨骼发育异常,特别是软骨发育不良进行了详细的历史回顾。