靶向辅助风云起,转化热点群雄论:一文了解NSCLC治疗进展

2020年9月13日,“瑞行千里,成就肺凡”菁睿学院全国会在河南开封和线上同步召开,大会有幸邀请到河南省人民医院仓顺东教授、河南大学淮河医院卢红教授、三门峡市中心医院田春桃教授担任会议主席,协同全国肺癌领域多位专家学者,聚焦非小细胞肺癌(NSCLC)靶向/免疫治疗和科研转化的热点话题——如EGFR突变阳性NSCLC患者术后辅助治疗、晚期一线治疗的优化和进展,基于统计学视角的围手术期NSCLC临床研究的盘点,以及免疫治疗中肿瘤突变负荷(TMB)的转化研究和科研问题,共同交流了最新前沿进展。
仓顺东教授在主席团开场致辞中表示:“随着以奥希替尼为代表的第三代EGFR-TKI进入临床,EGFR突变阳性患者的靶向治疗,已经在晚期、早期辅助、新辅助等多个领域全面铺开,本次会议通过顶尖专家线上讲演的方式,给临床医生更新知识提供了一个好机会。”
卢红教授在致辞中表示:“新冠肺炎疫情推动了线上学术活动,为地区性专家齐聚一堂,与全国学术精英交流,讨论NSCLC全程管理的新知识、新进展提供了难得的机会。EGFR突变靶向治疗开启了肺癌精准诊疗,在不同的时代,靶向治疗有着不同的定位,新的学术进展给患者带来更多延长生存的机会。”
田春桃教授则进一步指出:“NSCLC近年来的治疗进步迅速,在一线、二线、三线以及免疫治疗方面都有可喜的进展,而在科研思路方面临床医生同样需要适应这一趋势,了解研究设计和统计学知识是非常重要的。”
钟文昭教授:
NSCLC辅助治疗的进展和思考
广东省人民医院的钟文昭教授结合2020年美国临床肿瘤学会(ASCO)年会的最新进展,分析了EGFR突变阳性早期肺癌的术后辅助治疗进展和临床价值。
(1) 从辅助化疗到辅助靶向
约30%的NSCLC患者初诊时有机会接受手术治疗,但IB-IIIA期患者复发或死亡风险仍然较高。IALT/JBR10/ANITA三大经典临床研究,确立了术后辅助含铂化疗显著的生存获益和辅助化疗的地位,但真实世界数据显示,仅有约30%的患者能完成辅助化疗,比例约为临床试验中的一半,从而明显影响了患者的预后,临床亟需新的术后辅助治疗手段。
各种EGFR-TKI在晚期一线治疗的成功,以及三代TKI奥希替尼疗效的显著提升,提示了EGFR突变阳性NSCLC患者辅助靶向治疗的可能性,但早期临床探索并非一帆风顺,由于研究存在EGFR突变状态筛选、患者分期、辅助治疗用药方案等问题,吉非替尼的BR19研究、厄洛替尼的RADIANT研究均未体现EGFR-TKI辅助治疗的疗效优势。
(2)辅助靶向治疗的探索之路
2017年ASCO年会上公布的ADJUVANT/CTONG 1104研究,首次确立了EGFR-TKI辅助治疗的获益。ADJUVANT研究在设计上吸取了此前的经验,专门纳入EGFR突变阳性,且为术后相对高危的患者(II-IIIA/N1-N2),而治疗方案使用TKI单药辅助,不再联合化疗。
ADJUVANT研究初步结果显示,研究中吉非替尼组无病生存期(DFS)达到28.7个月,显著优于对照组长春瑞滨+顺铂(VP)的18.0个月,2020年ASCO年会公布的80个月随访数据,更新DFS数据为30.8个月 vs 19.8个月,吉非替尼组仍体现显著获益。
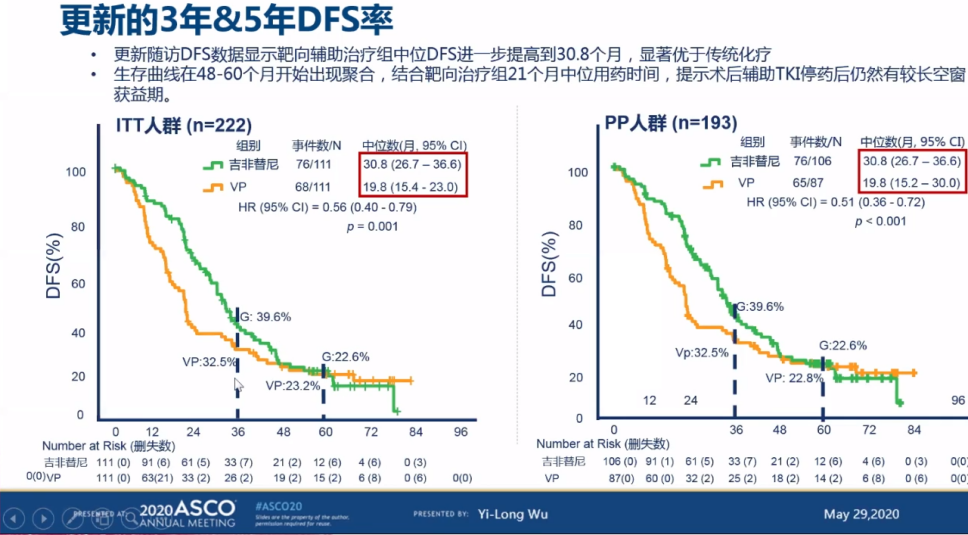
而在ADJUVANT研究最终成熟的总生存期(OS)数据方面,吉非替尼组和VP对照组分别为75.5个月和62.8个月,吉非替尼组的OS延长了约13个月,体现获益趋势,但最终未达统计学显著差异,OS双峰趋势可能与两组在病情进展后的治疗模式差异有关。
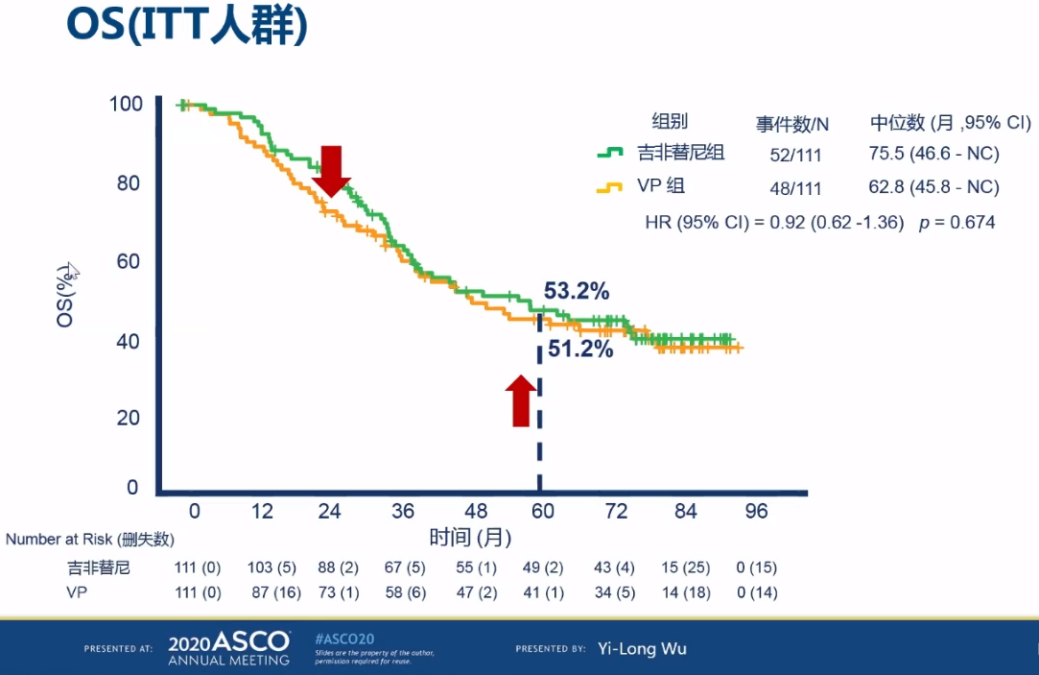
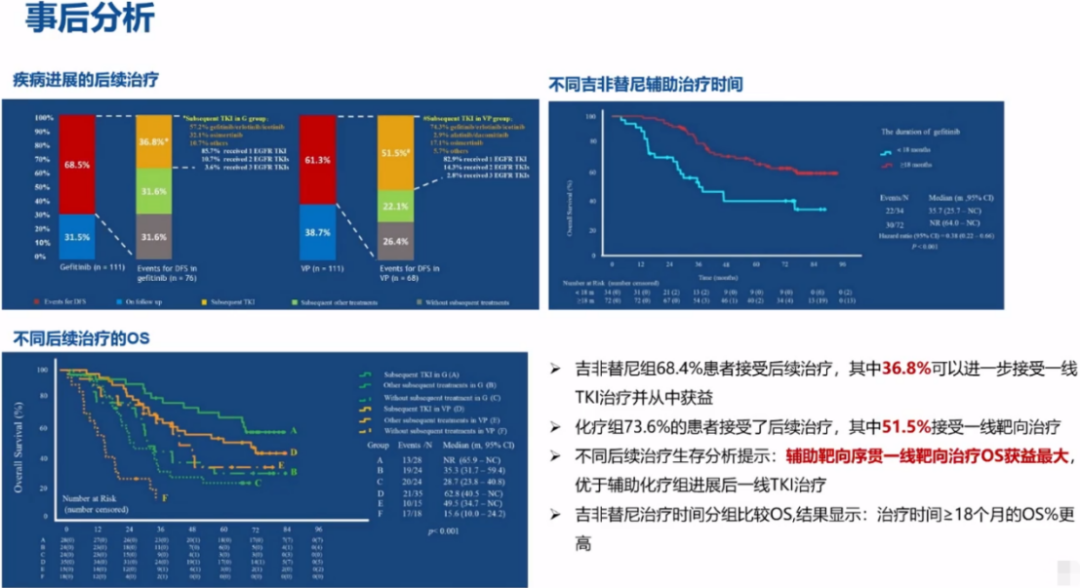
Post-hoc分析显示,吉非替尼组患者在疾病进展后有36.8%仍可以接受EGFR-TKI再次治疗,而VP化疗组接受一线靶向治疗的比例也仅为51.5%,且吉非替尼组后续治疗的客观缓解率(ORR)、疾病控制率(DCR)均优于化疗组。
综上所述,ADJUVANT研究是完全切除的IIB-IIIA NSCLC临床研究中疗效最好的研究之一,确立EGFR-TKI辅助治疗对R0切除、N1-N2期、EGFR突变NSCLC患者的治疗价值。奥希替尼辅助治疗ADAURA研究的成功,则将进一步推广EGFR-TKI辅助治疗的应用。
(3)三代TKI提前入局,ADAURA研究数据势不可挡
ADAURA研究在设计上汇总了RADIANT、ADJUVANT等多项研究的经验,如允许对照组患者接受术后辅助化疗改善OS获益,研究主要终点定为II-IIIA期患者的DFS,而相对低危的IB期患者虽然同样入组研究,但将单独进行亚组分析等,研究预设DFS HR为0.70。
ADAURA研究计划的奥希替尼治疗时间为3年,但基于其完全超出预期的疗效,研究目前已提前揭盲,并于2020年ASCO年会上公布初步疗效数据:在主要终点——II-IIIA期患者的DFS上,HR达到惊人的0.17,是TKI辅助治疗目前已知最好的HR值。
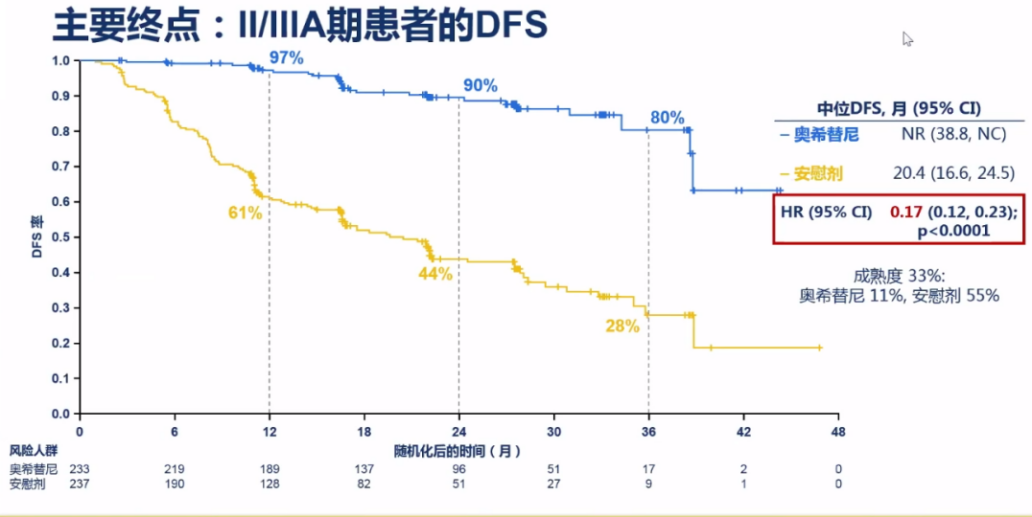
在研究次要终点,即IB-IIIA期患者的DFS方面,HR同样达到0.21。预设亚组分析显示,辅助化疗对奥希替尼的获益影响微弱,而IB期患者相对II-IIIA期患者获益相对受限,但奥希替尼治疗组患者,未出现对照组随分期获益的“线性下降”趋势。
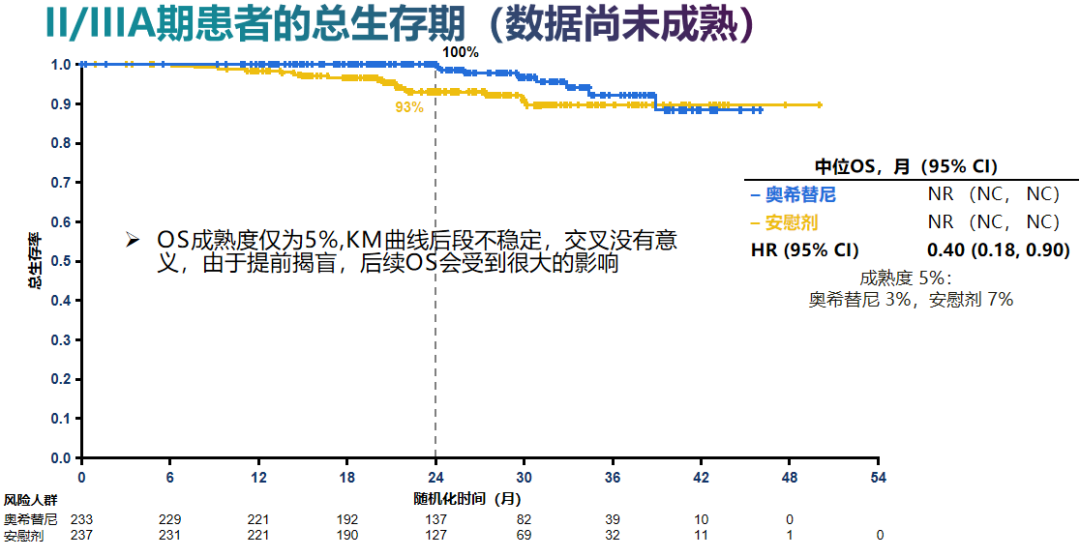
奥希替尼组患者的2年OS率达到100%,与安慰剂组相比患者死亡风险下降了60%(HR 0.40),但这一OS数据成熟度仅5%,且由于研究提前揭盲,允许对照组患者交叉使用奥希替尼,最终的中位OS数据和获益还有待进一步随访。
基于良好的疗效和安全性,奥希替尼有望改变IB/II/IIIA期EGFR突变阳性NSCLC患者辅助治疗的临床模式,即将召开的欧洲肿瘤内科学会(ESMO)年会上,将公布ADAURA研究中奥希替尼预防患者中枢神经系统(CNS)转移方面的数据,有望进一步明确奥希替尼治疗的价值。
但随着靶向治疗、免疫治疗等各种手段的不断发展,辅助治疗的DFS获益能否真正转化为OS获益,已不能单纯以化疗时代的经验推测,也是ASCO年会讨论中争议较大的焦点。EGFR-TKI辅助治疗虽然已被中国临床指南推荐,但未来仍有许多要解决的现实问题。
燕翔教授:
EGFR突变阳性晚期NSCLC治疗新思考
解放军总医院的燕翔教授对近年来EGFR突变阳性晚期NSCLC靶向治疗的进展进行了分析,并在相关研究数据的解读方面进行了一系列点评。
(1)EGFR-TKI联合治疗持续火热,模式多样
自2018年来,EGFR突变阳性晚期NSCLC的靶向治疗进展,除奥希替尼的FLAURA研究和达可替尼的ARCHER 1050研究为TKI单药治疗外,多数为EGFR-TKI联合治疗,如2020年ASCO年会公布的NEJ026、SINDAS研究,及此前的RELAY、CTONG 1509研究等。目前联合治疗的探索方向包括化疗、放疗、抗血管生成TKI,及EGFR-TKI之间的联合。
(2)EGFR-TKI联合化疗,疗效背后存在问题
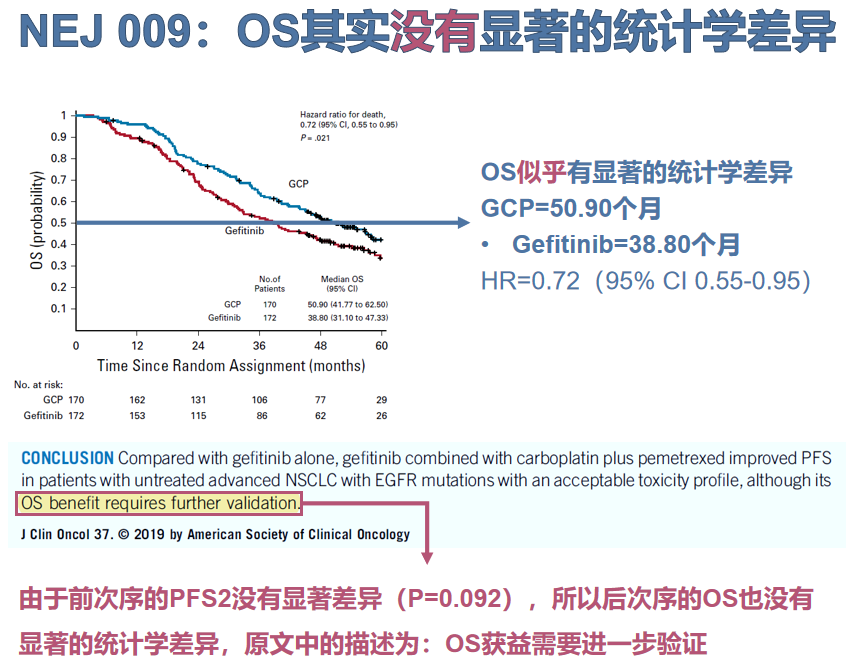
临床III期的NEJ009研究,首次证实在一线治疗中应用吉非替尼+含铂双药化疗,对比吉非替尼单药的无进展生存期(PFS)获益(20.93个月 vs 11.17个月,HR 0.49),但PFS2未达显著获益。
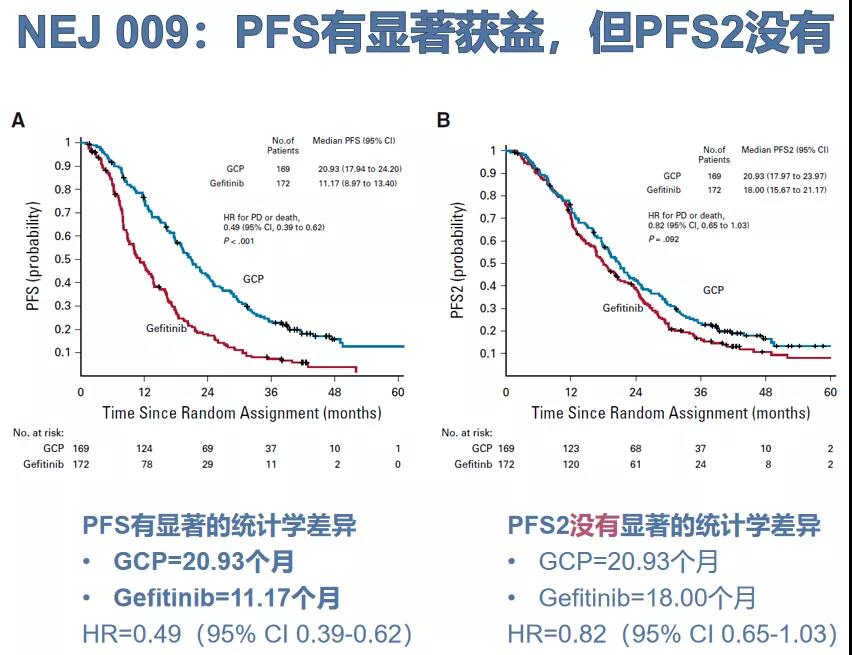
由于NEJ009研究的统计学设计为序贯多重检验,按PFS→PFS2→OS进行分析,因此在PFS2未达统计学显著差异的状态下,分析OS获益并无统计学意义,且后线治疗是否使用奥希替尼,对患者生存期有明显影响。吉非替尼+含铂双药化疗的3级以上不良事件发生率高达65.1%,较对照组(31.4%)翻倍,也会影响其临床应用。
(3)联合抗血管生成治疗,三代EGFR-TKI或实现破局
EGFR-TKI与抗血管生成类TKI联合治疗,是近年来临床研究数据较多的领域。这一联合治疗模式存在理论上的增效机制,如抗血管生成TKI可抑制新生血管的形成,促进肿瘤正常化,从而改善EGFR-TKI在肿瘤内的分布,并减轻肿瘤微环境的免疫抑制,提升疗效等。
厄洛替尼+贝伐珠单抗是EGFR+抗血管联合治疗中探索较多的组合,2011年临床III期BeTa研究入组30例EGFR突变阳性患者的疗效,最早提示该组合治疗或存在获益,但临床II期JO25567研究显示,厄洛替尼+贝伐珠单抗治疗仅存在PFS获益,无OS显著获益。
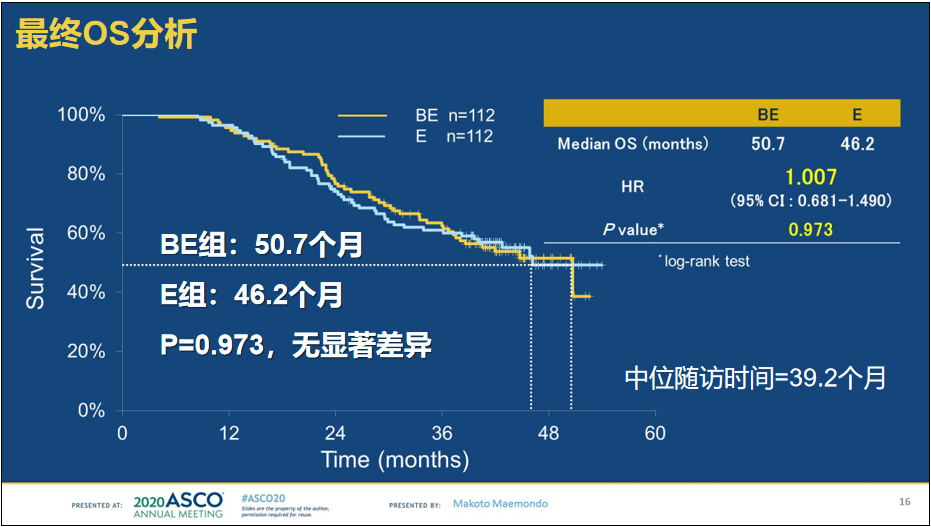
2020年ASCO年会公布了临床III期NEJ026研究的最终数据,结论与JO25567研究一致,厄洛替尼+贝伐珠单抗治疗仍仅有PFS获益,无PFS2和OS显著获益。这与患者后线治疗选择,尤其是奥希替尼等三代EGFR-TKI关系密切,联合治疗的OS获益可能有待真实世界研究证实。非预设性的Post-hoc分析则提示,联合治疗可能更适合L858R突变患者亚组。
仍在进行的中国CTONG 1509研究,PFS获益趋势与NEJ026研究相似(18个月 vs 11.3个月,HR 0.55),但分析显示研究中联合治疗组T790M耐药突变的发生率较低,可能会影响奥希替尼后线应用的获益。使用雷莫芦单抗+厄洛替尼方案的RELAY研究,PFS数据与以上两项研究相似(19.4个月 vs 12.4个月,HR 0.59),且未影响T790M发生率。
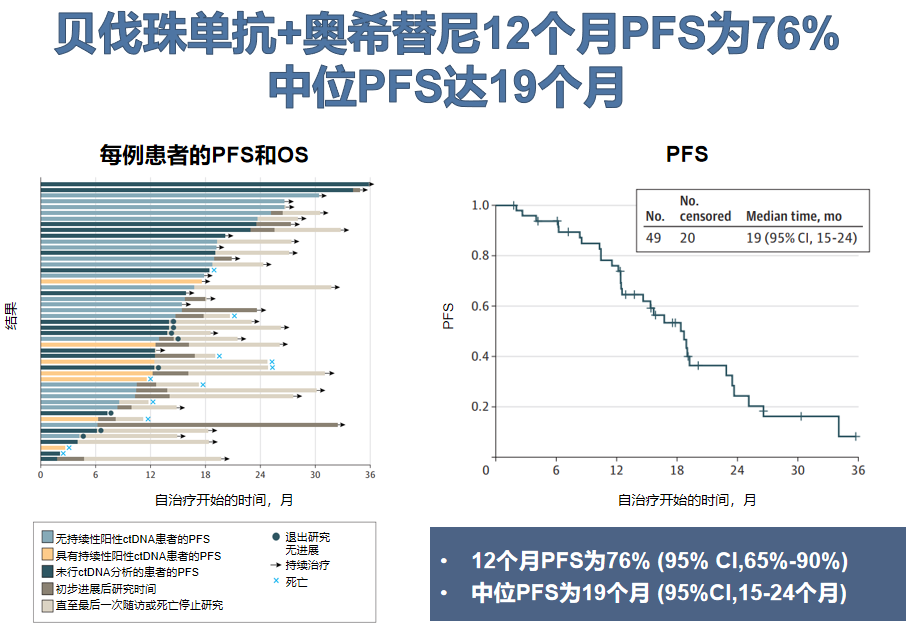
以上应用一代EGFR-TKI联合抗血管生成药物的研究,均未带来或尚未报告OS显著获益,而三代EGFR-TKI奥希替尼有望改变局面。2020年一项临床I/II期研究的初步数据显示,奥希替尼+贝伐珠单抗联合治疗的中位PFS达19个月,12个月患者PFS率为76%,总缓解率达到80%,其中CNS缓解率达到100%,体现奥希替尼在穿透血脑屏障方面的优势。
(4)EGFR-TKI联合放疗,最优治疗模式仍待确定
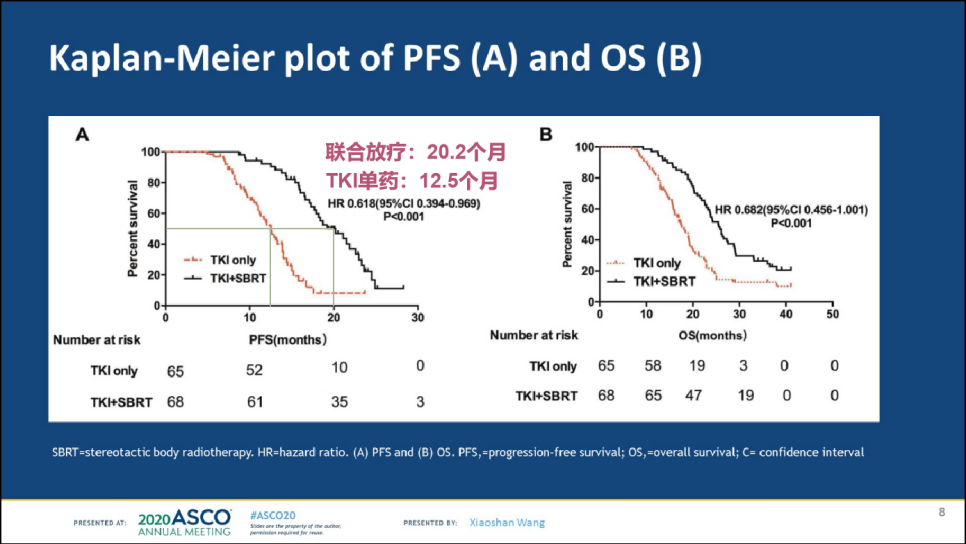
对转移模式为寡转移的EGFR突变阳性NSCLC患者,放疗是常用的局部治疗手段。2020年ASCO年会公布了中国的临床III期SINDAS研究中期分析结果(Abstract #9508),评价立体定向体部放疗(SBRT)联合一代EGFR-TKI,对寡转移(转移灶≤5个)患者的疗效。
在PFS和OS数据上,SBRT+EGFR-TKI治疗均较EGFR-TKI单药有显著获益,且并未显著增加严重不良事件的发生率,但联合治疗组的3级以上肺炎发生率相对较高(6例 vs 2例),是临床实践中值得关注的问题。且该研究未入组脑转移患者,基线特征方面TKI单药组存在较多的20号外显子插入突变患者,一定程度上影响了疗效,二线治疗选择也有待公布。
(5)跨代联用,EGFR-TKI治疗最新增效模式
2020年ASCO年会上公布了一项在一线治疗中联合使用奥希替尼+吉非替尼的临床I/II期研究数据(Abstract #9507),该联合模式的基础与两种TKI的耐药模式有关,吉非替尼可针对与奥希替尼耐药有关的C797S突变,而奥希替尼可破解一代TKI常见的T790M突变。
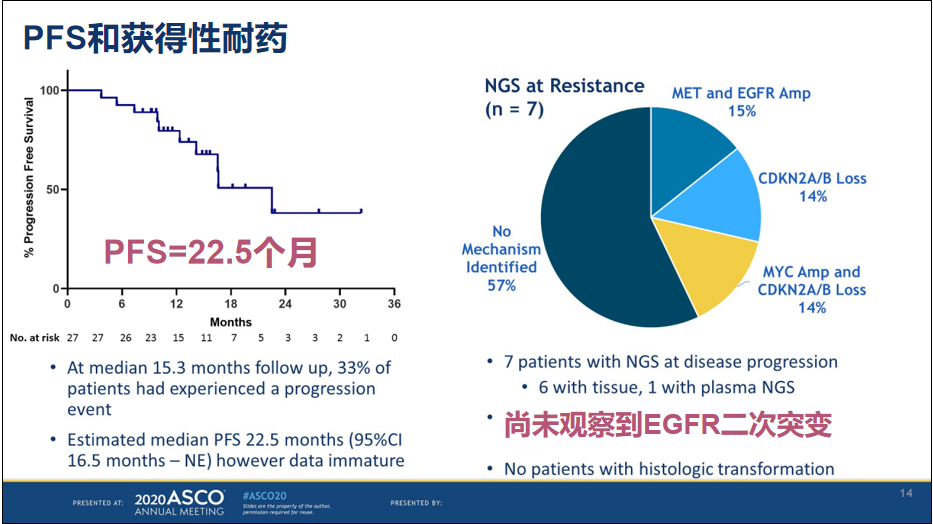
该研究共治疗了27例患者,中位PFS达22.5个月,ORR为88.9%,且治疗的安全性较好,仅有29.6%的患者报告≥3级治疗相关不良事件。研究中88%的患者血浆EGFR突变在两周内被快速、完全清除,而血浆EGFR突变迅速转阴与患者预后更好有关。
对7例病情进展患者进行NGS检测的结果,均未检出C797S、T790M等EGFR二次突变,提示奥希替尼+吉非替尼一线治疗,有望提升疗效并克服EGFR依赖性耐药,但结论有待进一步随访和大样本研究证实。
(6)冷思考看清EGFR靶向治疗发展趋势
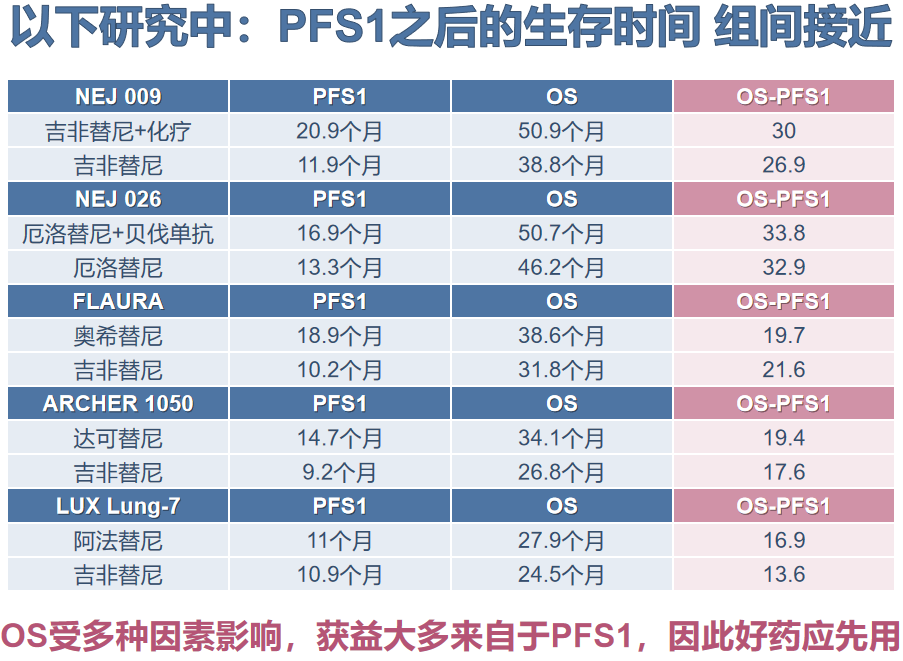
Del19和L858R突变患者的治疗最优模式目前临床争议较大。单药治疗的FLAURA研究,联合治疗的NEJ026等研究的Post-hoc分析,均未体现两类患者的OS差异。PFS数据的Post-hoc分析提示,Del19患者奥希替尼治疗获益显著,而L858R患者可能更适合厄洛替尼+贝伐珠单抗或奥希替尼单药治疗,但非预设性亚组分析的结论应谨慎看待。
此外由于EGFR突变阳性晚期患者的OS受到后线治疗的显著影响,PFS在指导治疗中的价值应被进一步重视,即“及早应用较好治疗方案”。由于目前的EGFR-TKI靶向联合治疗多使用一代TKI,且OS获益均不显著,未来临床研究应尽早转向“三代TKI+X”的探索中,积极探索奥希替尼等新型TKI,联合放疗/化疗/抗血管或是EGFR-TKI跨代联用的价值。
上半场Workshop分组讨论
在会议上半场的Workshop讨论与汇报环节,焦作市人民医院皇甫娟教授、郑州人民医院单国用教授、南阳医专第一附属医院杨秀丽教授、河南省人民医院杨红杰教授和贵州省人民医院张程教授等多位专家,围绕上半场报告的相关内容与讲者进行了精彩的讨论:
1. EGFR突变阳性患者的围手术期靶向治疗写入中国指南相对较晚,因此还不能确定最优用药时间或方案,但基于ALK突变患者靶向辅助治疗的经验,可以认为EGFR-TKI辅助治疗的效果优于含铂化疗,部分患者可通过TKI辅助治疗实现长期生存,ADAURA等研究将进一步推广和扩大靶向辅助治疗生存获益。在用药方案上除根据TNM分期筛选高危患者,对其延长治疗时间或加大治疗强度外,还可结合病理学、分子检测结果进行方案调整。
2. ADJUVANT、EVAN两项研究的数据显示,在EGFR-TKI辅助治疗出现病情复发后,患者仍可以选择EGFR-TKI或化疗作为后续治疗,但由于两项研究样本量均较小,暂时还不能提示相对较优的治疗模式,临床实践中可以根据药物本身的疗效数据进行选择。如对吉非替尼治疗后的患者,可通过是否存在T790M突变,判断应用奥希替尼的必要性。
3. 目前EGFR-TKI的靶向联合治疗方案,虽然在临床试验中均未体现有统计学意义的显著OS获益,但与EGFR-TKI单药治疗相比仍存在数值上的OS获益趋势。如厄洛替尼+贝伐珠单抗多项III期研究的中位OS达到47-50个月,优于单药TKI历史OS数据的38个月,试验未达显著获益可能与统计学因素,如样本量不足有关,因此并不影响临床实践对一部分患者尝试应用联合治疗,且真实世界数据也能对联合治疗的价值提供更多视角和数据。
4. 基于FLAURA等现有研究数据,奥希替尼等三代EGFR-TKI一线治疗的耐药机制非常复杂,目前推荐对符合条件的患者尽量进行NGS检测,尝试明确耐药的“主要驱动突变”,如EGFR-C797S/HER2/c-MET等。相关靶点治疗取得实质性进展,则患者应及早使用新药,但许多患者并不存在“主要驱动突变”,只能选择原有的化疗。而由于EGFR仍是耐药后患者肿瘤的主要驱动突变,肿瘤微环境抑制性较强,免疫治疗的应用空间目前非常有限。
梁文华教授:
围手术期EGFR-TKI辅助治疗临床研究盘点
广州医科大学附属第一医院的梁文华教授从统计学角度,对围手术期EGFR-TKI辅助治疗相关的多项临床研究进行了解读。
(1)围手术期TKI辅助治疗的必要性
2008年发表的LACE-meta分析,确立了术后辅助化疗的价值,但该分析同样显示辅助化疗的获益相对有限,5年的DFS和OS绝对获益仅为5.8%和3.9%,化疗难以区分优势人群,化疗本身ORR较低、副作用导致的治疗周期有限都是导致这一现象的原因。
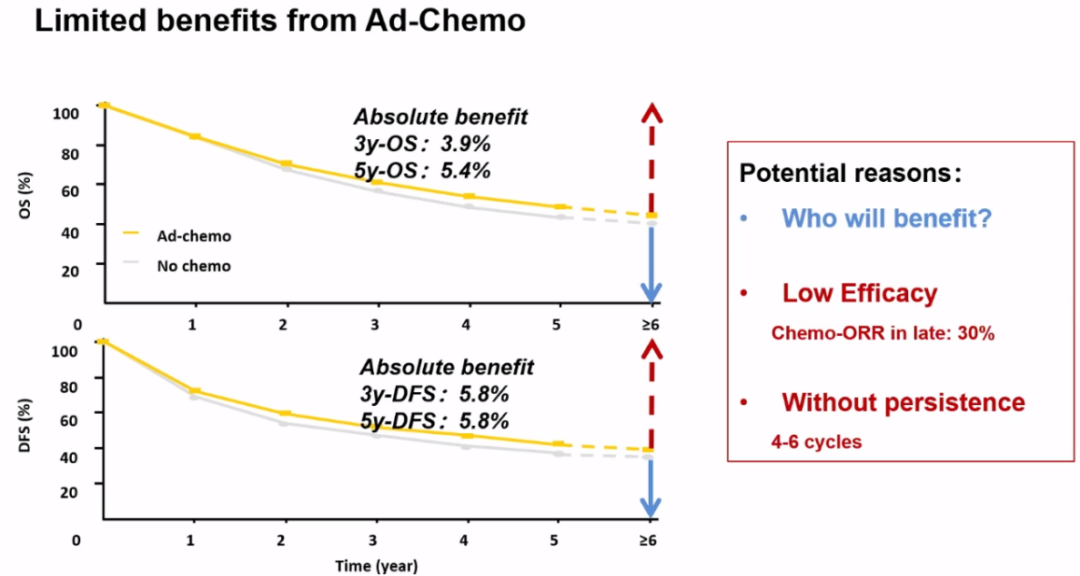
临床分期预测、基因位点模型、液体活检等手段,有望使辅助化疗的使用进一步精细化,但目前尚无生物标志物提示优势人群。对EGFR突变阳性的患者,EGFR-TKI已在晚期患者的治疗中体现明显优势,但辅助TKI治疗相比辅助化疗在理论上的优势,仍有待临床研究证实。
(2)EGFR-TKI辅助治疗的不同探索路径
由于指南推荐的差异,欧美国家对EGFR-TKI辅助治疗的临床研究探索,往往是接续在术后辅助化疗后使用EGFR-TKI,如知名的RADIANT研究,EGFR突变阳性患者亚组的DFS较安慰剂组延长近1.5年,该结果也得到一项中国研究证实,且DFS获益可转化为OS获益。奥希替尼的ADAURA研究同样沿用了这一设计思路,交出了非常优秀的疗效数据。
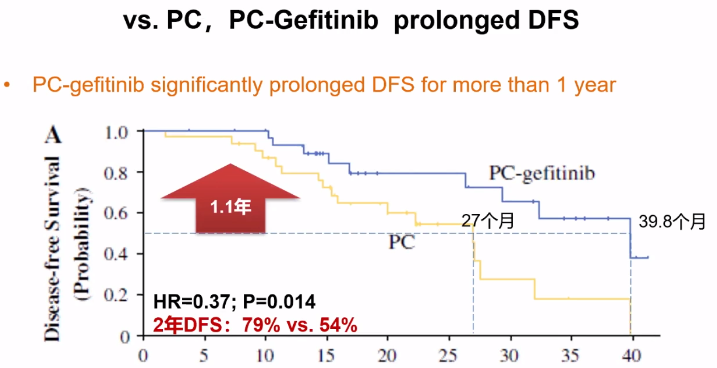
与欧美研究不同,亚太地区临床研究主要采用“做减法”思路,直接对比EGFR-TKI辅助治疗与辅助化疗的疗效差异,评价EGFR-TKI辅助治疗能否替代化疗。ADJUVANT、EVAN等研究已经显示,EGFR-TKI辅助治疗的DFS获益可转化为OS获益,ADJUVANT研究的Post-hoc分析显示,辅助靶向序贯一线靶向治疗的患者OS获益相对最大。
虽然东西方研究思路不同,但基于以上研究的较好疗效数据,2019年的EGFR突变肺癌术后辅助治疗专家共识,已经确立了EGFR-TKI辅助治疗不可或缺的地位,其中对II-IIIA期患者首选TKI辅助治疗,而IB期患者TKI辅助治疗则为可选项。近期国产一代TKI埃克替尼的临床III期研究EVIDENCE也已公布阳性结果,相关适应症有望迅速在国内获批。
(3)围手术期TKI治疗多项问题仍存
虽然EGFR-TKI辅助治疗的地位已经确立,但临床仍有多个问题争议较大,如TKI辅助治疗的定位,辅助治疗的使用时间,以及辅助化疗的定位等。
在TKI辅助治疗的定位上,争议主要集中在“辅助治疗”和“挽救治疗”的区别。及早应用EGFR-TKI,能够争取到患者更高的治愈机会,即使不能实现治愈,EGFR-TKI相对化疗也能延迟癌细胞的进化速度,为后线治疗争取机会。部分医生或患者认为,辅助治疗复发转移后患者即处于TKI耐药状态,但这属于认知误区,现有临床证据并不支持这一观点。
辅助治疗的使用时间同样是争议较大的课题,ADJUVANT研究显示,多数患者在吉非替尼停药后1年出现复发,而治疗1年内并无患者出现耐药。因此ADAURA研究将奥希替尼的治疗时间延长至3年,进一步延长治疗时间,可能为患者带来更大的获益。
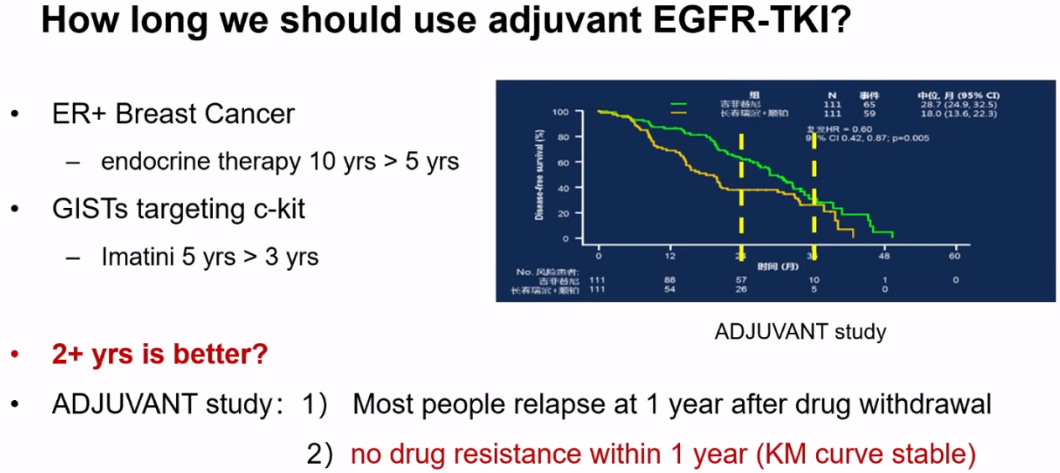
在ADAURA研究的奥希替尼治疗组中,辅助治疗的实际获益微弱,安慰剂对照组中无辅助化疗患者的DFS达到33.1个月,比辅助化疗患者的22.3个月更高。中国的ICAN等真实世界研究,同样显示辅助化疗患者的DFS相对更短。
这一现象可能与辅助化疗的证据主要来自欧美临床研究有关,中国EGFR突变患者是否需要辅助化疗,有待中国随机对照试验或真实世界研究证实,近期启动的全国多中心真实世界研究ADDRESS,有望进一步明确EGFR-TKI辅助治疗和辅助化疗对中国患者的优劣。
段建春教授:
TMB的探索——转化研究和科研思路分享
中国医学科学院肿瘤医院的段建春教授围绕免疫治疗中较热门的生物标志物TMB,对相关的转化研究和科研思路进行了解读。
(1)应运而生,TMB成为免疫治疗热点标记物
转化医学打破了基础研究与药物研发、临床医学之间固有的屏障,把基础研究的知识和成果快速转化为临床上的诊治新方法,如在EGFR突变肺癌的靶向治疗中,IPASS研究就是关键的转化研究,确立EGFR突变状态作为EGFR-TKI的疗效预测因素。
随着部分患者能从免疫治疗中长期获益,即“长尾效应”的发现,肿瘤免疫治疗也迅速迎来大发展的时代,但如何扩大获益群体是制约其发展的最大瓶颈,目前解决这一问题的途径,主要是采用免疫联合治疗扩大适用范围,以及通过生物标志物精准定位适合人群。
已被提出的免疫治疗生物标记物包括PD-L1表达水平、高度微卫星不稳定性(MSI-H)/错配修复缺陷(dMMR)、TMB等,其中TMB与免疫治疗疗效的关系最早在黑色素瘤中被发现,此后又得到多癌种、大样本的许多临床研究证实,如KEYNOTE-189/042等,TMB主要与PD-1/L1抑制剂单药治疗效果有关。而现有的TMB检测,在临床治疗中大规模应用也存在一些问题,除TMB对联合治疗的预测效果有限外,TMB对肿瘤组织的样本量和质量要求都比较高,如在Checkmate227研究中,有42%的标本不符合TMB检测要求。
(2)从临床需求出发,推动新型TMB检测手段
由于现有TMB检测存在的问题,从血液中检测TMB,即bTMB预测免疫治疗的疗效,也是临床探索的方向之一。血液检测目前主要采用NGS Panel来检测TMB,虽然这一手段在靶向治疗中应用较多,经验丰富,但也需要针对免疫治疗的特点,在计入突变的种类、TMB计算、TMB-H的Cutoff值等多方面进行调整。
B-F1RST等多项国内外转化研究显示,在根据免疫治疗特点进行相应调整后,bTMB检测能够预测免疫治疗单药的PFS疗效,但尚不能预测OS,这可能与bTMB-H人群的最大体细胞突变丰度(MSAF)水平更高有关,因此bTMB还可以进一步优化。
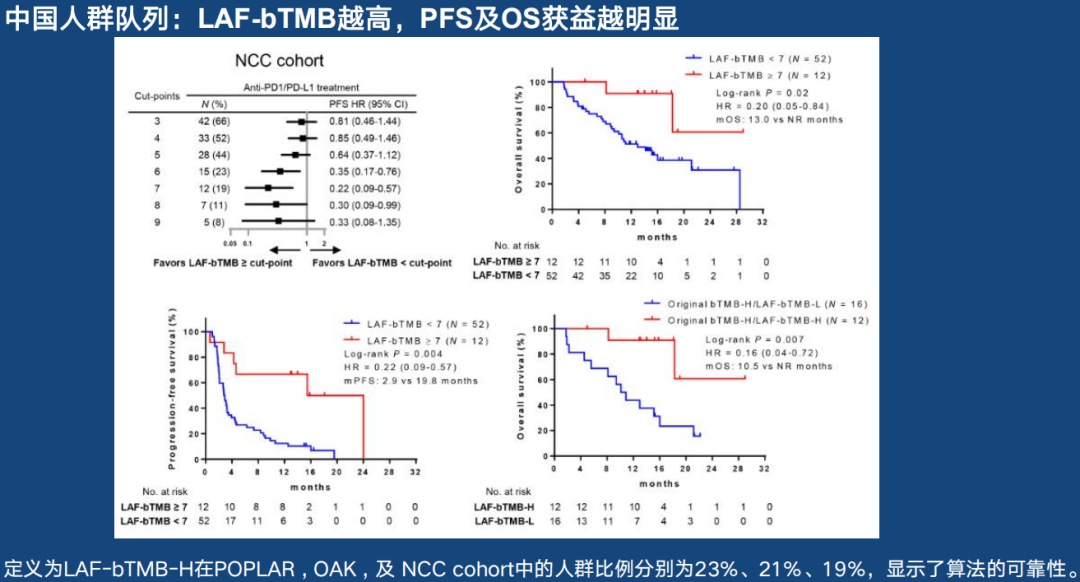
对bTMB的进一步优化,则是排除免疫原性差的高频突变,从而减少MSAF的影响,即低突变丰度TMB检测(LAF-bTMB)。2019和2020 ASCO年会上公布的多项分析显示,LAF-bTMB可有效预测免疫治疗患者的OS,且在中国患者亚组中体现了较好的预测效果,若结论得到大规模前瞻性研究证实,有望引领TMB检测进入2.0时代。
下半场Workshop讨论要点
在会议下半场的Workshop讨论与汇报环节,焦作市人民医院皇甫娟教授、郑州人民医院单国用教授、南阳医专第一附属医院杨秀丽教授、河南省人民医院杨红杰教授和贵州省人民医院张程教授等多位专家,围绕上半场报告的相关内容与讲者进行了精彩的讨论:
1. 随着靶向治疗、免疫治疗的应用不断前移,PACIFIC等研究提出免疫+放化疗的创新应用模式,围手术期系统治疗的手段也更加多样化,在选择上就需要结合患者相关基因、生物标志物检测结果,临床分期,身体条件及患者的个人治疗意愿,尽早进行精准化的系统治疗,从而实现改善早期患者预后的最终目标。
2. ADJUVANT等研究结果显示,围手术期靶向治疗的最终OS会受到后线治疗方案的显著影响,因此无统计学显著差异的试验结果,不等于临床实践中方案无价值,但同样这一现象也提示靶向药物的使用可能仍存在优化空间,如接续在辅助化疗后进行TKI单药维持,或选择副作用较小的培美曲塞等化疗药,进行TKI+化疗的尝试等,有待临床研究给出证明。
3. bTMB与传统TMB的转化,目前受到多方面因素的影响,如不同检测Panel列入的基因类型、具体检测算法保密等问题,但传统TMB检测的取样、准确度等局限性问题难以突破,就注定了bTMB未来会全面应用,对OS的预测价值则需要进一步优化。
4. 乳腺癌21基因检测、EGFR突变在IPASS研究中确立地位等经典的转化研究,离不开临床医生对患者情况规范化的数据统计,虽然部分医院学术研究起步较晚,但随着技术手段进步,远程会诊、视频会议等形式,都可以成为临床一线医生参与转化研究的契机,从临床现象到成功的转化研究,则需要科研团队的整体努力。
最后,担任会议主席的河南省人民医院仓顺东教授对此次会议进行了总结。仓教授指出,此次会议从学术盘点和科研统计两个角度,对NSCLC靶向治疗、免疫治疗的应用最新趋势进行了全面、深入的解读。靶向治疗和免疫治疗,目前在疗效和应用范围上都呈迅猛进展的态势,临床医生需要及时更新知识储备,既要对疗效数据充分了解,也要对统计常识有所掌握,从而准确解读临床成果,正确应用最新疗法,并且从临床实践中发现值得转化研究的现象,培养科研思维和参与度,从而将实践经验变为扩大肺癌患者获益的良方。
专家简介

仓顺东教授
河南省人民医院肿瘤科主任、肿瘤学博士
硕士研究生导师、主任医师
河南省肿瘤精准诊疗医学重点实验室主任
河南省省级学术技术带头人
河南省保健委员会干部保健会诊专家
河南省医学会肿瘤分会副主任委员
中华医学会肿瘤分会肿瘤内科专家委员会委员
中国医师协会肿瘤医师分会第二届委员会委员

卢红教授
河南大学淮河医院肿瘤科主任、主任医师
肿瘤学博士、教授、硕士研究生导师
开封市医师协会肿瘤专业委员主任委员
中国医师协会肿瘤专业委员会青年委员
中国抗癌协会食管癌专业委员会青年委员
河南省卫生厅科技创新型人才
河南省医学会肿瘤专业委员会常务委员
河南省医师协会肿瘤分会常务委员
河南省抗癌协会理事
河南省医院协会肿瘤医院(科)管理分会常务委员
开封市抗癌协会常务理事

田春桃教授
三门峡市中心医院肿瘤医院一病区主任主任医师
中国人民解放军总医院研究生
郑州大学肿瘤学博士
中国抗癌协会癌症康复与姑息治疗专业委员会委员
河南省抗癌协会癌症康复与姑息治疗专业委员会委员
河南省抗癌协会靶向治疗专业委员会常委
河南省抗癌协会肿瘤精准诊断与治疗专业委员会副主委
河南省抗癌协会化疗专业委员会常委
河南省抗癌协会中西医结合肿瘤整合及姑息疗法专业委员会常委
河南省抗癌协会疼痛专业委员会癌痛分会委员
三门峡市医学会肿瘤专业委员会主委
省部级科研成果3项,SCI论文1篇