第二款CAR-T疗法申报上市;一线治疗CLL或有新选择|血液周刊
要点一览
1. The Lancet Haematology:地西他滨联合维奈托克治疗AML患者效果良好
2. Leukemia: PVd三联疗法治疗初次复发的多发性骨髓瘤患者效果良好
3. 药明巨诺递交的“瑞基仑赛注射液”上市申请拟被纳入优先审评
4. 强生伊布替尼联合利妥昔单抗一线治疗CLL获欧盟批准
>>>> 1. The Lancet Haematology:地西他滨联合维奈托克治疗AML患者效果良好
2020年9月4日,The Lancet Haematology发表的一项研究显示,为期10天的地西他滨联合维奈托克对于不适合高强度化疗的急性髓细胞白血病(AML)患者以及复发/难治性AML患者安全有效。

维奈托克联合DNA甲基化抑制剂是目前75岁以上AML患者或不能耐受高强度化疗AML患者的标准治疗方案。但二者联合对于初发AML或复发/难治性AML患者的效果目前尚不明确。
为此,MD安德森癌症中心的研究人员进行了一项II期临床试验,招募了70例初发的不适合高强度化疗的AML患者、43例继发性AML患者、55例复发/难治性AML患者进行试验。患者首先接受为期10天的地西他滨20mg/m2静脉滴注以及400mg维奈托克口服治疗,然后接受为期5天的巩固治疗。该研究的主要终点是总体缓解率,次要终点包括安全性、总生存期和缓解持续时间。
结果发现,在中位随访时间16个月的随访期内,患者的总体缓解率为74%。168名患者中,有83%的患者出现严重不良事件,最常见的是中性粒细胞减少性发热,其次是肺炎和败血症。
这一结果表明,在为期10天的地西他滨联合维奈托克联合治疗安全性可控,对于初发AML患者或复发/难治性AML患者表现出高度活性。
>>>> 2. Leukemia: PVd三联疗法治疗初次复发的多发性骨髓瘤患者效果良好
2020年9月7日,Leukemia杂志在线发表的一项事后分析显示,相比于硼替佐米+地塞米松二联疗法(Vd),泊马度胺+硼替佐米+地塞米松三联疗法(PVd)可以显著延长来那度胺治疗后初次复发多发性骨髓瘤患者的无进展生存期(PFS),且这一结果不受患者前期治疗方案的影响。

OPTIMISMM III期临床试验已经证实,二线PVd三联疗法治疗复发难治性多发性骨髓瘤患者疗效显著优于Vd二联疗法。但是,患者前期的治疗方案是否会影响PVd或Vd的疗效目前尚不清楚。
通过对之前研究数据的分析,研究人员发现,患者初次复发后,无论是否接受过来那度胺、硼替佐米或干细胞移植治疗,二线PVd治疗效果均优于Vd。
具体来说,PVd vs Vd的PFS分别为:
患者接受过来那度胺治疗时,17.8个月 vs 9.5个月(P=0.0276);
患者没有接受来那度胺治疗时,22.0个月 vs 12.0个月(P=0.0491);
患者接受过硼替佐米治疗时,17.8个月 vs 12.0个月(P=0.0068);
患者没有接受过硼替佐米治疗时,20.7个月 vs 9.5个月(P=0.1055);
患者接受过骨髓移植时,22.0个月 vs 13.8个月(P=0.0241);
患者没有接受过骨髓移植时,16.5个月 vs 9.5个月(P=0.0454)。
同时,PVd治疗的总体缓解率也显著优于Vd 。这一结果表明,无论患者在初次复发前接受哪些常规药物的治疗,PVd治疗的效果均显著优于Vd。
>>>> 3. 药明巨诺递交的“瑞基仑赛注射液”上市申请拟被纳入优先审评
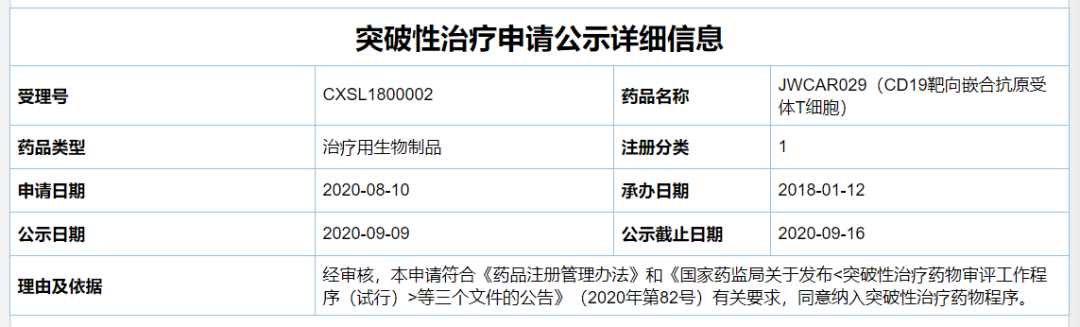
近日,据国家药监局药品审评中心(CDE)公示,上海药明巨诺生物科技有限公司的“瑞基仑赛注射液”(暂定名,研发代码为JWCAR029,通用名为“CD19靶向嵌合抗原受体T细胞”)上市申请拟被纳入优先审评,理由是“符合附条件批准的药品”。
药明巨诺是国内首个获得以 CD19 为靶点的 CAR-T 细胞(嵌合抗原受体 T 细胞)治疗产品的新药临床试验(IND )临床批件的企业。今年的6月30日,药明巨诺提交的瑞基仑赛注射液(暂定)上市申请获得CDE受理,是国内继复星凯特益基利仑赛之后第2款申报上市的CAR-T疗法。
目前,全球仅有两款CAR-T产品上市,靶点均为CD19,分别是诺华的 Kymriah 和 Gilead 旗下公司Kite的Yescarta。
前者批准用于治疗25岁以下的复发/难治性B 细胞急性淋巴性白血病患者、 弥漫性大B细胞淋巴瘤(DLBCL) 成人患者二线或以上治疗;后者批准用于治疗两种非霍奇金淋巴瘤,包括 DLBCL、较为罕见的原发性纵隔大 B 细胞淋巴瘤成人患者二线或以上治疗。
期待1类新药瑞基仑赛注射液(暂定)能够早日获批上市,这将是淋巴瘤患者的福音。
>>>> 4. 强生伊布替尼联合利妥昔单抗一线治疗CLL获欧盟批准
强生旗下杨森制药近日宣布,欧盟委员会(EC)已授予其伊布替尼联合利妥昔单抗一线治疗慢性淋巴细胞白血病(CLL)成人患者的上市批准。
该决定是基于III期E1912研究(NCT02048813)的结果。该研究共评估了529例年龄≤70岁、先前未接受治疗的CLL患者。结果显示,与FCR方案(氟达拉滨+环磷酰胺+利妥昔单抗)相比,伊布替尼联合利妥昔单抗一线治疗方案(IR)显著延长了患者的PFS(HR=0.39 [95% CI:0.26-0.57] ,p<0.0001)、PD或HR降低61%。
IR是一种非化疗联合治疗方案,可以延长PFS,同时减少化疗副作用,有望成为一线治疗CLL的一个新选择。期待伊布替尼联合利妥昔单抗一线治疗方案能使更多的CLL患者获益。
参考文献
[1] 10-day decitabine with venetoclax for newly diagnosed intensive chemotherapy ineligible, and relapsed or refractory acute myeloid leukaemia: a single-centre, phase 2 trial. DiNardo, Courtney D et al. The Lancet Haematology, Volume 0, Issue 0
[2] Michot J M, Bouabdallah R, Vitolo U, et al. Avadomide plus obinutuzumab in patients with relapsed or refractory B-cell non-Hodgkin lymphoma(CC-122-NHL-001): a multicentre, dose escalation and expansion phase 1 study[J]. The Lancet Haematology, 2020.
[3] 拟优先审评品种公示,拟突破性治疗品种公示. Retrieved 2020-09-09, from http://www.cde.org.cn/news.do?method=changePage&pageName=service#
[4]https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/205552s030,210563s006lblPI.pdf