ESMO 2020 FLAURA研究中国队列OS数据公布在即!
EGFR-TKIs是EGFR突变阳性晚期NSCLC患者的一线标准治疗方案,相比化疗,均有显著的PFS获益,但遗憾的是,不管是单药的IPASS、OPTIMAL、CONVINCE、Lux-Lung 7和ARCHER 1050研究,还是联合的NEJ 009和NEJ 026,一直没有OS获益。众所周知,OS获益才是晚期肿瘤治疗方案疗效判断的金标准。


奥希替尼是第三代不可逆结合的EGFR-TKI,对WT-EGFR(野生型EGFR)的抑制作用弱,但选择性抑制EGFR 19外显子缺失突变(19 del)、20外显子T790M突变以及21外显子L858R点突变,显示出高效低毒的特性,同时在合并CNS转移(肺癌中枢神经系统转移)的患者中也显示出很好的抗肿瘤活性。
FLAURA研究[1]是一项国际多中心、随机、对照Ⅲ期临床研究,旨在评估奥希替尼单药(80mg PO QD,n=279)或标准EGFR-TKIs单药(SoC,包括吉非替尼 250mg PO QD或厄洛替尼 150mg PO QD,n=277)治疗EGFR敏感突变阳性晚期NSCLC患者的疗效和安全性。研究的主要研究终点是研究者评估的PFS,次要研究终点包括OS、ORR、DCR、缓解深度和安全性等。
2017 ESMO:FLAURA研究公布主要研究终点,PFS有显著获益
FLAURA研究达到主要研究终点,并成功发表于新英格兰医学杂志,奥希替尼相比SoC的PFS分别为18.9个月和10.2个月[1],HR=0.46(95% CI:0.37-0.57),疾病进展或死亡风险降低54%,P<0.001,差异有显著的统计学意义,具有显著的临床价值。
2019 ESMO:FLAURA研究OS结果公布,奥希替尼成首个有显著OS获益的EGFR-TKI
2019年ESMO,FLAURA研究的OS最终分析结果公布,奥希替尼和SoC的中位随访时间分别为35.8个月和27个月,共发生321例死亡时间,OS成熟度为58%[2]。根据序贯多重检验策略,FLAURA研究的检验策略为PFS→OS→CNS PFS,由于主要研究终点PFS有显著的统计学差异,因此&α;值可以继承下去,基于以上两点,FLAURA研究可以进行后续的正式OS分析。
奥希替尼和SoC的中位OS分别为38.6个月(95% CI 34.5个月-41.8个月)和31.8个月(95% Ci 26.6个月-36.0个月)[2],HR=0.799(95% CI 0.641-0.997),疾病死亡风险降低20.1%,P=0.0462<0.0496,差异有显著的统计学意义。至此,奥希替尼成为有史以来首个OS获益的EGFR-TKI。
由此,美国NCCN指南推荐泰瑞沙为治疗EGFR突变阳性晚期NSCLC患者的唯一优选方案,欧洲ESMO指南推荐泰瑞沙为治疗EGFR突变阳性晚期NSCLC患者唯一MCBS最高分方案,日本肺癌诊疗指南推荐泰瑞沙为治疗EGFR敏感突变阳性晚期NSCLC患者唯一强推荐方案,也是2020年中国CSCO指南EGFR突变阳性晚期非小细胞肺癌患者一线治疗的Ⅰ级推荐方案(IA类证据)。
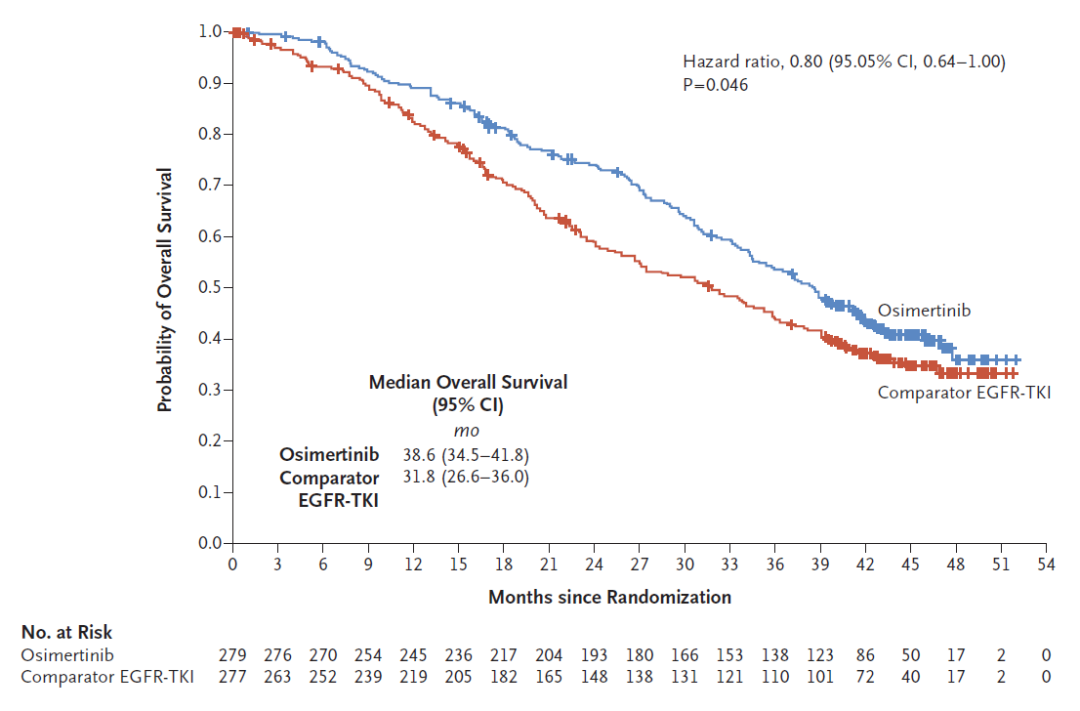
图1:奥希替尼OS最终结果
奥希替尼安全性良好
奥希替尼的安全性与之前研究报道相似。分析显示,奥希替尼和SoC的中位药物暴露时间分别为20.7个月和11.5个月,奥希替尼的中位暴露时间差不多是SoC的一倍,但3级及以上不良事件发生率反而较低,分别为34%和45%[2],这更凸显奥希替尼良好的安全属性。另外,使用奥希替尼治疗的患者,其剂量调整的比率为43%,剂量下调的比率为5%,因不良事件导致的永久性停药的比例为15%[2];相对的,使用SoC治疗的患者,其剂量调整的比率为41%,剂量下调的比率为4%,因不良事件导致的永久性停药的比例为18%[2]。
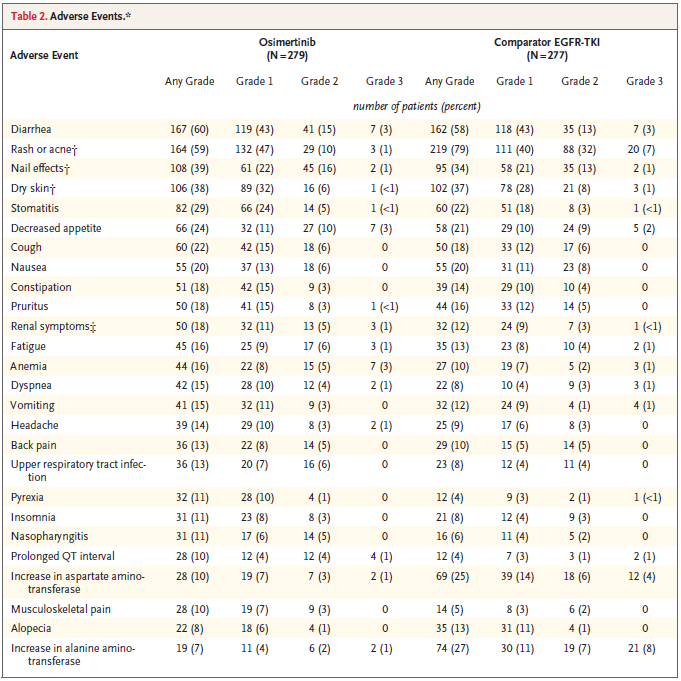
图2:FLAURA研究的不良事件更新数据
2020 ESMO:FLAURA研究中国队列数据公布在即,看趋势比单纯看数据更有意义
据悉,本次ESMO大会,FLAURA研究会公布其中国队列的OS最终数据。FLAURA研究的中国队列共纳入136例患者,随机分为奥希替尼组(71例)和标准EGFR-TKI组(65例,所有中国研究中心均选择吉非替尼为对照药品),值得注意的是:① FLAURA中国队列的主要研究终点是PFS,且达到了主要研究终点,PFS有显著的统计学获益(PFS HR=0.56,95% CI=0.37,0.85),OS只是一个次要研究终点。② 中国队列的统计分析计划(SAP)为探索性分析,最终的结果,无论好坏,其统计学效能是无法与研究根据ITT人群的分析所做的统计学效能相比的。而且据我们了解,这136例中国患者是为了满足CFDA对奥希替尼在中国注册的要求,而在研究进行过程中增补的一组队列,只需观察到与全球队列一致的获益趋势即可。也可以说,中国队列仅是全球结果的一个佐证,如果趋势一致,说明中国人群亦有获益!
结语
虽然PFS作为OS的替代终点,越来越多地被设计为研究的主要研究终点以及新药上市审批的评价标准,但OS是依旧是评价抗肿瘤治疗方案的金标准,得OS才能得天下。
据FDA官网报道[4],ARCHER 1050研究采用Gate-keeping procedure的统计策略,检测的顺序为PFS→ORR→OS。尽管该研究取得了PFS的显著统计学意义,但ORR(75% vs 72%,P=0.4234)[3]和OS未取得显著的统计学意义。而JCO发布的文章提示[5],NEJ 009研究使用序贯多重检测策略,多个研究终点的统计检验顺序为PFS→PFS2→OS,由于PFS2没有显著的统计学意义(PFS2=20.9个月 vs 18.0个月,P=0.092),后一个次序的OS分析不是正式分析(无法控制Ⅰ类错误的发生),因此最终的OS分析结果没有统计学意义,需要进一步研究来验证。

图3:达可替尼FDA官网截图

图4:NEJ 009研究JCO文献结论部分截图
奥希替尼是首个有OS获益的EGFR-TKI,终结了EGFR-TKIs只有PFS没有OS的尴尬历史,我们对2020 ESMO即将公布的FLAURA研究中国队列的OS数据拭目以待。据悉,奥希替尼也在积极准备2020年的医保谈判,我们也非常期待这样的好药品能尽快纳入国家医保,造福更多的肺癌患者。
参考文献:
[1] S.S. Ramalingam, et al,. N Engl J Med 2018;378:113-25. P:113-125
[2] S.S. Ramalingam, et al, N Engl J Med. 2019 Nov 21. P:1-10
[3] https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-dacomitinib-metastatic-non-small-cell-lung-cancer-0
[4] Tony S. Mok, et al. J Clin Oncol 36:2244-2250
[5] Yukio Hosomi, et al, J Clin Oncol. 2020 Jan 10;38(2):1-9