缺氧是导致癌细胞不断肆虐的元凶
当缺乏氧气(缺氧)时,健康细胞成长受到限制。但令人惊奇的是,缺氧却是90%的实体瘤中广泛存在的一种特质,而且缺氧这种特征与肿瘤的增殖、分化、血管生成、能量代谢以及癌症的耐药性发生、患者预后较差密切相关。
但当氧气含量在生长中的肿瘤中下降时,缺氧就会激活一种名为HIF1(缺氧诱导因子)的基因,并通过发挥其转录调节因子的作用,降低乃至关闭线粒体中的耗氧过程,尤其是氧化磷酸化,从而使得糖酵解成为癌细胞主要的能量产生方式。
2019年的诺贝尔生理学或医学奖,正是颁发给了HIF1通路的三位奠基人。

然而,科学家对于肿瘤细胞是如何响应低氧环境的仍知之甚少。
此外,绝大多数关于缺氧调节基因表达的研究都是在体外环境下进行的。即使用与正常空气相同的氧气浓度来培养肿瘤细胞,然后再将细胞短时间暴露于1%的氧气中。实际上,这比体内的氧气含量高的多,可能并不能模拟肿瘤细胞缺氧的真实情况。
近日,约翰·霍普金斯大学医学院的研究人员在 Nature Communications 杂志发表了题为:Fate-mapping post-hypoxic tumor cells reveals a ROS-resistant phenotype that promotes metastasis 的研究论文。
该研究构建了二维和三维的组织系统和活体动物实验,充分表征了缺氧细胞在癌症发展至转移过程中的命运。
研究表明,在体内经历肿瘤内缺氧的细胞与体外暴露于缺氧环境的细胞具有不同的基因表达模式。体内暴露于慢性低氧环境赋予癌细胞以增强的侵袭、转移和ROS耐药的表型,从而在血液中再充氧时促进其存活,并更有可能扩散到远处的组织。

在该项研究中,研究人员发明了一种双载体缺氧命运映射系统来永久标记缺氧细胞,并跟踪它们在肿瘤发生过程中的命运。
载体1包含一个改造的Cre基因(添加一个HIF调控的氧依赖的降解域(ODD))。载体2表达一个红色荧光报告蛋白(DsRed),其终止密码子位于一个绿色荧光蛋白(GFP)基因编码前的串联loxP位点。
在缺氧条件下,HIF导致Cre的转录激活,Cre切掉DsRed基因,导致永久性的GFP表达。
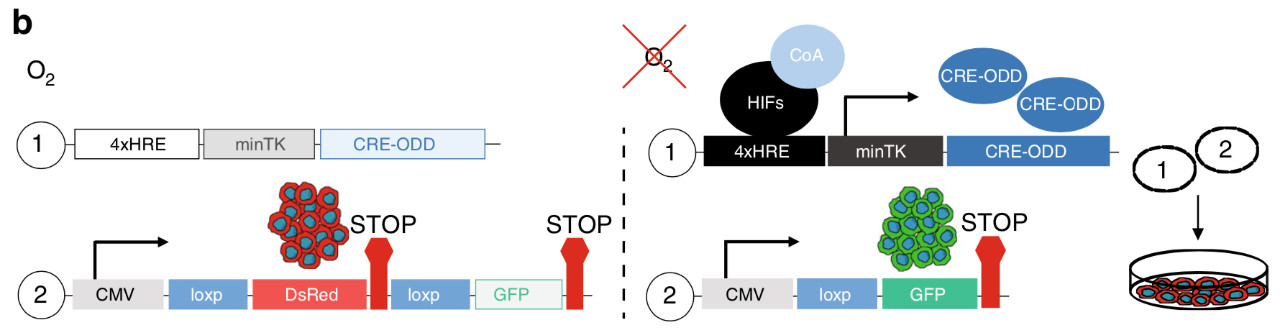
同时,研究人员构建了一种转基因小鼠模型,它同样以缺氧依赖的方式表达CRE基因(载体1)。通过靶向位点扩增(TLA)和下一代测序,研究人员确定了转基因的确切整合位点、拷贝数、序列和定位。
研究人员系统地研究了缺氧过程中每个阶段的乳腺癌进展(导管增生,导管原位癌(DCIS),早期癌,晚期浸润性癌),并定位了缺氧部位。研究发现,瘤内缺氧首先出现在导管原位癌病变中。
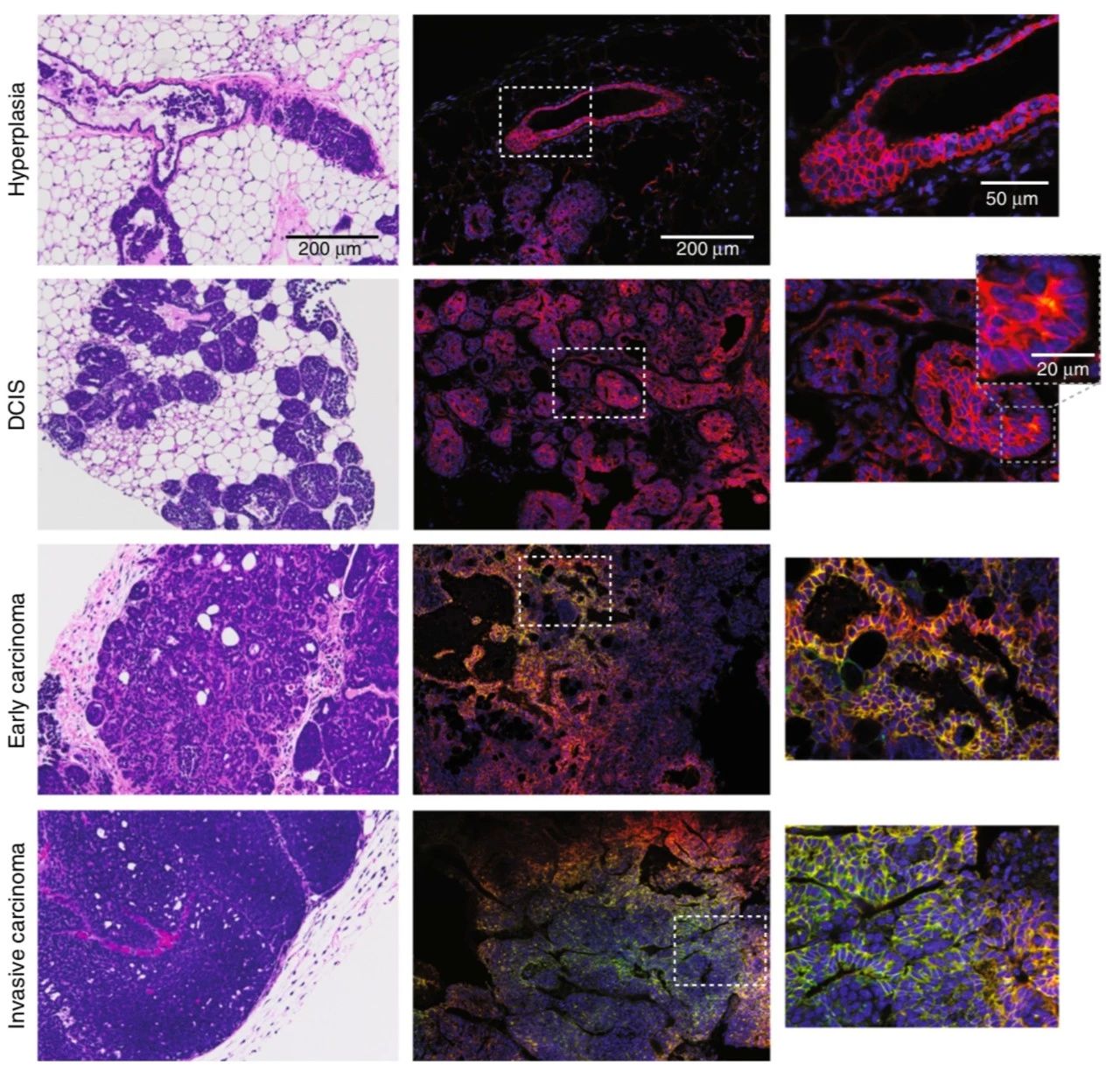
研究团队使用荧光激活细胞分选技术捕获红色或绿色(缺氧)乳腺癌细胞,然后进行RNA测序。发现在肿瘤内细胞经历了缺氧诱导后,许多基因表达水平升高,包括整合素α10(ITGA10)和血浆铜蓝蛋白(CP),但是在体外暴露于缺氧的肿瘤细胞中却没有发现这种现象。
这种肿瘤内缺氧的细胞的基因表达模式似乎可以帮助细胞在进入血流时抵抗氧化应激。
一些肿瘤细胞即使在重新充氧后,仍保留了部分“低氧记忆”的遗传标记。
这些发现还表明,这些经历低氧后的细胞形成肺转移的可能性是其六倍,这表明缺氧会增强其转移能力。
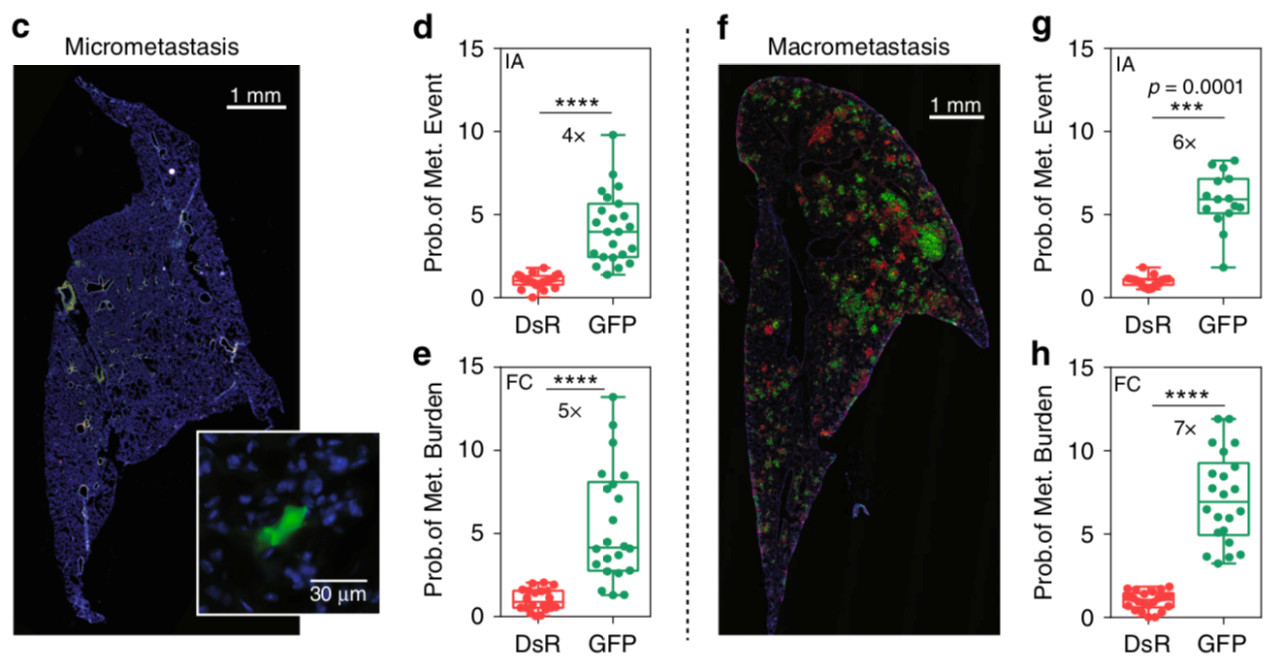
癌细胞适应低氧水平时趋于变得更具侵略性。
令人惊讶的是,即使在血液中重新供氧,原发性肿瘤中暴露于低氧的细胞仍保持其侵袭性。
研究团队认为,未来低氧细胞的独特功能可能会被用作识别转移风险患者的生物标志物,或者可能直接用于治疗,以预防或限制转移。转移部位的低氧后肿瘤细胞是否比其他细胞对化疗更有抵抗力,靶向这些低氧后的细胞是否对治疗转移性癌症患者有益仍需要进一步的研究。
来源:BioWorld
论文链接:
https://www.nature.com/articles/s41467-019-12412-1