Selpercatinib 在RET融合阳性NSCLC患者中的有效性
RET基因融合作为NSCLC的驱动因素,存在于1%~2%的患者中。既往多激酶抑制剂如Cabozantinib和Vandetanib在临床前及临床中均显示出一定的RET抑制活性,但其临床疗效均有限。Selpercatinib作为一种新型的ATP竞争性小分子药物,临床前试验中显示出对RET蛋白抑制的高度选择性。近期,《新英格兰医学杂志》(NEJM)报道了Selpercatinib在RET融合阳性NSCLC患者中的Ⅰ/Ⅱ期临床研究结果,评估了Selpercatinib在该类患者中的有效性及安全性。

背景
RET原癌基因编码跨膜受体酪氨酸激酶,并参与正常胚胎发育。RET基因C-末端激酶结构域与其伴侣基因上游序列融合所产生的融合蛋白可导致蛋白的异常表达及寡聚化。这些融合蛋白可导致RET组成性激活,并激活配体非依赖性信号通路,促进肿瘤发生。RET基因融合通常与其他肿瘤驱动因素互斥,并导致肿瘤细胞对致癌激酶的依赖。RET融合发生在1%~2%的NSCLC患者中,并与患者高风险脑转移相关。既往的针对其他基因的多靶点激酶抑制剂对RET也有一定的抑制作用,并已在前瞻性的临床试验中进行评估,但这些药物对RET的抑制作用较弱,药代动力学特征较差及剂量限制毒性,导致了其在临床上应用有限。
Selpercatinib(也叫LOXO-292)是一种新型的ATP竞争性小分子药物,对RET蛋白的抑制具有高度选择性。体外实验显示其可抑制多种RET改变,包括RET融合、RET激活点突变以及获得性耐药突变。此外,Selpercatinib可穿透中枢神经系统(CNS),并在临床前模型中显示出一定的颅内抗肿瘤活性。LIBRETTO-001为一项评估Selpercatinib有效性的Ⅰ/Ⅱ期临床研究,该研究纳入了携带RET激活改变(融合或突变)的青少年及成年实体瘤患者,本文报道了Selpercatinib在RET融合NSCLC患者中的有效性及安全性。
方法
研究纳入12岁及以上晚期或转移性实体瘤患者,RET基因改变由当地分子检测实验室进行NGS、FISH或PCR确定,不需要中心实验室进行确认。患者的PS评分为0~2,有充足的器官功能,校正的QT 间期≤470ms。既往经免疫检查点抑制剂、多靶点的激酶抑制剂及化疗治疗的患者允许入组,此外,研究允许存在经治/初治的无症状或≥2周稳定脑转移患者入组。本次分析中纳入的NSCLC患者均为RET融合阳性。
该研究在12个国家65家中心开展,所有患者给予Selpercatinib口服,每28天为一个周期,直至患者出现疾病进展、死亡、不可耐受的毒性或撤销知情同意。Ⅰ期剂量爬坡试验中Selpercatinib剂量范围由20 mg每天一次至240 mg每天两次,Ⅱ期研究中采取160 mg每天两次的推荐剂量。如果患者出现疾病进展,但研究者认为患者可以继续从Selpercatinib治疗中获益,则会继续进行Selpercatinib治疗。研究的主要研究终点是孤立评审委员会评估的客观缓解率(ORR),次要研究终点是颅内ORR,无进展生存期(PFS),持续缓解时间(DoR)及安全性。所有的缓解评估均须在4周后进行影像学确认,第一年每8周进行一次疗效评估,随后每12周评估一次。研究同时分析了经治和初治RET融合阳性NSCLC患者的疗效。安全性分析包含了截止2019年6月17日共531例接受Selpercatinib治疗的经治或初治患者。
结果
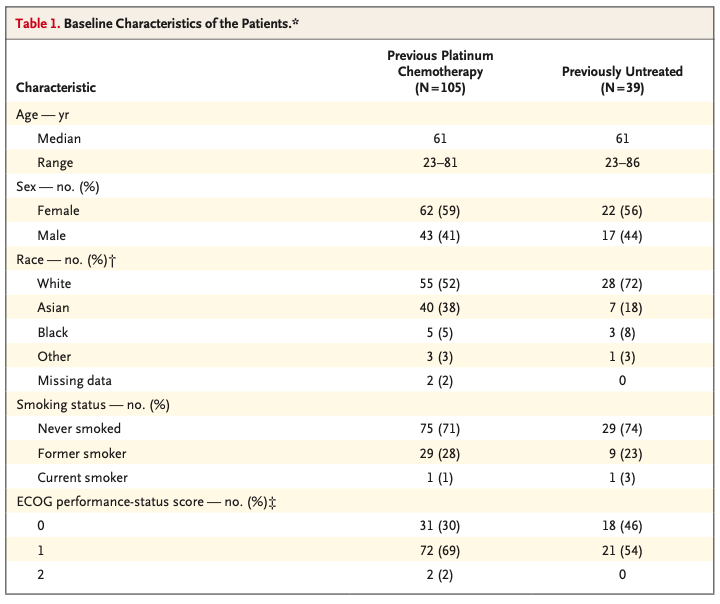
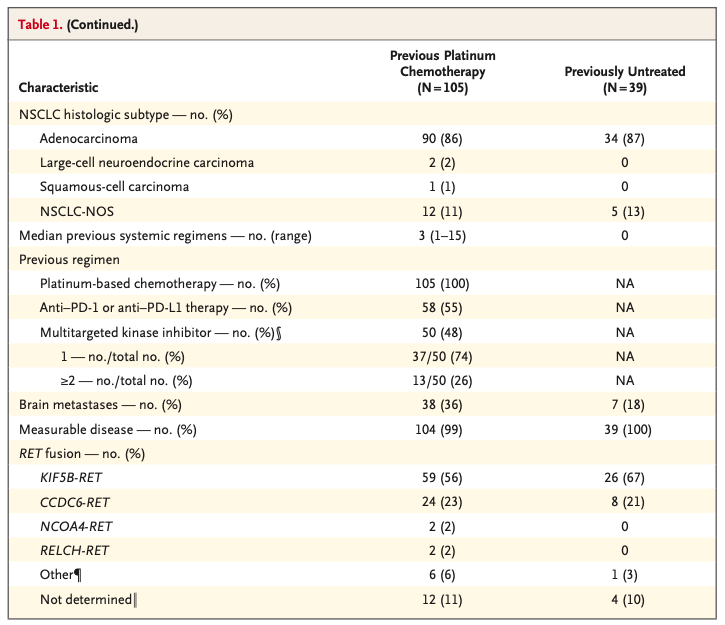
研究于2017年5月-2018年12月共纳入了105例RET融合阳性的经治晚期NSCLC患者,,其中49例入组了Ⅰ期剂量爬坡试验,56例患者入组剂量扩展及Ⅱ期临床研究。此外,2017年12月-2019年6月期间纳入39例初治的晚期RET融合阳性NSCLC进行Selpercatinib治疗。患者基线特征见表1。经治患者的中位系统性治疗线数为3线,其中55%的患者先前接受过PD-1/PD-L1抑制剂治疗,48%的患者接受过多激酶抑制剂(包括可抑制RET活性的激酶抑制剂)治疗。36%的患者基线存在脑转移,经治及初治患者的基线特征相似,88%经治患者的患者接受了至少1次160 mg 每天两次的Selpercatinib治疗,所有初治患者均接受160 mg每天两次Selpercatinib治疗。
表1. 患者基线特征
有效性
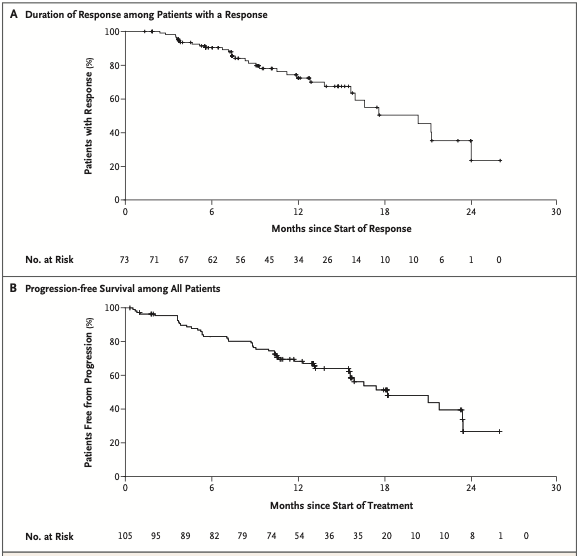
孤立评审委员会评估的经治患者的ORR为64%(95%CI, 54 ~ 73)(图2)。2例(2%)患者获得完全缓解(CR),65例(62%)获得部分缓解(PR),30例(29%)疾病稳定(SD),4例(4%)疾病进展(PD),4例(4%)无法评估。无论患者既往治疗线数、先前是否接受过PD-1/PD-L1抑制剂或多激酶抑制剂治疗,均获得了缓解。中位DoR为17.5个月(95%CI,12 ~ NE),中位PFS为16.5个月(95%CI,13.7 ~ NE)。1年的PFS率为66%,63%(42/67)的患者在中位随访12.1个月后仍处于缓解中。5例(5%)患者失访或退出试验。研究者评估的ORR为70%(95%CI,60 ~ 78)(表2,图1),无论RET融合伴侣为哪种类型,均可从治疗中获益,出现缓解的中位时间为1.8个月,中位DoR为20.3个月(95%CI,15.6 ~ 24.0),既往接受化疗及PD-1/PD-L1抑制剂治疗的患者DoR相似。中位PFS为18.4个月(95%CI,16.4 ~ 24.8),1年的PFS率为68%(表2,图2B)。随访14.8个月时58%的患者仍在缓解中,71%的患者仍在治疗中。
105例患者中,38例基线存在脑转移,其中11例患者存在可评估病灶,这些患者的颅内ORR为91%(95%CI,59 ~ 100),包括3例CR,7例PR和1例SD,中位CNS DoR为10.1个月(95%CI,6.7 ~ NE)。
39例初治患者经孤立评审委员会和研究者评估的ORR分别为85%(95% CI, 70 ~ 94)和90%(95% CI, 76 ~ 97)(表2)。6个月时仍有90%的患者持续缓解。在中位随访7.4个月和9.2个月时,对应的中位DoR和中位PFS均未达到。无患者失访或退出试验。
表2. Selpercatinib治疗有效性
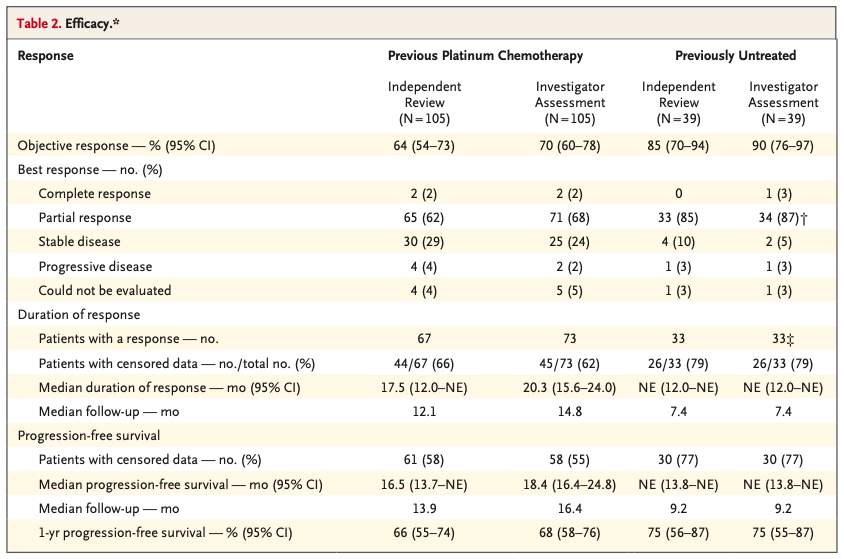
图1. 有效性评估
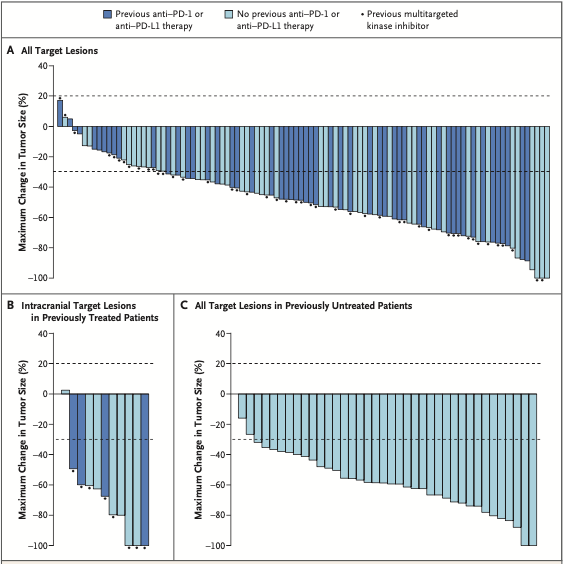
图2.持续响应时间及无进展生存期KM曲线
安全性
表3列出了治疗期间出现的不良反应。最常见的3-4级不良反应是高血压(14%)、丙氨酸转氨酶升高(13%)、天冬氨酸转氨酶升高(10%)、低钠血症(6%)和淋巴细胞减少(6%)。6例(4%)的患者出现了5级不良反应,分别为2例败血症以及心脏骤停、多器官功能障碍综合征、肺炎和呼吸衰竭各1例,研究者评估这些不良反应均与Selpercatinib治疗无关。总体的531例接受Selpercatinib治疗患者中,160例(30%)出现因治疗相关不良反应导致的剂量减低,12例(2%)患者治疗终止,最常见的与Selpercatinib相关的不良反应为丙氨酸转氨酶升高(2例)和药物过敏(2例)。
表3. RET融合NSCLC患者接受Selpercatinib的不良反应
讨论
既往多激酶抑制剂,如Cabozantinib 和 Vandetanib 在临床前和临床试验中均显示出一定的RET抑制活性,但其疗效均有限。在Cabozantinib的Ⅱ期临床研究中,ORR仅28%,中位PFS仅6个月,73%的患者出现剂量调整。Selpercatinib在RET融合肺癌中的活性优于既往的多激酶抑制剂,即使在接受至少3次系统性治疗及经免疫治疗的患者中。本研究中Selpercatinib疗效与NSCLC中携带其他驱动基因(EGFR突变、ALK/ROS1/NTRK融合)经相应靶向药物一线治疗的疗效相似。此外,Selpercatinib呈现出一定的颅内缓解率。安全性方面,Selpercatinib导致的主要为低级别不良反应,仅2%的患者出现Selpercatinib治疗相关不良反应而导致的治疗终止。
总体上,Selpercatinib在RET融合阳性肺癌患者中表现出的持续的抗肿瘤活性,无论是一线还是在既往经铂类治疗的患者,或者脑转移患者中。无论患者既往是否接受PD-1/PD-L1抑制剂或多激酶抑制剂治疗,Selpercatinib均表现出抗肿瘤活性。未来包括对RET融合的分子检测,将有助于筛选可能从Selpercatinib治疗中获益的NSCLC患者。
参考文献
Drilon A, Oxnard GR, Tan DSW, et al. Efficacy of Selpercatinib in RET Fusion–Positive Non–Small-Cell Lung Cancer[J]. New England Journal of Medicine, 2020, 383(9): 813-824.