特约综述 HER2阳性乳腺癌治疗标准的演变及挑战上篇
HER2阳性乳腺癌占乳腺癌整体人群的15%-20%,复发率高、生存率低、生物学行为差。乳腺癌的治疗策略不断发展和更新,显著改善了患者的预后,但有16%-22%的早期HER2阳性乳腺癌患者会出现复发,22%-25%患者存在原发或继发性抗HER2治疗的耐药,高达50%的晚期HER2阳性乳腺癌患者会发生脑转移,因此,迫切需要新的治疗策略去提高患者的生存。目前,已经有7种抗HER2靶向治疗药物获得美国FDA的批准用于HER2阳性乳腺癌患者(新)辅助/转移后的治疗(图1),虽然研究在不断的深入,但挑战仍然存在,治疗升阶梯和降阶梯理念是当前研究的热点。
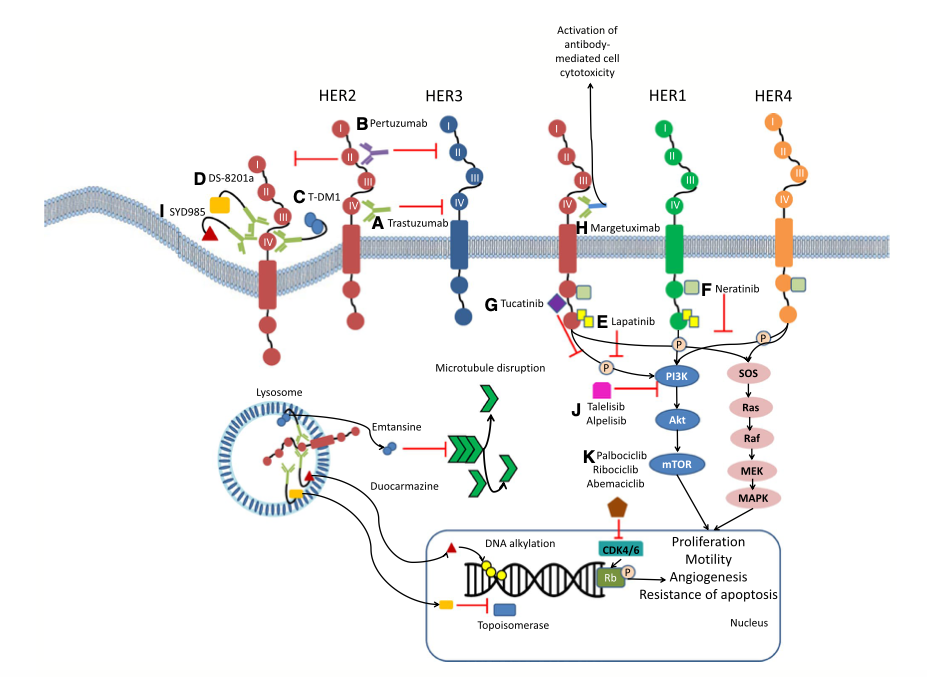
2020年8月19日,CA Cancer J Clin在线发表了一篇特约文章,其影响因子高达292.278,对HER2阳性乳腺癌治疗的升阶梯和降阶梯的优化治疗策略和最近FDA批准的改变治疗模式新的药物做了系统性综述。本文带来上篇,早期HER2阳性乳腺癌的治疗进展和挑战。

早期HER2阳性乳腺癌的治疗进展和挑战
(一)辅助/新辅助治疗
奠基性的试验证实了与单纯化疗相比,化疗联合曲妥珠单抗(trastuzumab)显著延长PFS和OS(减少约50%复发率,提高约30%的生存率),确立了基于曲妥珠单抗的方案作为早期和晚期HER2+乳腺癌患者的标准治疗地位。同时,有研究通过减少化疗或缩短抗HER2治疗的时长来进行降阶梯的治疗,试图在保证良好疗效的同时减少毒性,平衡全身治疗的益处和风险。
1、辅助治疗中的降阶梯
APT试验是针对淋巴结阴性,肿物≤3cm的HER2阳性早期乳腺癌患者的Ⅱ期单臂临床研究。患者接受紫杉醇和曲妥珠单抗治疗12周,然后完成1年的曲妥珠单抗治疗,7年无病生存率(DFS)为93.3%,7年无复发间隔(RFI)为97.5%。APT入组人群T>2 cm只有9%,有50%患者T≤1 cm,且大约65%的患者为激素受体阳性(HR+),因此,APT试验表明,在低风险的患者中,可以考虑降阶梯的治疗。
ATEMPT研究是一项随机多中心、Ⅱ期研究,入组了I期、HER2+乳腺癌患者,随机3:1分配接受T-DM1 q3w,共17个周期或TH qw x 12w,序贯H x 39w方案的治疗,主要终点为T-DM1臂的3年DFS和两治疗臂之间的毒性发生率。中位随访3年,T-DM1和TH组DFS分别为97.7%和92.8%(P < 0.0001)。两组具有临床有意义的毒性发生率均为46%,TH组的中性粒细胞减少高于T-DM1,但T-DM1的治疗终止率高于TH组(17% vs 6%)。ATEMPT研究提示在一些选择性的I期HER2+患者中,根据相应毒性(先前存在的神经病变/脱发),T-DM1可以作为TH方案的替代选择。但是与APT试验方案相比较,1年时长的T-DM1并不是真正意义上的降阶梯治疗,经济花费是应该是值得关注的问题。
RESPECT试验也在降阶梯治疗上做了尝试,旨在比较曲妥珠单抗单药与曲妥珠单抗联合化疗在老年(70-80岁)Ⅰ至ⅢA期HER2+乳腺癌患者术后辅助治疗的Ⅲ期非劣效随机对照试验。虽然该研究效力不足,但在随访3年时组间DFS无显著性差异(89.2% vs 94.8%,P = 0.35),且曲妥珠单抗单药治疗组有更高的生活质量,提示曲妥珠单抗单药治疗是不能耐受化疗患者的一种选择。
2、曲妥珠单抗的最佳持续时间
充足的数据支持了曲妥珠单抗在HER2+乳腺癌辅助治疗中的标准时长为1年,然而系列的研究被开展去探寻缩短疗程的治疗是否具有同样的疗效。2006年FinHER研究中HER2+亚组分析表明,即使9周的曲妥珠单抗治疗也能改善3年的DFS(89% vs78%,P = 0.01),然而5年随访未见显著获益(HR = 0.65,95% CI:0.38 ~ 1.12, P = 0.12),其他评价9周曲妥珠单抗治疗的试验ShortHer、SOLD等亦无阳性结果发表。评价6个月曲妥珠单抗疗效的2013年法国PHARE研究和2015年希腊HORG研究均为阴性结果,虽然Persephone研究获得非劣效阳性的结果,但是由于非劣效界值设定较为宽泛以及入组人群较为低危而饱受争议。经典的HERA试验11年的中位随访结果证实2年的曲妥珠单抗治疗并无显著生存获益且不良反应增加。因此,目前曲妥珠单抗辅助治疗标准时长仍然为1年,但是对于存在潜在心脏风险或者新冠疫情下免疫功能低下的特定患者,缩短疗程值得进一步探索。
(二)新辅助治疗的降阶梯
病理完全缓解(PCR)可以作为HER2+乳腺癌患者长期预后的替代指标,借助新辅助治疗平台的筛选作用,根据是否获得pCR而进一步优化抗HER2治疗的策略。Compass HER2-pCR拟研究HER2+早期乳腺癌患者接受12周的紫杉醇、曲妥珠单抗和帕妥珠单抗新辅助治疗后获得pCR者是否可以豁免辅助化疗而仅单纯靶向治疗,拟检验降阶治疗后达到pCR患者的3年无复发生存率≥92%。该试验结果可能指出未来研究的方向并对临床实践产生有意义的影响。
I-SPY2是促进新辅助治疗药物研发和个体化治疗方案制定的代表性研究,这种适应性随机研究比较在不同肿瘤亚型中,多个试验药物组合与标准治疗的疗效,将并不显著提高pCR率的药物从试验中剔除,将达到预定的疗效阈值的方案纳入进一步的III期试验。I-SPY试验设计允许研究者在较少样本量中快速评价疗效,其检测的HER2靶向药物包括tucatinib、奈拉替尼(neratinib)、T-DM1、帕妥珠单抗、MK-2206和AMG 386。
1、无化疗方案
分析NeoSphere和ADAPT试验,分别有约17%和30%单纯接受曲帕双靶治疗的受试者获得了pCR,提示有必要在HER2+早期乳腺癌中进行豁免化疗的新辅助靶向治疗的深入探索。
KRISTINE试验入组II/III期、HER2+早期乳腺癌患者,显示TCHP组的pCR率显著高于T-DM1+P组(55.7% vs 44.4%),但是TCHP组≥3级不良事件更多。后续随访表明达到pCR者的临床结局均较好,表明在高选择的患者或者无法耐受化疗的患者也可以尝试化疗降阶的靶向治疗方案,如何利用生物标志物去准确筛选出这部分特定人群是研究的关键所在。
TBCRC026研究旨在评估根据18F-FDG PET/CT去脂体重校正的肿瘤最大摄取值(SULmax)对HR-、HER2+早期乳腺癌单纯赫帕双靶向新辅助治疗pCR的预测作用,提示根据影像学指标来实现新辅助治疗的化疗降阶梯具有潜在的临床应用价值。
NA-PHER2是一项应用CDK4/6抑制剂哌柏西利、曲妥珠单抗、帕妥珠单抗和氟维司群在HR+/HER2+乳腺癌患者中进行的Ⅱ期新辅助研究。主要终点是基线至治疗2周时和手术时的细胞增值指数Ki67表达变化、基线至手术时的细胞凋亡变化。次要终点为临床客观缓解率和pCR率。治疗2周后和手术时观察到Ki-67水平和细胞凋亡显著降低。在30例可评价患者中,有8例(27%)达到乳腺和腋窝淋巴结的pCR。
PALTAN是一项应用哌柏西利、来曲唑和曲妥珠单抗在ER+/HER2+ Ⅱ/Ⅲ期乳腺癌患者中进行的II期新辅助治疗试验,该研究结果预计将在2021年公布。
(三)治愈意向背景下辅助治疗的升阶梯治疗
虽然HER2靶向治疗显著改善了患者的预后,但仍然有部分患者存在较高的局部区域复发和/或远处转移的风险。因此,临床试验关注的重点之一是如何进一步提高高复发风险患者(如,肿瘤负荷较大或淋巴结阳性和/或新辅助治疗后仍然残留浸润性病灶)的DFS和OS。评估拉帕替尼(ALLTO)或贝伐珠单抗(BETH)辅助研究显示,与化疗和曲妥珠单抗单靶治疗相比,未显著提高OS。
ExteNET试验入组Ⅱ/Ⅲ期HER2+早期乳腺癌患者,在完成标准的化疗+曲妥珠单抗辅助治疗后再接受1年的奈拉替尼辅助治疗,中位随访时间5.2年,奈拉替尼延长抗HER2辅助治疗的效益2.5%(90.2% vs 87.7%,P = 0.0083);在HR+/HER2+早期乳腺癌患者中的DFS获益更大(4.4%)。基于此,2017年7月美国FDA批准奈拉替尼上市。然而,ExteNET试验入组人群3级腹泻的发生率较高(40%),且奈拉替尼在术后接受过帕妥珠单抗和T-DM1患者中应用的数据尚不充分。
基于APHINITY试验结果,2017年FDA批准帕妥珠单抗在HER2+高危(HR-和/或淋巴结阳性)乳腺癌辅助治疗的适应证。中位随访6年更新结果显示,帕妥珠单抗组的iDFS获益增加至2.8%;淋巴结阳性亚组患者的iDFS获益为4.5%。值得注意的是,更长时间的随访表明HR阳性(&δ;3.0%)和HR阴性(&δ;2.5%)的iDFS均可从帕妥珠单抗辅助治疗中获益。帕妥珠单抗组的3级腹泻发生率较高(9.8% vs 3.7%),未发现新的心脏安全性问题。两个治疗组的中枢神经系统转移均较高(25%-33%)。总之,只要淋巴结阳性、无论激素受体阳性或者阴性的人群均可接受赫帕双靶+化疗的辅助治疗策略。至于双靶治疗能否为淋巴结阴性患者带来生存获益,尚需进一步的分析。
KATHERINE也是具有里程碑意义的试验,与曲妥珠单抗相比,T-DM1显著降低了50%的复发风险(HR = 0.5,95%CI:0.39 ~ 0.64,P < 0.001),强化辅助治疗显示出生存的获益,促使FDA批准了T-DM1辅助强化治疗的适应证。由于赫帕双靶新辅助治疗可以获得更高的pCR率,因此,随着双靶新辅助治疗比例的增加,降低了对T-DM1辅助强化治疗的需求。
尽管T-DM1辅助强化治疗总体上改善了新辅助治疗后仍然有浸润性残余病灶的HER2+乳腺癌患者的iDFS,但ER-和/或淋巴结阳性患者的iDFS结局仍较差,这部分人群可能从进一步升阶梯治疗中获益。Ⅲ期CompassHER2 RD试验将HER2+乳腺癌患者随机应用14个周期的T-DM1以及T-DM1+ tucatinib治疗,以明确是否可以进一步改善iDFS,该试验将于2020年底启动。另一项Ⅱ期研究旨在评价与HER2+早期乳腺癌pCR有关的免疫生物标志物,将新辅助治疗后有残余病灶的患者按2:1的比例随机接受T-DM1+多表位疫苗或T-DM1+安慰剂,主要研究终点为iDFS和安全性,期待结果发表。
参考文献
CHOONG GM, CULLEN GD, O'SULLIVAN CC, et al. Evolving standards of care and new challenges in the management of HER2-positive breast cancer. CA Cancer J Clin 2020 Aug 19. DOI:10.3322/caac.21634 PMID:32813307