CD47拍了拍SIRPα 并留言自己人别吃我!
导读
自免疫检查点发现以来,肿瘤免疫治疗已迅速转化为临床策略,引领肿瘤治疗进入免疫新时代。与以往放化疗直接攻击癌细胞不同,免疫治疗是将“失灵”的免疫系统恢复正常,让体内“斗士”重新恢复战斗力去进攻癌细胞。为大家所熟知的免疫斗士有,“反恐精英”T细胞、“间谍致命物”NK细胞、“巡逻警察”巨噬细胞,他们各展所长与癌症相抗争。
我们熟知的PD-1/PD-L1神药,便是召唤反恐精英T细胞来与癌细胞抗争:PD-1(程序性死亡分子1)是T细胞上的一种蛋白质,通过与其配体PD-L1结合产生信号,诱导T细胞凋亡,从而抑制免疫系统。肿瘤细胞很聪明,为自己配备了战斗装置PD-L1,这样就可以与T细胞上的PD-1结合逃避免疫系统捕杀。PD-1/PD-L1抑制剂可以阻止肿瘤细胞上的PD-L1与T细胞上的PD-1结合,T细胞就可以对肿瘤细胞发起进攻,增强人体免疫应答。
PD-1/PD-L1抑制剂的积极临床效果让免疫治疗领域大受鼓舞,那大家不禁思考,其他免疫斗士是否有与其相匹敌的抗癌能力?答案是肯定的,本文为您介绍:继PD-1/PD-L1之后,肿瘤免疫领域的下一个重要靶点—CD47。
CD47——请别吃我!
CD47药物主要是召集“巡逻警察”巨噬细胞,其是人体固有的免疫系统的主要成员,负责日常在血液系统里巡逻,识别和清除外来的、受损的或老化的细胞, 以保持内环境的稳定。他从不自我攻击, 原因是正常细胞表面的CD47(整合素相关蛋白)与SIRP&α; (巨噬细胞表面的信号调节蛋白&α;) 结合, 传递一个负调节信号给巨噬细胞, 以保护正常细胞免受吞噬。
狡猾的癌细胞又有机可乘,在其表面伪造了CD47,与巨噬细胞表面的SIRP&α; 结合并发出“别吃我”(Don‘t eat me)信号以逃避免疫监视。因此,破坏肿瘤细胞和巨噬细胞之间 CD47-SIRP&α; 的相互作用是一种有效的抗肿瘤策略。近年来CD47 单抗、SIRP&α;-Fc 融合蛋白以及核酸类药物已成为抗肿瘤新药研发的热点。
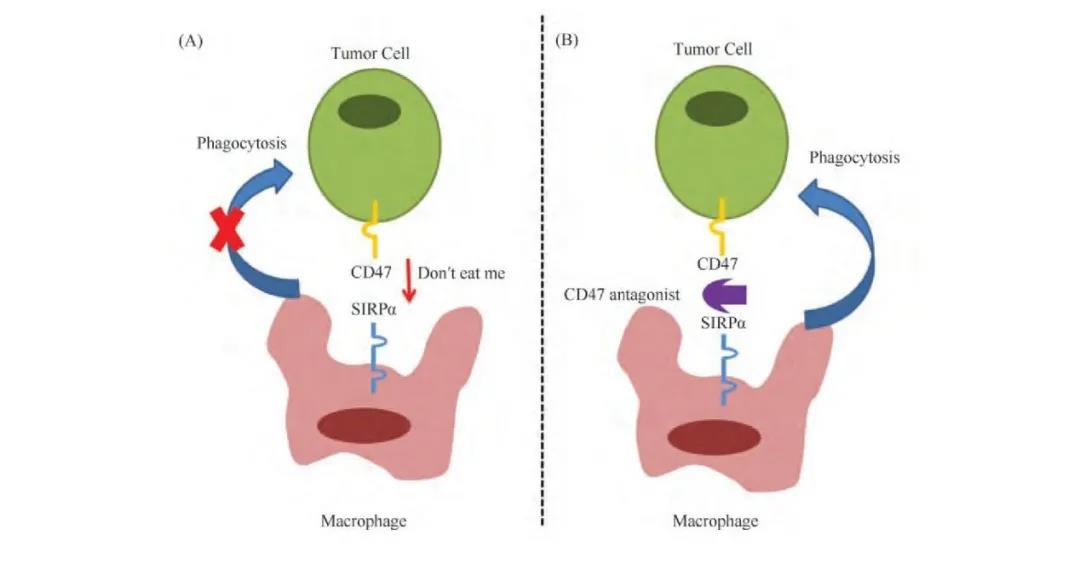
CD47抑制剂作用原理
来源参考文献[5]
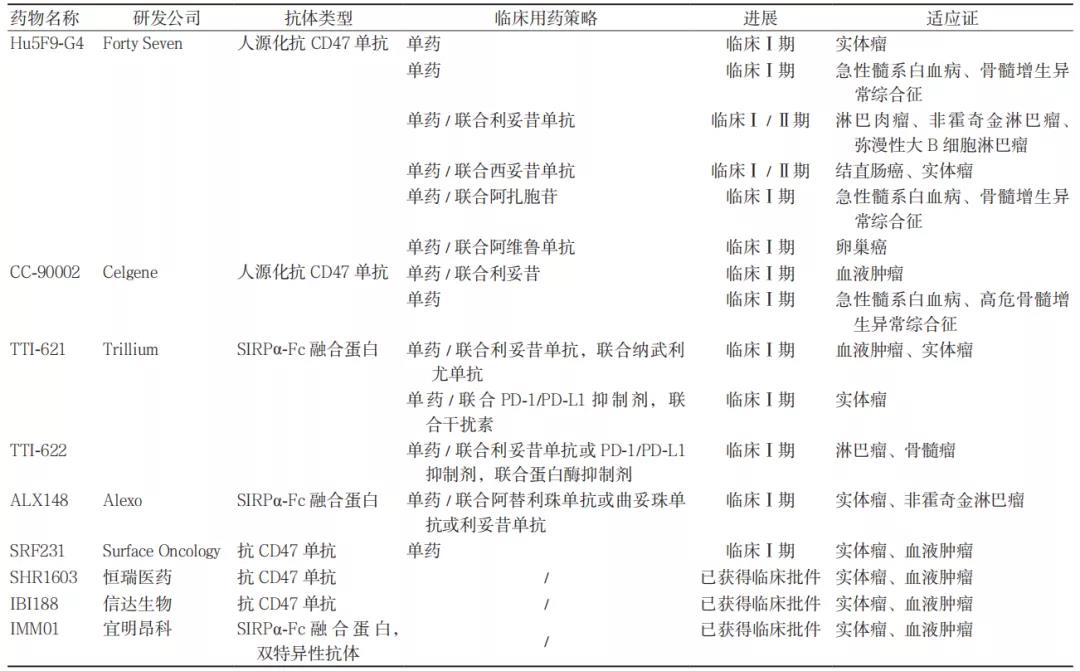
CD47 靶点在研药物
CD47抗体药物——青铜还是王者?
安全性高
巨噬细胞发挥吞噬效应,不仅需要细胞表面CD47的“别吃我”信号,也需要靶向细胞表面钙网织蛋白(CRT)的“吃我”信号的协同作用。通常情况下肿瘤细胞高表达CRT而正常细胞并不表达"吃我"信号,故阻断CD47并不能引发巨噬细胞对正常细胞的吞噬效应,可见CD47抗体药物的副作用也十分小,为临床的广泛应用提供了最核心的保障。
有效性高
CD47广泛地表达于各类癌细胞表面,因此可以用于治疗各种类型的癌症,具有更为广谱的效应,拥有更多的潜在受益人群。且有研究表明,CD47抗体可以介导CD8+T对肿瘤实现特异性杀伤作用。也就是说,CD47抗体不但能激活机体天然的免疫能力,还能同时激活机体的适应性免疫能力,使得其有机会不再像PD-1/CTLA-4抗体一样,只能对一小部分患者发挥治疗作用,这也可能成为CD47抗体药物优于既往免疫抑制剂的一个重要原因。
综上,CD47抗体药物无论从安全性还是有效性均表现出令人振奋的效果,让我们有信心相信其是继PD-1/PD-L1之后,肿瘤免疫领域靶点抑制剂的新王者。
最新研究进展
单药治疗

ASCO 2020国际会议上公布了CD47的免疫检查点抑制剂TTI-622治疗复发难治性淋巴瘤的I期临床最新数据。TTI-622与同类药物TTI-621均为SIRP&α;-Fc融合蛋白,这类药物最大特点为只结合肿瘤细胞的CD47,不结合红细胞表面的CD47,从而可以降低患者的贫血风险;同时通过避免大规模的“抗原沉默”现象,降低药物使用剂量。
两药的不同在于Fc亚型不同,TTI-621和TTI-622分别采用IgG1 Fc和IgG4 Fc,而TTI-622的IgG4 Fc区与Fc受体的相互作用比IgG1更为有限,因此推测TTI-622会向巨噬细胞传递更适度的“吞噬”信号。
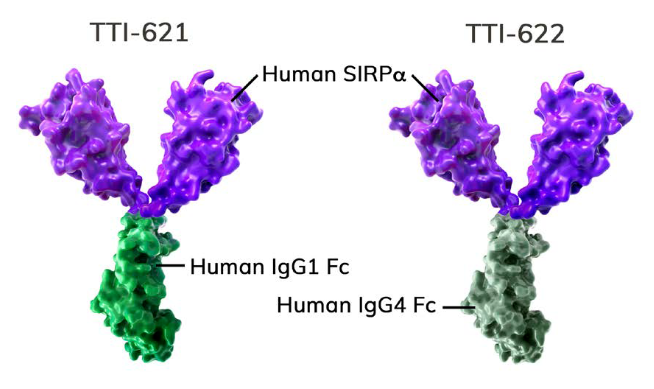
TTI-621、TTI-622作用机制
来源Trillium Therapeutics Inc.
TTI-622的I期临床入组患者,都经过至少2种标准治疗方案或还没有获批疗法。研究结果显示,19例入组的淋巴瘤患者中,已经观察到1例完全缓解(CR),1例部分缓解(PR);TTI-622的耐受性良好,3级以上治疗相关副作用仅发生2例(中性粒细胞减少)。
联合治疗
除了单药治疗以外,CD47抗体联合其它药物治疗白血病、淋巴瘤、和实体瘤也在临床研究中。美国血液学会(ASH)大会公布了 CD47 抗体Magrolimab(Hu5F9-G4)联合化疗药阿扎胞苷(AZA)治疗骨髓增生异常综合征(MDS)与急性骨髓性白血病(AML)的最新临床进展。结果显示,Magrolimab+AZA联合治疗在该适应症上展现了可持续的疗效。
对于高危MDS患者,MDS 平均随访时间为 6.4 个月,客观缓解率(ORR) 为 92%(22/24),完全缓解率(CR)为 50%(12/24);
对于不适合化疗、未经治疗的 AML 患者,平均随访8.8 个月,ORR 为 64%(14/22),CR 为 41%(9/22);
双特异性抗体

双特异性抗体是含有 2 种特异性抗原结合位点的人工工程化抗体,具有同时结合两个不同抗原表位的能力,可在靶细胞和功能细胞之间架起桥梁,激发具有导向性的免疫反应,发挥一些特殊的生物学功能。
今年年初,新型CD47/PD-L1双特异性抗体IBI322在中国获得临床试验默示许可,适应症为实体瘤和血液肿瘤。2020年8月3日,该双特异性抗体的I期临床研究完成中国首例患者给药。该项研究(CIBI322A101)是一项在中国开展的评估IBI322治疗晚期恶性肿瘤受试者的Ia/Ib期临床研究,旨在明确该药在标准治疗失败的晚期恶性肿瘤受试者中的安全性、耐受性和抗肿瘤活性。
临床前研究显示,IBI322可有效阻断SIRP&α;与CD47结合,诱导巨噬细胞对表达CD47的肿瘤细胞发挥吞噬作用,能力与抗CD47单抗相当;同时IBI322也可有效阻断PD-1与PD-L1结合,激活CD4+T淋巴细胞,能力与抗PD-L1单抗相当。通过靶向CD47和PD-L1两个通路,IBI-322有望增强机体对肿瘤细胞的杀伤能力,IBI322的I期临床研究结果也更值得期待。
总结与展望
CD47-SIRP&α;是首个在癌症中被发现的发挥吞噬作用的免疫检查点,以目前的数据来说,无论是CD47单抗、SIRP&α;-Fc融合蛋白还是核酸类不同的药物结构,它们单药治疗、联合治疗,甚至是双特异性抗体,均显示出超越既往检查点抑制剂疗效的潜质,毋庸置疑,靶向CD47提供了一个不同于既往免疫检查点的良好肿瘤治疗策略。
CD47 作为继 PD1/PDL1 后下一个天然的免疫检查点,具有同时激活天然免疫以及适应性免疫的能力,有着极高的临床开发价值及应用前景,其抗体药物疗效已在多个肿瘤类型领域初露头角,包括血液系统肿瘤、肺癌、肝癌等在内的常见肿瘤。多个 CD47 靶向药物已进入临床试验阶段,相信不久的将来在该领域会有更大的突破及研究成果公布,该类药物走向患者人群也指日可待。
参考文献
[1] Barclay AN, Van den Berg TK.The interaction between signal regulatory protein α(SIRPα) and CD47:structure, function, and therapeutic target.
[2] CD47Blockade Triggers T Cell–Mediated Destruction of Immunogenic Tumors.
[3] Onbeing less tolerant: enhanced cancer immunosurveillance enabled by targetingcheckpoints and agonists of T cell activation.
[4] Ongoing, first-in-human, phase I dose escalation study of the investigational CD47-blocker TTI-622 in patients with advanced relapsed or refractory lymphoma.
[5] 杨赟,张子恒,张朋飞. CD47分子与抗肿瘤免疫[J]. 中国生物化学与分子生物学报,2018,03:262-266..
[6] CD47免疫功能与靶向药物的研究进展./CD47分子在抗肿瘤免疫中的应用./CD47:PD-1之后的神药来了?
[7] 国家药品监督管理局药品审评中心—临床试验默示许可—IBI322.