肿瘤免疫治疗标志物的进展与思考
免疫检查点抑制剂的问世,引领了癌症治疗的重大变革。然而,目前免疫治疗的精准生物标志物仍未明确。近期发布在Current Opinion in Chemical Biology杂志上的一篇综述,系统性介绍了目前肿瘤免疫治疗的生物标志物研究进展以及各个标志物的局限性,并探讨未来开发组合标志物的可能性。
在免疫治疗新时代,临床医师和病理科医师需要共同关注肿瘤免疫治疗标志物的进展,以更好地指导精准医学时代的免疫治疗。

背景
免疫治疗引领了多个肿瘤治疗领域的变革,尤其是靶向程序性死亡受体1/配体1(PD-1/ PD-L1)单抗。然而,仅有部分患者可以从PD-1/ PD-L1单抗治疗中获得持久疗效和长期生存。目前,针对如何实现精准免疫治疗,研究者开始了诸多尝试,探寻生物标志物。事实上,生物标志物仍然是免疫治疗的重大挑战,不仅可以帮助我们筛选能够从免疫治疗中获益的人群,还能够避免治疗不响应者的不必要的花费、超进展和可能的严重毒性。此外,生物标志物还可以帮助我们筛选免疫联合治疗的合适人群。PD-L1表达作为PD-1单抗直接的作用靶点,是肿瘤组织上的一个重要标志物,也是目前研究最为深入的标志物,但关于PD-L1表达的预测价值,在不同瘤种中,研究结论不一。由此引发了对分子生物标志物、循环生物标志物和影像生物标志物的探索。
近期,发布Current Opinion in Chemical Biology杂志上的一篇综述[1],系统性介绍了目前肿瘤免疫治疗的生物标志物研究进展,包括目前熟知的PD-L1表达以及一些新的标志物,覆盖组织生物标志物、分子生物标志物、循环生物标志物以及影像生物标志物,见图1、表1。研究总结了这些生物标志物目前的研究进展(表2)以及各自的优点和局限性;同时探讨了未来采用组合生物标志物的策略。
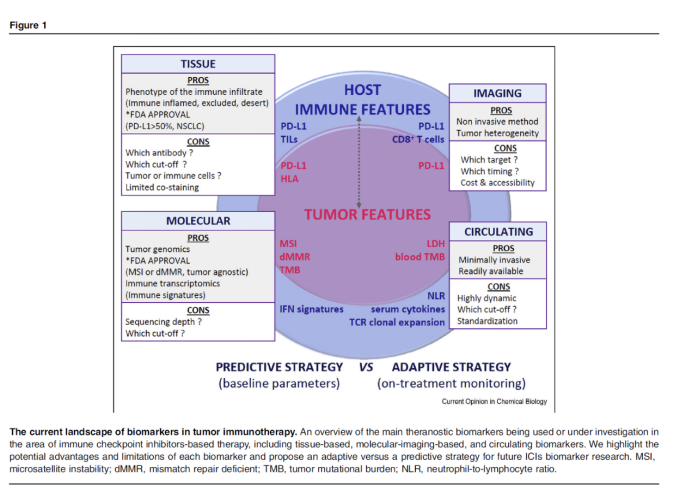
图1. 当下肿瘤免疫治疗生物标志物谱
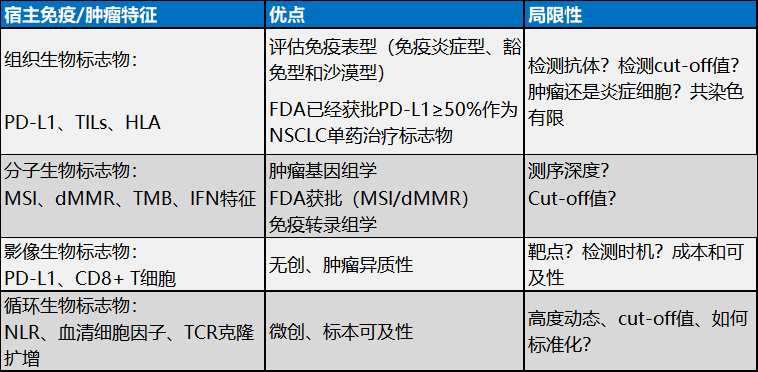
表1. 目前肿瘤免疫治疗生物标志物及其优缺点
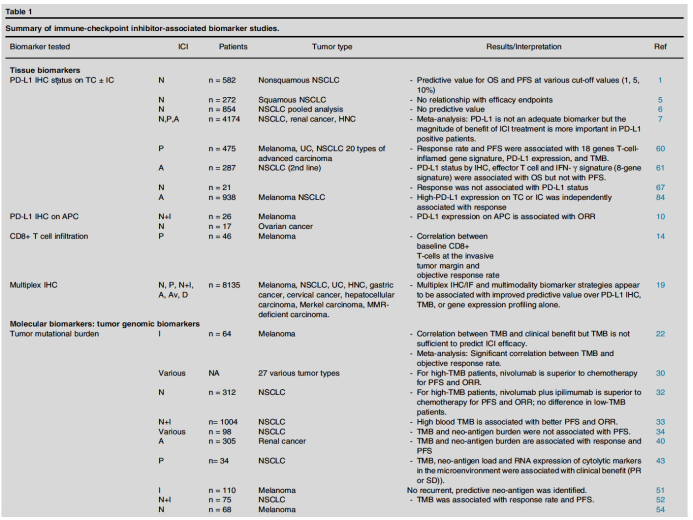
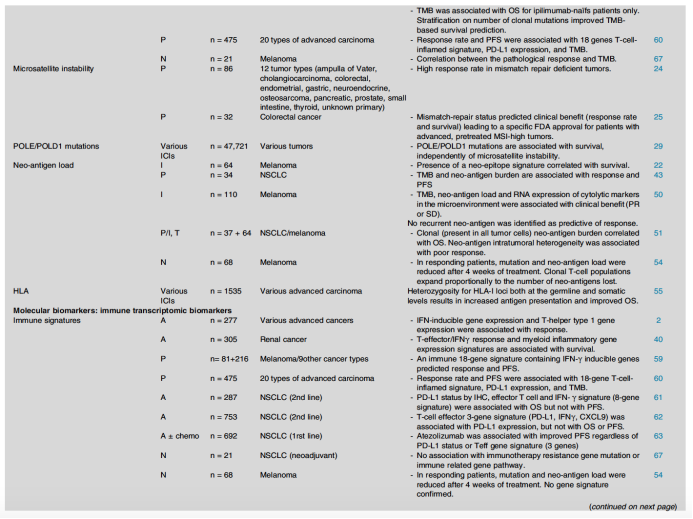
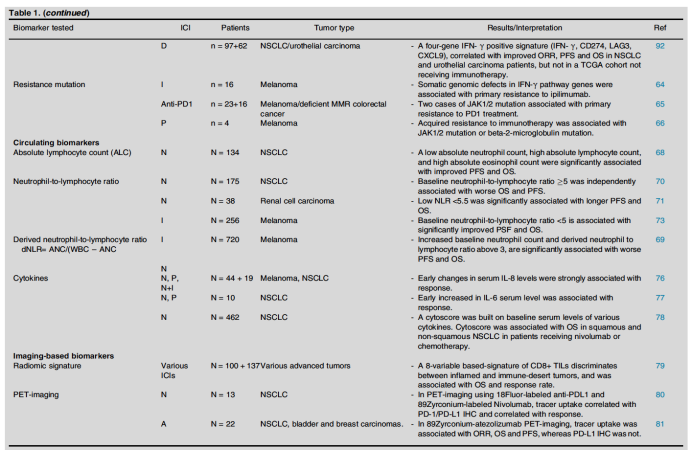
表2. 免疫检查点抑制剂相关的标志物研究进展
专家解读与点评
(一)免疫治疗与靶向治疗均应纳入精准医学范畴
免疫治疗与靶向治疗均应纳入精准医学范畴,也应使用精准医学的思路进行研究。与经验医学不同,精准医学试图通过一些明确的分子标志物筛选出精确的获益人群,通过早期的转化医学研究和后期临床循证医学辅助得到相关的评效数据。在目前all-comer的大趋势之下,应深入理解和思考疗效背后的机制。机制层面深入研究会帮助我们更加合理地设计免疫治疗的研究,甄别出哪些病人可以从免疫治疗中获益甚至受害。只有完成精确甄别,免疫治疗才真正进入精准医学时代,而不是目前经验和精准医学混合的状态。
我们今天重点讨论的问题是免疫治疗是否真的无关患者分子亚型,“来者不拒”。目前很多的免疫治疗的研究入组均采用“all-comer”方式,虽然后续进行回顾性分析,但绝大多数研究在入组时都不使用如PD-L1、肿瘤突变负荷(TMB)等指标作为分组标准,这已成为几乎所有免疫治疗研究采用的通用模式,但显然不是精准医学临床研究的最佳模式。
(二) 免疫治疗分子标志物:复杂但有迹可循
发布在Current Opinion in Chemical Biology杂志上的这篇综述,就免疫治疗生物标志物,提示有两个非常重要的观点:首先,免疫治疗也有分子标志物。不同于靶向药物的基因突变,免疫治疗的分子标志物复杂程度更高。此外,免疫治疗分子标志物虽复杂,但仍有内在规律可循,即生命的中心法则。这其中主要涉及到基因组学,转录组学和蛋白组学三个层面。
第一,基因突变层面,应更关注个体基因突变与肿瘤的相关性,加深对群体基因机制层面理解。个体基因突变是指某个基因突变,而群体基因突变则侧重于整个基因组的突变共性。从个体角度而言,主要注意两点。首先,要遵循循证医学证据进行相应研究。一些有明确驱动基因阳性的肿瘤,可能对免疫治疗效果不佳,如EGFR突变用免疫治疗会引起超进展。然而,最新一项研究显示,RET基因可能与免疫治疗有正相关性[2],这就提示并非所有驱动基因突变都不利于免疫治疗应用,这在我的临床工作中也得到印证。后续,我们应该关注免疫治疗临床研究中被排除在外的基因突变患者。其次,免疫治疗的疗效可能与某些基因突变存在正负作用:如KRAS突变目前被认为是免疫治疗正向调节基因,TP53预示免疫治疗整体效果较好。此外,我们还应该对突变机制有更为深入的了解,如POLE基因突变可能因为位点不同导致疗效差异。
群体基因是基因突变的另外一个层面。首先,群体基因突变通常预示着一些分子信号通路的改变。如错配修复缺陷(dMMR)可看作是系统性基因错配修复误差,系统误差大,基因转录出错的几率就高,进而提高了免疫治疗对出错抗原识别的概率,预示更好的免疫疗效。其次,应更加关注TMB的本质和来龙去脉,理解TMB基因来源对了解检测技术有很大帮助[3]。目前在国内难以保证检测公司进行panel等效性验证。在TMB领域里,国内的检测厂家基于TMB开展的有效的免疫治疗研究还少,还需要这方面的经验和积累。总体而言,目前对TMB的价值仍无定论。
最后,应关注TCR基因突变为肿瘤新抗原识别创造的多样性。人体通过TCR和组织相容性复合物(MHC)进行肿瘤抗原的识别。基因层面出现的变化越多,蛋白水平的识别区域会更丰富,识别肿瘤新抗原的可能性就越大。
第二,转录组学在免疫治疗中的作用尚未在循证医学层面上得到证实。总体来讲,RNA水平的研究在免疫治疗领域仍处于探索阶段,主要分为两类:一类是DNA功能转化过程中的多样性;另一类关注炎症因子、趋化因子的作用。转录组学上,可以更好的分辨功能型T细胞和“看客”T细胞,进而区分淋巴细胞是否真正参与到抗肿瘤效应中。需要注意的是,但从前沿的转化医学到累计循证医学证据,仍需要时间。
第三,从蛋白质的水平看免疫治疗。这方面的研究较多,争论也更为突出。目前蛋白质水平最为经典的还是PD-L1检测在免疫治疗中的指导意义。不同的免疫治疗药物和不同抗体之间有对应关系,这也为临床应用制造了相当的难度。单从组织病理样本中判断患者PD-L1表达存在一定局限性。从临床现状而言,PD-L1表达水平与获益人群之间的关系不明确,PD-L1高表达的人群获益明显,阴性人群亦有获益。同时,不同抗体、平台检测、阈值及判读的主观性对PD-L1的预测结果亦有影响,单一PD-L1表达水平难以较好地衡量复杂的肿瘤微环境。对待PD-L1检测,仍需用精准医学的观念看待:①PD-L1仍是目前免疫治疗的重要分子标志物,在肺癌领域检测标准逐步成型。刚刚发表在JTO上的文章[4],对PD-L1检测做了规范化的介绍。②PD-L1检测与药物的关系在帕博利珠单抗中体现得相对更好,如KEYNOTE-024研究中[5],未经治疗的PD-L1肿瘤比例评分≥50%且无EGFR/ALK突变的晚期非小细胞肺癌患者,相较于进行铂类化疗,帕博利珠单抗显著改善了无进展生存(PFS)和总生存(OS),见图2。③PD-L1与TMB之间没有直接联系,但TMB与PD-L1均高的情况可能提示从免疫治疗获益,甚至可以考虑单药治疗。④PD-L1目前仍是不完美的标志物,表达较低仍有治疗机会,免疫治疗药物对PD-L1低表达患者的作用机制还在探索中。⑤需更多关注PD-1受体,即从PD-1/PD-L1完整通路与两者对应关系角度看待治疗。⑥PD-L1表达的影响因素非常多,不同部位的PD-L1表达对疗效影响也不同,如最新研究发现部分淋巴结转移的肺癌患者,PD-L1高表达并不与免疫治疗疗效相关[6]。⑦PD-L1表达具有动态性,且能通过外泌体形式释放并聚集至淋巴结。⑧通过循环肿瘤细胞检测PD-L1的表达,可能成为一种无创、安全、准确,可以预测疗效和动态监测的技术。
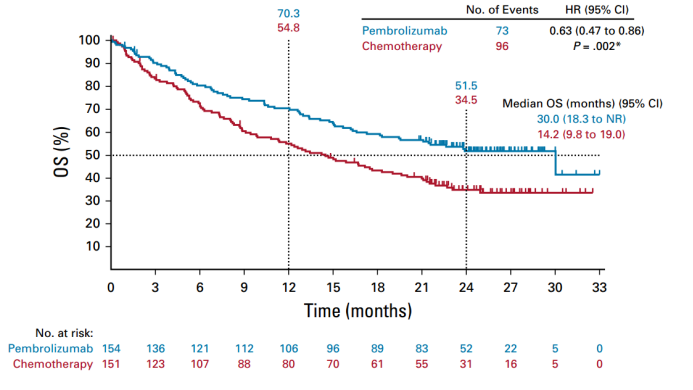
图2.KEYNOTE-024研究中帕博利珠单抗较化疗显著改善总生存
除基因层面上的一些探索之外,影像组学也开始了初步研究,但目前影像组学在免疫治疗方面的应用研究仍处于转化医学阶段,需较长时间发展。通过影像组学构建,间接识别免疫治疗相关的分子标志物,可以获取分子标志物动态表达情况。该技术的应用依赖于中心法则各个阶段标志物是否有明确的临床意义,但前景值得期待。功能影像学方式为临床治疗的疗效预测、动态监测、预后评估创造了机遇。
(三)增加多学科诊疗模式(Multiple Disciplinary Team,MDT)和癌症分子诊断专家组(Molecular Tumor Boards, MTB)模式,迎接新时代的挑战
在免疫治疗时代,无论是转化还是循证研究,都更加依赖新的分子病理学技术,这需要大量的病理学医师从传统病理向分子病理转化。MDT即多学科诊疗模式,是从临床角度讨论肿瘤治疗问题,主要涉及内外科、影像科及相关学科专家等组成的专家团队,目前已成为肿瘤诊疗的重要形式。而MTB作为一种新兴多学科协作的模式,主要目的是从分子层面讨论肿瘤治疗问题,以肿瘤学临床医生、病理医生、临床药师和生信专家为核心成员,解读肿瘤患者的病理报告和基因检测报告,为肿瘤患者制定治疗方案。无论哪种协作形式,对临床医生和病理医生而言,都是新的挑战。在这里,由衷希望能够创造更多机会让病理与临床医生一起参与讨论,增加MDT、MTB等形式的交流,为迎接新时代下的研究与治疗挑战做好准备。
参考文献
[1]Audrey Bellesoeur, et al. Advances in theranostic biomarkers for tumor immunotherapy. Current Opinion in Chemical Biology.2020;56:79–90.
[2]Lu Chang, et al. Association of genetic and immunocharacteristics with clinical outcomes in patients with RET-rearranged non-small cell lung cancer: a retrospective multicenter study. Journal of Hematology & Oncology.2020;13:37.
[3]Mark Lee, et al. Tumor mutational burden as a predictive biomarker for checkpoint inhibitor immunotherapy, Human Vaccines & Immunotherapeutics.2020; 16:1, 112-115.
[4]Sylvie Lantuejoul, et al. PD-L1 Testing for Lung Cancer in 2019: Perspective From the IASLC Pathology Committee. Journal of Thoracic Oncology Vol. 15 No. 4: 499-519.
[5]Martin Reck, et al. Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non–Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater. published at jco.org on January 8, 2019.
[6]Gang Chen, et al. Exosomal PD-L1 Contributes to Immunosuppression and is Associated with anti-PD-1 Response. Nature.2018;560(7718):382–386.