最强治愈时代! 双免疫治疗8项新数据全面汇总, 超60%患者可实现长期生存
作为一款当红的“抗癌神药”,PD-1抗体已经在绝大多数癌种中取得了非常惊艳的疗效,但有效率仍然是它的硬伤:单药使用,PD-1抗体仅对约20%的人群有效。
于是,在临床治疗中,PD-1抗体的联合治疗成了更优选择,既能大幅提高治疗的有效率,还有1+1>2的妙用。
目前,临床上最主流的联合方案分别是PD-1联合化疗,以及PD-1联合其他免疫药物,也就是我们常说的“双免疫治疗”。今天,我们要谈的主题就是双免疫治疗的疗效。
到目前为止,双免疫治疗(PD-1抗体+CTLA-4抗体)已经被批准用于部分晚期非小细胞肺癌、肾癌和恶性黑色素瘤的一线治疗(也就是首选治疗)。不过,相比于PD-1抗体联合化疗(已经在晚期非小细胞肺癌、食管癌、鼻咽癌、三阴性乳腺癌、胃癌等多种实体瘤中获得三期临床试验的成功),双免疫治疗的势头似乎暂时处于下风。
但是,双免疫治疗,从机制上讲,可以在肿瘤免疫循环的多个维度,促进机体抗癌免疫反应的发生和维持,在诱导抗癌免疫反应维持更持久的疗效方面,或许有更大的优势。
因此,在过去的一段时间里,研究者们依然在不遗余力地推动双免疫治疗在实体瘤诊治的各个阶段中的应用——在过去的3个月里,有8项双免疫治疗用于实体瘤的临床试验数据公布,其中几项甚至有划时代的意义。今天,咚咚将这8项研究汇总在一起,分享给大家。
1 用于术后恶黑患者的辅助治疗疾病复发风险比单药PD-1降低一半
一直以来,专家和病友都在疑惑:既然单药PD-1抗体在恶性黑色瘤等实体瘤患者中能起效了,那么双免疫治疗到底能不能提高疗效,甚至提高治愈率?
IMMUNED研究是一项多中心2期临床试验,入组的是手术已经将全身病灶切除干净的晚期恶性黑色素瘤患者,1:1:1分组,一组接受双免疫治疗进行巩固,一组接受单药PD-1抗体进行巩固,一组接受安慰剂对组。167名患者参与了这样研究,中位随访28.4个月。
结果提示:三组2年的无疾病进展生存率分别是70%、42%和14%。
也就是说,在安慰剂对照组,86%的病人在2年内肿瘤已经复发转移;在单药PD-1抗体组,58%的患者在2年内肿瘤已经复发转移;而双免疫治疗组,只有30%的患者疾病出现了复发转移。相比于单药PD-1抗体,双免疫治疗优势明显。
更重要的是,从生存曲线上看,双免疫治疗组疾病复发转移的风险在18-24个月后基本就处于平台期了;也就是说,绝大多数患者如果2年内不出现疾病复发转移,这些病人后续就大概率可以长期生存了。
那么,这些经过手术切除干净的晚期恶性黑色瘤患者,原本的临床治愈率只有15%左右,现在提高了接近70%——双免疫治疗,让临床治愈率提高了4倍!当然,这只是小规模数据,3期临床试验还在进行中。

2 用于眼脉络膜恶黑有效率突破个位数
PD-1抗体免疫治疗最敏感的实体瘤就是恶性黑色素瘤,在皮肤型恶性黑色素瘤中,单药PD-1抗体就可以取得30%-40%的有效率,双免疫治疗的有效率甚至高达60%。
但是,对于黏膜来源的恶性黑色素瘤,尤其是眼脉络膜来源的恶性黑色瘤,单药PD-1抗体的有效率低于5%。
近期,一项入组89名难治性晚期眼脉络膜恶性黑色瘤患者的2期临床试验,给出了略正能量的答案:
双免疫治疗用于此类患者的有效率为12%、控制率为36%,中位总生存时间为15个月,疗效维持时间最长的超过了30个月。

虽然疗效依然不算好,但是至少已经比单药免疫治疗进步了一大步。
3 用于单药PD-1耐药后的晚期肾癌有效率20%
PD-1抗体单药治疗失败后的晚期实体瘤患者,是不是就从此与免疫治疗无缘了?其实不是的,一部分患者还可以从双免疫治疗中再次获益。
JCO杂志公布的一项小规模临床试验显示:
45名PD-1抗体单药治疗失败的晚期肾癌患者,接受了双免疫治疗,客观有效率为20%,中位无疾病进展生存时间为4个月,起效的患者疗效维持时间较长,其中至少2名患者已经疗效维持时间超过1年。
4 用于复发难治的卵巢癌有效率31.4%
卵巢癌,主要靠外科手术、传统化疗以及PARP抑制剂治疗为主。一直以来,免疫治疗用于卵巢癌,数据都不算太好。
近期,JCO杂志公布的2期临床试验,数据还不错。100名铂类化疗短期内(62%的患者是半年内)就复发转移的难治性晚期卵巢癌患者,接受了免疫治疗。49名患者接受的是PD-1抗体单药治疗,51名患者接受的是双免疫治疗:
PD-1抗体单药治疗组有效率为12.2%,双免疫治疗组有效率为31.4%,两组的无疾病进展生存期分别为2个月和3.9个月。

5 用于伴肉瘤样分化的晚期肾癌有效率超60%
肾癌,绝大多数都是透明细胞癌,但是其中也有一部分患者是其他少见病理类型,比如合并肉瘤样分化的肾癌。双免疫细胞用于这类特殊类型的晚期肾癌患者,一直缺少大规模数据。
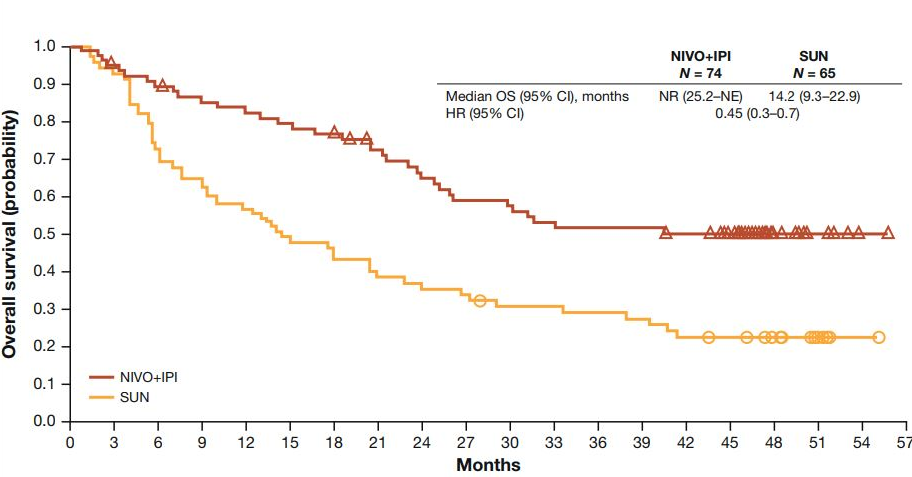
入组上千名患者的国际多中心三期临床试验checkmate214研究中,可以把伴肉瘤样分化的肾癌患者,专门挑出来分析一样,样本量还不小。
总人群1096名患者中,有139名中高危的伴肉瘤样分化的晚期肾癌患者,其中接受双免疫治疗的患者有74人,接受索坦治疗的有65人:
接受双免疫治疗组,有效率高达60.8%(接受索坦治疗组只有23.1%),其中包括18.9%的患者肿瘤完全消失(索坦组只有3.1%)。
更重要的是,长期随访下来,接受双免疫治疗这一组,有超过50%的患者长期生存、临床治愈,导致中位总生存期尚未达到/无法计算。
6 用于微卫星稳定的胆道系统肿瘤疾病控制率44%
胆管癌、胆囊癌,是比胰腺癌更难治、生存期更短的癌王。其中一小部分患者为微卫星不稳定(MSI阳性)的患者,这类患者接受免疫治疗,自然疗效很好。
但是MSI阳性或者肿瘤突变负荷TMB高的胆管癌患者,毕竟只占少数,对于绝大多数MSS(微卫星稳定)的患者而言,双免疫治疗,或许是一条出路。
39名复发难治的晚期胆管癌患者,接受了双免疫治疗,客观有效率为23%、疾病控制率为44%。

起效的患者基本都是胆囊癌和肝内胆管癌患者,疗效维持的中位时间尚未达到。
7 用于口腔鳞癌新辅助治疗病理缓解率73%
中晚期口腔鳞癌,需要接受放化疗和手术综合治疗。近期,也有学者开始探索,利用免疫治疗作为手术前的新辅助治疗。
14名患者接受了PD-1抗体单药作为手术前的新辅助治疗,15名患者接受了双免疫治疗。29名患者均在计划的时间内顺利完成了手术,没有因为免疫治疗新辅助而导致手术被耽搁,数据显示:
两组的病理缓解率为54%和73%。其中分别有1名和3名患者实现了主要病理学缓解(也就是说切下来的肿瘤组织里,癌细胞的成分已经小于10%,甚至是完全没有了)。中位随访14.2个月,89%的患者依然健在(另外1名患者死于脑梗发作,和肿瘤无关)。
8 长期随访数据揭晓部分患者实打实走向治愈
本文要分享的最后一项研究,是国际多中心3期临床试验checkmate214研究长达42个月以后的长期随访数据。这样研究上文已经提及,一共入组了1096名晚期肾癌患者,一组接受双免疫治疗,一组接受索坦治疗。现在我们重点来看接受双免疫治疗这一组,长期随访下来,得出的几个最重要的结论:
①
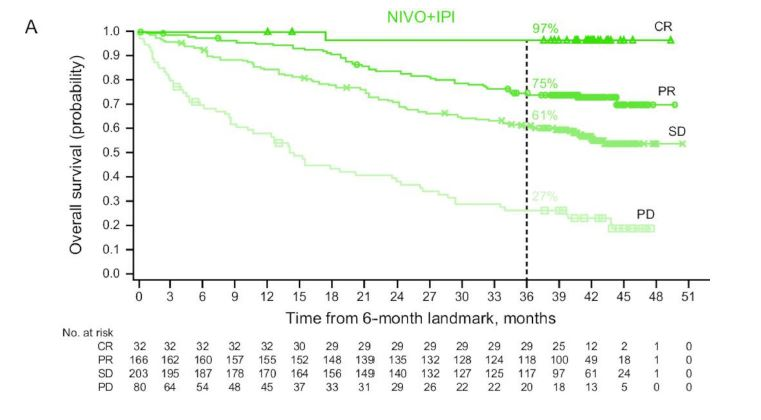
一开始疗效越好的患者,临床治愈率越高。这句话好像是一句废话,但是在肿瘤治疗中,并不是一定如此的。比如,晚期小细胞肺癌患者,一线接受双药化疗,60%甚至更高比例的患者,肿瘤都会大面积缩小,但是几个月后就反弹回来了。
因此,一开始疗效好,并不一定能保证疗效能长期维持。但是,双免疫治疗做到了。一开始实现了肿瘤完全缓解(CR)的病人,97%的患者实现了3年生存,临床治愈率有望达到95%左右;一开始实现了肿瘤部分缓解(PR)的病人,75%的患者实现了3年生存,临床治愈率有望达到65%左右;一开始实现了肿瘤稳定(SD)的病人,61%的患者实现了3年生存,临床治愈率有望达到50%左右;一开始对双免疫治疗就是无效,疾病进展(PD)的病人,3年生存率只有27%,经过其他治疗后,能实现临床治愈的希望大约只有15%。
②
双免疫治疗一旦起效,大多数患者不再发生耐药。免疫治疗起效的患者,一部分后续依然会发生耐药,只是相比于传统化疗和靶向药,免疫治疗疗效维持时间更长。
但是,双免疫治疗可以让更多的病友实现免疫记忆,从而实现疗效长期维持。从下图可以看出,双免疫治疗组,治疗起效的患者,超过60%的患者疗效维持时间超过了4年,有望长期维持。
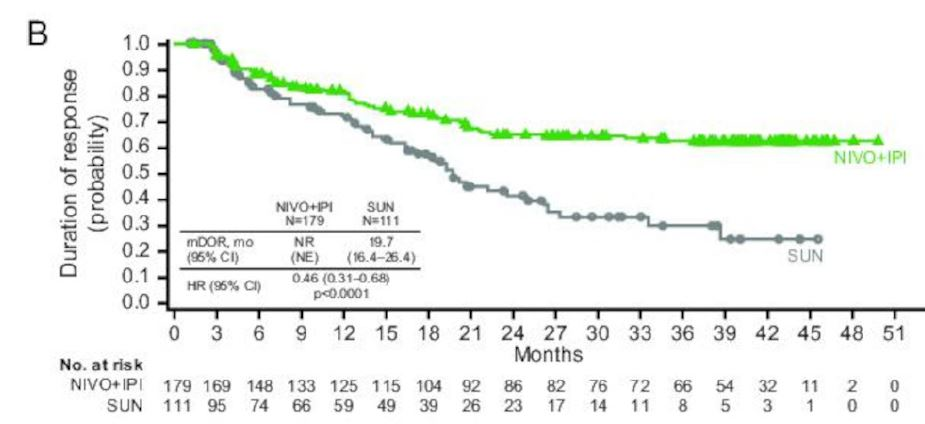
③
正是基于第2点,双免疫治疗有望让部分患者实打实地实现临床治愈。在这项研究中,双免疫治疗组有59名患者实现了肿瘤完全消失。随访4年左右,仍然有20名患者继续在用药(这部分患者比较胆小,怕停药后疾病复发反弹),其他39名患者已经停药,其中包括28名患者停药后疾病一直没有复发。
这28名接受双免疫治疗后实现肿瘤完全消失,用药一段时间后主动停药的患者,目前停药的中位时间已经达到34.6个月,尚未出现疾病复发反弹。晚期的肾癌患者,接受一段时间双免疫治疗,肿瘤就完全消失了,然后就主动停药,停药后长达3年了,肿瘤还没有复发反弹,如果这种疗效进一步维持,那么,实打实可以说是治愈了。
参考文献:
[1]. Adjuvantnivolumab plus ipilimumab or nivolumab monotherapy versus placebo in patientswith resected stage IV melanoma with no evidence of disease(IMMUNED): arandomised, double-blind, placebo-controlled, phase 2 trial.Lancet 2020 May 16;395(10236):1558-1568.
[2]. Ipilimumabplus nivolumab for patients with metastatic uveal melanoma: a multicenter,retrospective study.JImmunother Cancer 2020 Jun;8(1):e000331.
[3]. SalvageIpilimumab and Nivolumab in Patients With Metastatic Renal Cell Carcinoma AfterPrior Immune Checkpoint Inhibitors.JClin Oncol 2020 Jun 3;JCO1903315.
[4]. RandomizedPhase II Trial of Nivolumab Versus Nivolumab and Ipilimumab for Recurrent orPersistent Ovarian Cancer: An NRG Oncology Study.JClin Oncol 2020 Jun 1;38(16):1814-1823.
[5]. Efficacyand Safety of Nivolumab Plus Ipilimumab versus Sunitinib in First-LineTreatment of Patients with Advanced Sarcomatoid Renal Cell Carcinoma. ClinCancer Res 2020 Sep 1;clincanres.2063.2020
[6]. NeoadjuvantNivolumab or Nivolumab Plus Ipilimumab in Untreated Oral Cavity Squamous CellCarcinoma A Phase 2 Open-Label Randomized Clinical Trial.JAMA Oncol. doi:10.1001/jamaoncol.2020.2955
[7]. Evaluationof Combination Nivolumab and Ipilimumab Immunotherapy in Patients With AdvancedBiliary Tract Cancers: Subgroup Analysis of a Phase 2 Nonrandomized ClinicalTrial.JAMA Oncol 2020 Jul30;e202814. doi: 10.1001/jamaoncol.2020.2814.
[8]. Survivaloutcomes and independent response assessment with nivolumab plus ipilimumabversus sunitinib in patients with advanced renal cell carcinoma: 42-monthfollow-up of a randomized phase 3 clinical trial.JImmunother Cancer 2020 Jul;8(2):e000891