重组人血管内皮抑制素联合放化疗:改善乏氧,提升局部晚期NSCLC疗效
既往有研究表明,肿瘤微环境乏氧不仅有助于肿瘤细胞对化疗产生抵抗,而且有助于肿瘤的转移[1,2],肿瘤氧合是放疗(RT)或放化疗(CRT)有效应用的必要条件[3]。局部晚期非小细胞肺癌(NSCLC)单纯放疗后局部未控和复发率高达60%-80%,主要原因是实体肿瘤含有对放射线抵抗的乏氧细胞。
临床上为了提高放疗疗效,亟需找到能改善乏氧微环境的新疗法。研究发现肿瘤血管异常是引起乏氧最常见的因素之一,抗血管生成治疗可改善组织灌注,降低肿瘤乏氧,促进肿瘤血管正常化。因而,目前抗血管生成治疗联合放化疗成为了治疗局部晚期NSCLC(LA-NSCLC)一种新的探索模式。
截止目前,内源性血管生成抑制剂重组人血管内皮抑制素已初显实力——临床前研究表明重组人血管内皮抑制素能够使肿瘤血管系统正常化,缓解乏氧,增加肿瘤对放射治疗的敏感性[4,5]。多项研究显示重组人血管内皮抑制素联合放化疗展现出良好的疗效和安全性,有望成为不可切除局晚NSCLC的治疗新选择。
最新汇总分析:重组人血管内皮抑制素联合放化疗的疗效和安全性均得到证实
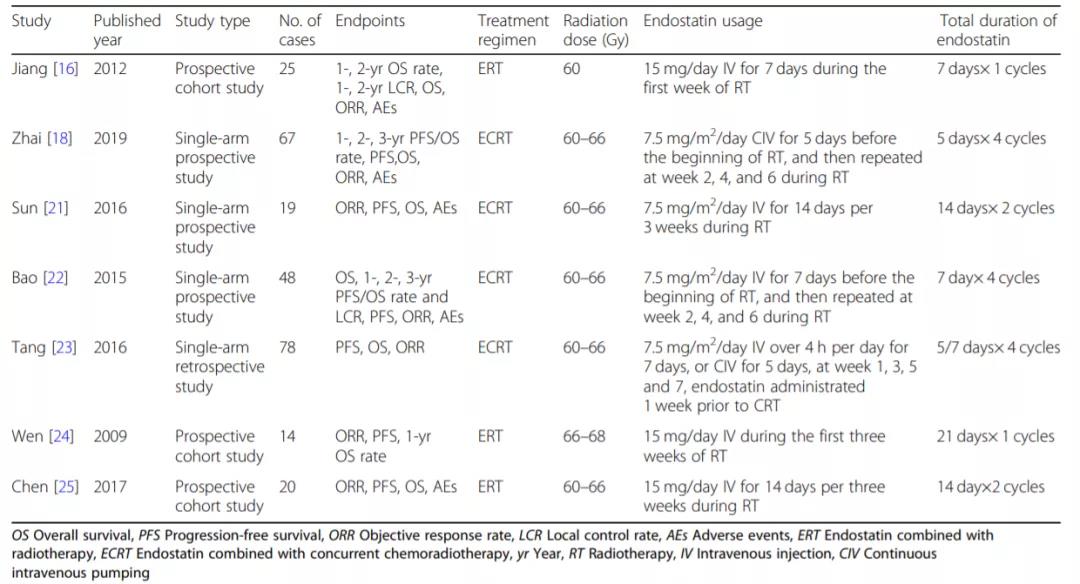
2020年8月,Radiation Oncology发表了一项汇总分析[6],纳入了7个前瞻性/回顾性研究,中位随访时间在20.0-37.1个月,评估了重组人血管内皮抑制素联合放疗(ERT)或同期放化疗(ECRT)对于LA-NSCLC患者的疗效和安全性。主要终点包括:客观缓解率(ORR)、局部控制率(LCR)、总生存(OS)率、无进展生存(PFS)率和不良事件(AEs)。
其中,4项研究中有212名可评估的患者接受ECRT治疗,3项研究中59名可评估患者接受ERT治疗。患者接受的放射总剂量为60-68 Gy/30-34次,持续6-7周。重组人血管内皮抑制素的给药方法因研究而异,包括静脉滴注和持续静脉泵注。
重组人血管内皮抑制素联合CRT的ORR、PFS率、OS率均有不错结果
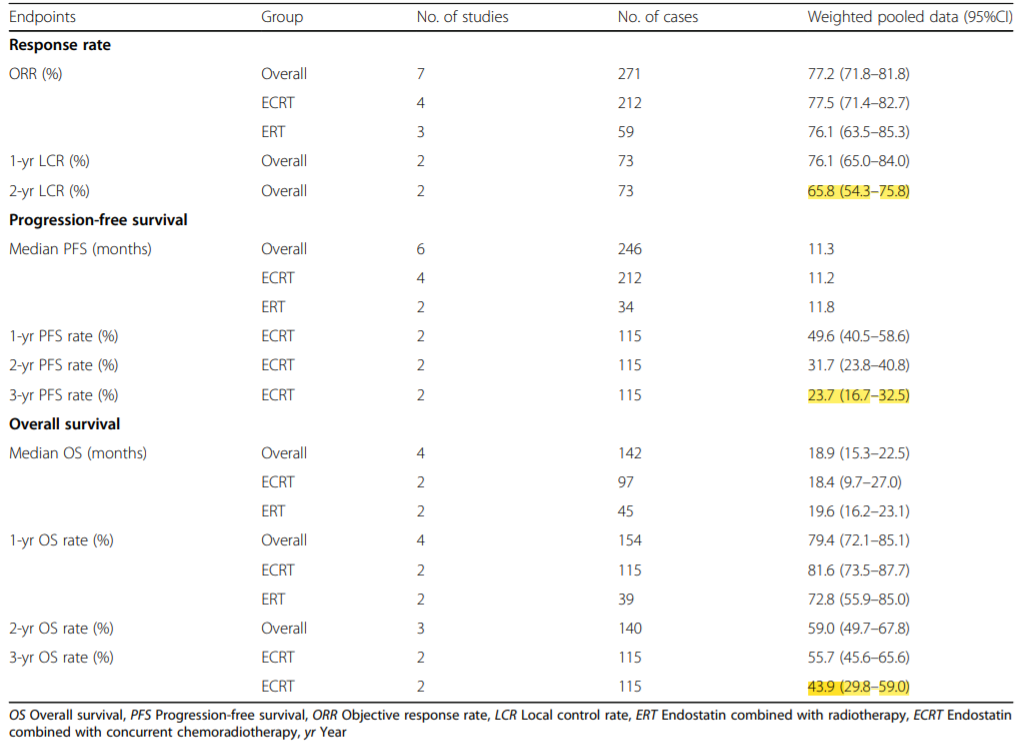
7项研究的合并总ORR为77.2%(95%CI:71.8%-81.8%),ERT组ORR为76.1%(95%CI:63.5%-85.3%);ECRT组ORR达到77.5%(95%CI:71.4%-82.7%)。与单纯RT组相比, ERT组的ORR更高(76.1% vs 61.7%)。
ECRT组中有两项研究报道了PFS率,合并的1年、2年和3年PFS率分别为49.6%(95%CI:40.5%-58.6%)、31.7%(95%CI:23.8%-40.8%)和23.7%(95%CI:16.7%-32.5%)。ECRT组合并的1年、2年和3年OS率为81.6%(95%CI:73.5%-87.7%)、55.7%(95%CI:45.6%-65.6%)和43.9%(95%CI:9.8%-59.0%)。汇总分析显示,重组人血管内皮抑制素联合放化疗用于LA-NSCLC的患者,3年PFS率和3年OS率均取得不错的结果,3年OS率达到了43.9%,优于临床仅采用单纯放化疗的生存结果。
汇总分析中,有两项ECRT和ERT的研究报道了LCR数据。合并的1年、2年LCR率分别达到了76.1%(95%CI:65.0%-84.0%)和65.8%(95%CI:54.3%-75.8%)。
总体的汇总分析显示,中位PFS为11.3个月,ECRT组为11.2个月,ERT组为11.8个月;中位OS为18.9个月,其中,ECRT组为18.4个月,ERT组为19.6个月。
在安全性方面,选定的5项研究中包括179名患者在内的AEs评估显示,最常见的AEs是放疗相关的放射性肺炎、放射性食管炎、血小板减少症和贫血。此外,还包括恶心/呕吐、中性粒细胞减少和白细胞,但整体上重组人血管内皮抑制素联合放化疗的不良反应在可控范围之内。
该汇总分析得出结论:无论联合化疗与否,重组人血管内皮抑制素联合RT都能带来更好的反应率、LCR和生存率,显示出更优的短期和长期生存获益,且不低于既往CCRT随机对照试验(RCT)的结果。提示我们重组人血管内皮抑制素联合CCRT或RT治疗LA-NSCLC是一种有前景的治疗方式。
从理论到循证,重组人血管内皮抑制素联合放疗实现疗效超越
▍理论支撑:重组人血管内皮抑制素改善细胞乏氧,联合放疗可协同增效
实体瘤乏氧可引起对放射治疗的抵抗,导致局部治疗失败。因此,尝试通过肿瘤富氧来提高RT的敏感性是一个新的研究方向[7,8]。肿瘤血管异常是引起乏氧最常见的因素之一,因此改善肿瘤内部异常的血管可能对改善经RT治疗的患者的肿瘤放疗反应至关重要[9]。
大量基础研究证实抗肿瘤血管靶向治疗能使肿瘤血管正常化,改善肿瘤乏氧状态,增加肿瘤的放化疗敏感性。但是2012年发布的一项I期研究显示单靶点抗肿瘤血管靶向药物贝伐珠单抗联合放疗治疗局部晚期NSCLC仅入组六例就因严重的肺毒性导致试验关闭[10]。为了找到既提高LA-NSCLC放化疗疗效,又不增加不良反应的联合方案,临床上开始了新的探索。
重组人血管内皮抑制素是内源性的抗血管生成药物,由XVIII胶原蛋白水解裂解产生,其作用是通过抑制VEGF/VEGFR信号通路抑制内皮细胞增殖,通过抑制整合素和基质金属蛋白酶(MMP)抑制内皮细胞迁移和侵袭,通过抑制肿瘤血管新生抑制肿瘤生长。临床前研究表明,重组人血管内皮抑素可以使肿瘤血管“正常化”,以改善乏氧提高对放射治疗的敏感性[11,12]。
▍经典研究回顾:从临床前试验到临床研究,恩度联合CCRT带来喜人疗效
研究小组在临床试验前开展了探索重组人血管内皮抑制素与放疗联合应用的基础研究。结果显示重组人血管内皮抑制素使用5-7天后,Lewis肺癌移植瘤血管出现正常化现象,乏氧细胞比例降低。进一步研究显示,经重组人血管内皮抑制素处理后肿瘤出现的血管正常化时间窗内,联合放疗可以达到最佳疗效。
在取得基础实验的成果后,研究小组进一步开展了隔周静脉滴注重组人血管内皮抑制素联合放疗治疗局部晚期NSCLC的多中心II期临床研究。其研究结果发表在国际权威期刊Radiotherapy & Oncology上。结果显示:重组人血管内皮抑制素联合CCRT治疗LA-NSCLC安全可行,该研究中83%为IIIB期患者,PFS仍然可以长达9.9个月,OS达到了24个月。1年、2年和3年LCR分别为75%、67%和51%。1年、2年和3年的PFS率分别为48%、27%和16%。1年、2年和3年的生存率分别为81%、50%和30%,表现出可观的生存率和LCR。总体而言,整体的治疗方案耐受性良好[13]。
II期临床研究中发现患者对静脉每日滴注重组人血管内皮抑制素的依从性稍差,而持续静脉泵注给药方式使用方便、依从性好、有利于保持药物在体内稳定的血药浓度。研究者继续设计了评估持续静脉泵注重组人血管内皮抑制素联合EP方案+同期放疗治疗不可切除Ⅲ期NSCLC患者有效性及安全性研究(HELPER)。HELPER研究结果显示重组人血管内皮抑制素联合治疗提高了CCRT的疗效,且毒副反应可以耐受[14]。
HELPER研究从2012年11月到2015年6月,共有73名符合条件的患者入组。所有患者接受6~7周的3DRT 60~66 Gy分30~33次,同期开始重组人血管内皮抑制素持续静脉泵注(7.5mg/m2/24h,120h,14天为一个周期,首次放疗前5天开始给药,共4个周期),依托泊苷50mg/m2第1-5天加顺铂50 mg/m2第1、8、28天重复化疗两程。主要的终点是PFS,次要终点是ORR、 OS、局部无复发生存(LRFS)和毒性。
研究结果显示:ORR达到76.1%,保持了此前的良好数据。中位OS、PFS和LRFS分别为34.7个月、13.3个月和27.1个月。1、2、3年的PFS率分别为50.7%、34.8%和28.2%,OS率分别为82.1%、59.9%和47.7%,而LRFS率分别为72.7%、54.7%和49.9%。
值得注意的是,HELPER 研究中入组患者60%以上都是鳞癌,贴合真实世界情况,其应用范围更广泛。对比既往EP方案同步放疗数据,持续静脉泵注重组人血管内皮抑制素联合EP方案+同步放疗对于不可切除Ⅲ期NSCLC患者的治疗,获得了更高的生存率,且重组人血管内皮抑制素联合CCRT方案完成率高,耐受性好。该研究将开辟全新的抗肿瘤血管靶向治疗联合CCRT的治疗策略,并有望突破局部晚期NSCLC的疗效瓶颈,改变临床实践。
小 结
基于重组人血管内皮抑制素联合CCRT的已有研究数据,对于不可切除LA-NSCLC患者,放疗或同步放化疗联合重组人血管内皮抑制素是一种有效且毒性较小的治疗方案。目前CRT+度伐利尤单抗巩固治疗在不可切除LA-NSCLC中显示了很好的治疗效果,重组人血管内皮抑制素联合CRT+免疫巩固维持治疗的研究正在进行中,未来可能提供一种更有效的治疗策略,值得期待。
参考文献
[1] Toma-Dasu I, Dasu A, Karlsson M. The relationship between temporal variation of hypoxia, polarographic measurements and predictions of tumour response to radiation[J]. Phys Med Biol, 2004, 49(19):4463–75.
[2] Seo Y, Yan T, Schupp JE, et al. Differential radiosensitization in DNA mismatch repair-proficient and -deficient human colon cancer xenografts with 5-iodo-2-pyrimidinone-2′-deoxyribose[J]. Clin Cancer Res, 2004, 10(22):7520–8.
[3] Ansiaux R, Baudelet C, Jordan BF, et al. Mechanism of reoxygenation after antiangiogenic therapy using SU5416 and its importance for guiding combined antitumor therapy[J]. Cancer Res, 2006, 66(19):9698–704.
[4] Jiang XD, Dai P, Qiao Y, et al. Clinical study on the recombinant human endostatin regarding improving the blood perfusion and hypoxia of non-small-cell lung cancer[J]. Clin Transl Oncol, 2012, 14(6):437–43.
[5] Meng MB, Jiang XD, Deng L, et al. Enhanced radioresponse with a novel recombinant human endostatin protein via tumor vasculature remodeling: experimental and clinical evidence[J]. Radiother Oncol, 2013, 106(1):130–7.
[6] Shu-Ling Zhang , Cheng-Bo Han , Li Sun,et al.Efficacy and safety of recombinant human endostatin combined with radiotherapy or chemoradiotherapy in patients with locally advanced non-small cell lung cancer: a pooled analysis[J]. Radiat Oncol, 2020 Aug 24, 15(1):205.
[7] Brizel DM, Sibley GS, Prosnitz LR, Scher RL, Dewhirst MW. Tumor hypoxia adversely affects the prognosis of carcinoma of the head and neck Int J Radiat Oncol Biol Phys[J]. 1997, 38(2):285–9. 37.
[8] Brizel DM, Hage WD, Dodge RK, Munley MT, Piantadosi CA, Dewhirst MW. Hyperbaric oxygen improves tumor radiation response significantly more than carbogen/nicotinamide[J]. Radiat Res, 1997, 147(6):715–20.
[9] Sonveaux P. Provascular strategy: targeting functional adaptations of mature blood vessels in tumors to selectively influence the tumor vascular reactivity and improve cancer treatment[J]. Radiother Oncol, 2008, 86(3):300–13.
[10] Joline S W Lind , Suresh Senan, Egbert F Smit. Pulmonary toxicity after bevacizumab and concurrent thoracic radiotherapy observed in a phase I study for inoperable stage III non-small-cell lung cancer[J]. J Clin Oncol, 2012 Mar 10, 30(8):e104-8.
[11] Peng Q, Li M, Wang Z, Jiang M, Yan X, Lei S, et al. Polarization of tumorassociated macrophage is associated with tumor vascular normalization by endostatin[J]. Thorac Cancer, 2013, 4(3):295–305.
[12] Wu JB, Tang YL, Liang XH. Targeting VEGF pathway to normalize the vasculature: an emerging insight in cancer therapy[J]. Onco Targets Ther, 2018, 11:6901–9.
[13] Yong Bao, Fang Peng, Qi-Chao Zhou, et al.Phase II trial of recombinant human endostatin in combination with concurrent chemoradiotherapy in patients with stage III non-small-cell lung cancer[J]. Radiother Oncol, 2015 Feb, 114(2):161-6.
[14] Zhai Y, Ma H, Hui Z, et al. HELPER study: A phase II trial of continuous infusion of endostar combined with concurrent etoposide plus cisplatin and radiotherapy for treatment of unresectable stage III non-small-cell lung cancer [J]. Radiotherapy and Oncology, 2019, 131:27-34.