泽布替尼在合并心血管疾病CLL患者中的应用分享
我国淋巴瘤发病率呈逐年增高趋势,每年新发病例约10万。淋巴瘤的临床分型复杂,不同亚型预后情况不同,治疗手段也有所差异。但随着人们对疾病的深入认识及新药物和新治疗方案的不断涌现,我国淋巴瘤诊治水平和治愈率得到了显著提高。该系列文章将通过不同亚型淋巴瘤应用创新治疗方案临床诊疗病例的分享,为广大临床医生提供借鉴。
慢性淋巴细胞性白血病/小淋巴细胞性淋巴瘤(CLL/SLL)是一类以进行性淋巴细胞增多、淋巴结肿大和脾脏肿大为特征的成熟B淋巴细胞的血液肿瘤,主要发生在中老年人群。其中,CLL中除骨髓和淋巴组织外还有大量的异常淋巴细胞存在于血液中。近年来,CLL/SLL相关临床研究,特别是新药治疗方面取得了巨大进展。本文将介绍一例应用新型BTK抑制剂治疗存在合并症且为复发CLL患者的诊治经过,以期为临床提供更多借鉴。

王 莉
• 江苏省人民医院血液科副主任医师 ,硕士研究生导师
• 江苏省研究型医院学会淋巴瘤专业委员会青年委员
• 江苏省医学会血液学分会淋巴瘤学组成员
• 江苏省抗癌协会血液肿瘤专业委员会成员
• 中国老年保健协会淋巴瘤专业委员会委员
• 中国医药教育协会淋巴瘤专业委员会委员
病例概况
基本情况
患者男性,61岁。
现病史
患者2010年体检发现血常规示白细胞21.69×109/L,无不适,定期门诊随访复查血常规。2014年初患者发现颈部、腋窝及腹股沟肿块。2014年7月因肿块进行性增大于我院门诊就诊。
2014年7月血常规示:白细胞38.3×109/L、淋巴细胞28.92×109/L、淋巴细胞75.5%。2014年7月血涂片显示:白细胞总数增高,分类淋巴细胞比例增高,形态正常。成熟红细胞大致正常。血小板散在易见。B超提示:胰腺下方极低回声区,部分有融合,较大51×29 mm,双侧腋窝、双侧颈部及双侧腹股沟多发淋巴结肿大,腋窝较大者30×14 mm,颈部较大者29×16 mm。
既往史
糖尿病、高血压。
相关检查
患者于2014年8月入住我科,完善相关检查。
骨髓常规:淋巴细胞比例增高,成熟淋巴细胞比例88.4%,形态大致正常,符合CLL/SLL。骨髓病理:CD5++++,CD20+++,CD23++++,CyclinD1-,符合CLL。
流式细胞术免疫分型:慢性B淋巴细胞增殖性疾病,CLL/SLL。
分子检测示IGHV无突变,IGHV4-59*08,符合率100%。
CLL-FISH结果为P53阴性。染色体正常核型。
2014年8月血常规:白细胞计数79.20×109/L,淋巴细胞计数72.30×109/L,淋巴细胞91.30%,血红蛋白131 g/L,血小板计数151×109/L。
2014年8月4日PET/CT显示:双侧颈部、锁骨窝、颌下、腋窝、肝门、腹主动脉及双侧髂血管周围、肠系膜区、双侧盆壁及腹股沟区等区多发肿大淋巴结,腹腔内部分融合成较大团块,较大者约10.9×4.2 cm,放射性摄取不同程度增高,SUV最大值6.5。脾脏体积增大,放射性摄取弥漫性不均匀增高,SUV最大值3.9。
颈部淋巴结活检病理:肿瘤细胞CD20(++),Pax-5(++),CD5(++),CD23(++),Ki-67约(30%+),CD21(+),Cyclin D1(-),CD10(-),Bcl-2(++),Bcl-6(-),背景细胞CD3(+),CD38(灶+),结合HE切片,本例为B细胞性恶性淋巴瘤,符合CLL/SLL。
颈胸全腹增强CT显示:颈胸腹部多发肿大淋巴结,部分融合,考虑淋巴瘤。脾大。
诊 断
慢性淋巴细胞白血病 Rai Ⅱ期Binet B期,ECOG 1分,CRS 4分。
治疗经过
2014年9月2日-2016年2月26日
由于淋巴细胞倍增时间<6个月、淋巴结进行性增大,PET/CT示大包块,患者于2014年9月2日起六周期FCR化疗,6疗程后2015年2月26日查颈胸全腹增强CT等评估为PR,后续定期复查。
2016年5月
2016年5月,患者自觉乏力,盗汗症状较前加重,体重下降5 kg。遂于2016年5月4日查B超示,颈部、腋窝、腹股沟多处淋巴结较前明显肿大,考虑疾病进展。复查骨髓常规、病理、流示细胞术免疫分型均提示CLL。染色体46, XY, 17p-[7];CLL-FISH示17p-阳性(207/300),其余探针均阴性。分子检测示:SF3B1突变阳性,NOTCH1、MYD88、P53突变均为阴性。复查血常规:白细胞14×109/L,淋巴细胞计数12.25×109/L,血红蛋白136 g/L,血小板99×109/L。患者出现乏力、盗汗症状,需要再次治疗。家属商议后要求暂缓治疗,等待加入BGB-3111-205临床试验。
2017年4月22日
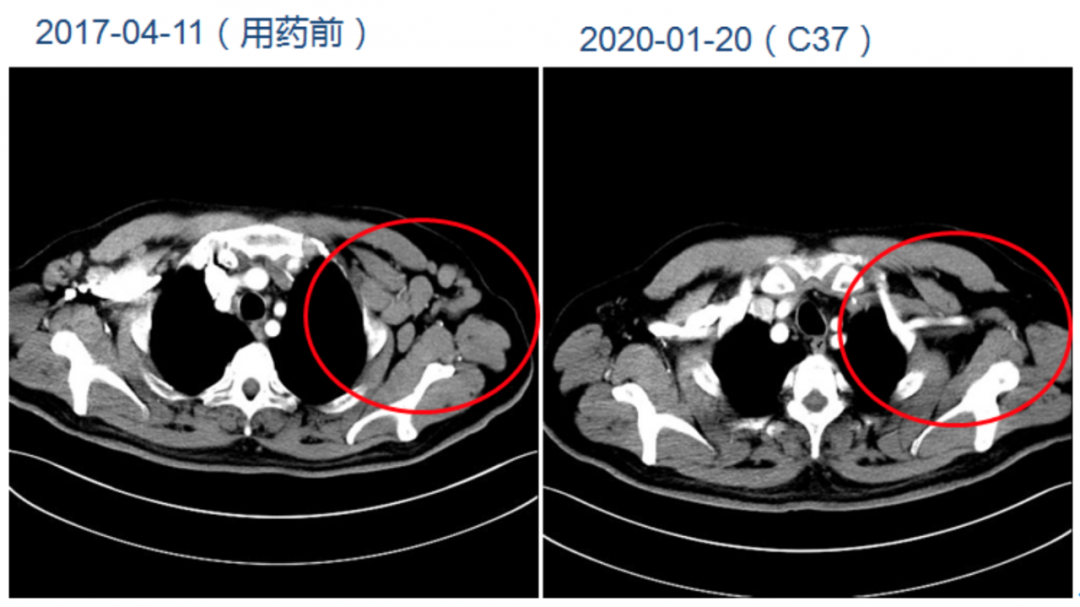
获得知情同意后,患者于2017年4月22日开始(C1D1)口服试验药物泽布替尼(BGB-3111)160 mg bid,定期按方案要求行血常规、尿常规、生化、心电图、颈胸全腹增强CT等检查。患者服药后淋巴结缩小明显,自觉压迫感迅速减轻。
2017年7月-2019年2月
2017年7月13日(C4)复查,影像学评估为部分缓解PR,淋巴细胞计数86.14×109/L,总体评估为PR-L。2018年3月22日(C13)再次复查,影像学评估为PR,淋巴细胞计数3.26×109/L(<4×109/L),总体评估为PR。2019年2月21日(C25)再次复查,评估为CR。
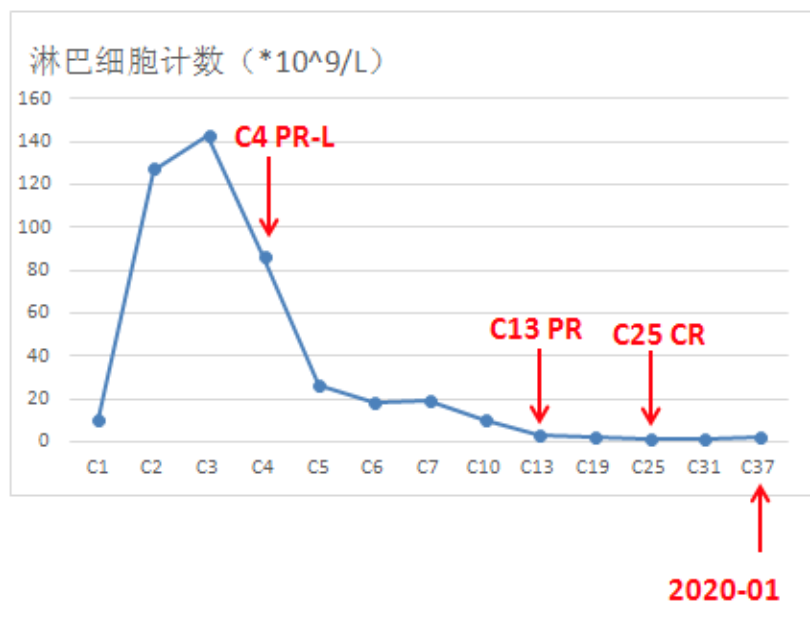
安全性方面,患者服药过程中未出现药物相关3/4级血液学毒性,无特殊不适。
病例小结
该患者为一例61岁男性CLL,患者合并高血压、糖尿病基础疾病。初始经6周期FCR化疗后达到PR,但约15个月后出现疾病进展。进一步检查发现患者17p缺失,属高危人群,经与家属协商,决定入组临床试验。
于2017年4月22日开始应用新型BTK抑制剂——泽布替尼进行治疗,患者病情迅速得到缓解,在C13用药周期评估为PR,C25达到CR。值得一提的是,患者虽合并高血压、糖尿病,但在服药过程中未出现严重药物相关不良反应,安全性较好。
专家点评

徐卫 教授、主任医师
南京医科大学第一附属医院(江苏省人民医院)血液科副主任、博士生导师
• 中国抗癌协会血液肿瘤专业委员会副主委,淋巴瘤学组组长
• 中国老年保健协会淋巴瘤专业委员会副主任委员
• CSCO中国抗淋巴瘤联盟常委
• 中国老年医学学会血液学分会常委
• 中国女医师协会血液专业委员会常委
• 中国老年肿瘤学会淋巴血液肿瘤专业委员会常委
• 中国抗癌协会淋巴瘤专业委员会委员
• 中国病理生理学会实验血液学专业委员会委员
• 中国医师协会整合医学医师分会整合血液病学专业委员会委员兼秘书
• 江苏省医学会血液学会副主任委员
• 江苏省医师协会血液病医师分会副会长
• 江苏省研究型医院协会淋巴瘤专业委员会主任委委员
• 江苏省抗淋巴瘤联盟主任委员
• 江苏省抗癌协会血液肿瘤专业委员会副主任委员
• 江苏省抗癌协会淋巴瘤专业委员会常委
• 南京市血液学会副主任委员
• 《中华血液学杂志》、《中国实验血液学杂志》、《国际输血及血液学杂志》、《白血病∙淋巴瘤》和《BLOOD中文版》等杂志编委
CLL是常见的血液系统恶性肿瘤,患者以中老年男性为主。染色体17p缺失是当前被认可的提示预后最差的生物标志物,且当疾病进展至复发/难治CLL,患者17p缺失的比例明显增加。当前,临床针对R/R CLL患者尚缺乏标准治疗,现有治疗选择有限,尤其是伴17p缺失的R/R CLL患者。
追本溯源,CLL是由成熟的B淋巴细胞单克隆增生所致,这些细胞可接受由组织微环境传递的生长和生存信号,其中BCR信号通路的激活尤为重要。近年来,靶向BCR信号传导通路中关键激酶——Bruton酪氨酸激酶(BTK)的BTK抑制剂成为CLL可选治疗方案之一。
泽布替尼(BGB-3111)是我国百济神州公司自主研发的新一代强效BTK抑制剂,其在多种B淋巴细胞肿瘤的治疗中具有良好的临床活性和耐受性。第61届ASH年会上,泽布替尼治疗R/R或未接受过治疗CLL/SLL患者的全球Ⅰ、Ⅱ期临床试验结果显示,在中位随访25.1个月时,ORR达到97%,其中CR率为14%。1年和2年PFS率分别为97%和89%,仅4例患者因AE停止治疗。
而在该病例中患者在FCR方案治疗失败后,应用泽布替尼单药进行治疗获得较好预后,证实了已有研究报道的结果。该患者合并高血压、糖尿病,在应用泽布替尼过程中未出现严重心血管事件及其他严重不良事件,可见药物安全性良好。
作为首个获得FDA批准的本土创新药物,泽布替尼用数据和效果不断展现着其“best-in-class”的潜质,期待为更多淋巴瘤患者带来生命的曙光!
关于泽布替尼:
泽布替尼是由我国百济神州公司自主研发的新一代强效BTK抑制剂。泽布替尼通过创新、优化的分子结构,对BTK靶点选择性更强且脱靶效应更低,可最大程度提高BTK占有率并最小化脱靶作用,从而特异性地减少治疗过程中不良事件的发生。基础研究表明,使用泽布替尼后在外周血和淋巴结中均可观察到完全持久的BTK占有。
泽布替尼自2012年6月正式立项研发,如今在全球的临床试验中,包括慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(WM)、滤泡性淋巴瘤(FL)等,泽布替尼均表现出更高的有效性和安全性。
2019年11月15日,泽布替尼以“突破性疗法”的身份被美国FDA以快速通道资格审批上市,用于既往至少接受过一种治疗的成年MCL患者,打破了中国抗癌新药“只进不出”的历史。2020年6月3日,泽布替尼(百悦泽®)获中国国家药品监督管理局批准,在中国上市。