MDS治疗新突破!新药加持,口服地西他滨横空出世
胞嘧啶核苷类似物地西他滨和阿扎胞苷是DNA甲基转移酶(DNMT)抑制剂,作用于细胞周期的S期(增殖期),通过抑制DNA甲基化进而修饰表观遗传模式和基因表达发挥作用,用于治疗骨髓增生异常综合征(MDS)、慢性粒单核细胞白血病(CMML)和不适合高强度治疗的急性髓系白血病(AML)。
地西他滨和阿扎胞苷均为静脉给药,每个治疗周期为3-5天,期间需多次给药。如果能口服DNMT抑制剂,则可以减轻患者每月多次静脉输注带来的负担,提高生活质量。
但是由于在胃肠道(GI)和肝脏中被胞苷脱氨酶(CDA)快速灭活,地西他滨和阿扎胞苷的口服生物利用度有限,通过抑制CDA能提高DNMT抑制剂的口服生物利用度。既往研究发现竞争性CDA抑制剂四氢尿苷(THU)可增加地西他滨的口服生物利用度,但THU在酸性环境中不稳定。
作为一种新型CDA抑制剂,cedazuridine能克服THU的不稳定性,在临床前研究中口服给药安全地增加了地西他滨的暴露量。最近公布的一项Ⅱ期研究比较了口服cedazuridine 100 mg+地西他滨35 mg与地西他滨20mg/m2静脉给药的疗效,结果于近日发表在Blood杂志上。

交叉设计,随机入组
符合条件的患者最初按1:1的比例随机分配
A序列的受试者在前2个28日的疗程内先口服cedazuridine/地西他滨,持续5天,随后第2周期静脉使用地西他滨,持续5天,第3疗程开始全部口服给药;
B序列在第1周期静脉给予地西他滨,第2周期口服给药,其余同序列A。
在剂量确认(DC)阶段,患者同时单独接受2种口服药物,以确认合适剂量。初步药动学分析显示口服和静脉地西他滨的暴露量相当后,在固定组合剂量(FDC)阶段使用含有相同剂量的两种药物的复方片剂对队列进行随机分组。
结局指标
研究的主要终点是口服cedazuridine/地西他滨与静注地西他滨2个疗程后的DNA去甲基化程度和总体缓解率。
次要终点包括其他疗效结局(缓解持续时间、发生AML时间和生存期)及口服cedazuridine/地西他滨的安全性。
主要研究结果
共入组86例受试者,52例和34例分别进入DC队列和FDC队列。剂量确认队列和FDC队列分别为2例和4例未接受治疗,从队列中排除。中位随访时间为24.3个月(12.0-29.2),在随访结束时,67例患者已停止治疗,13例患者仍在接受治疗,接受疗程的中位数为7个(1-29)。
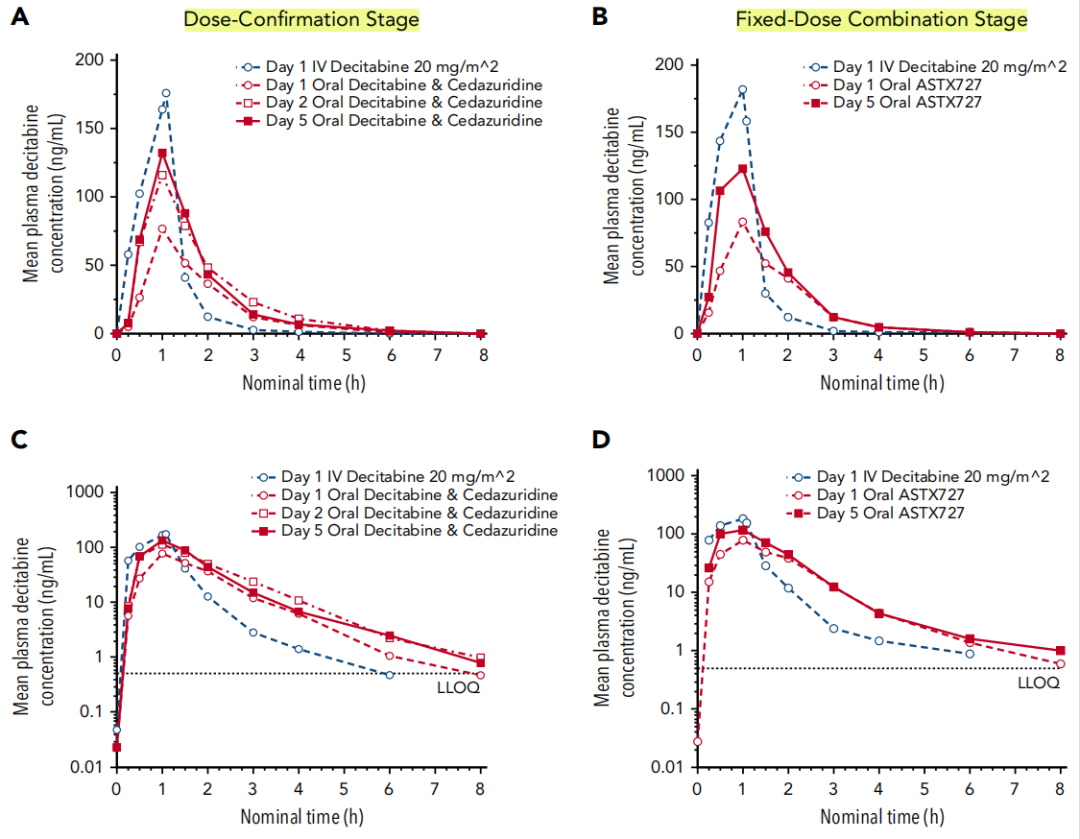
药代动力学
地西他滨的血浆峰浓度在静脉输注开始后1小时达到,与口服cedazuridine/地西他滨的时间十分接近(图1)。
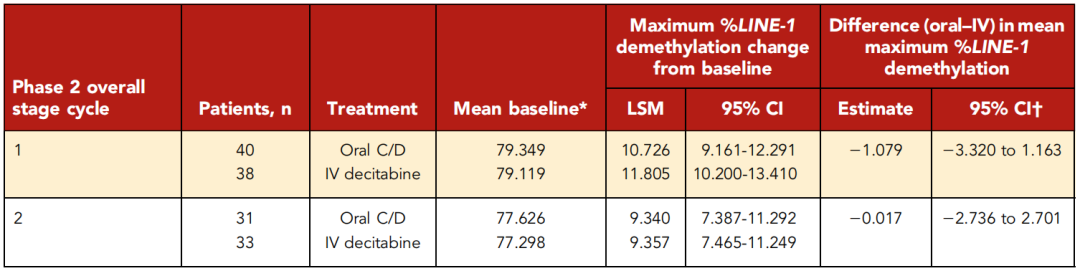
药效学
如果几何最小二乘均值(LSM)及其80% CI的比值完全包含在剂量确认队列和FDC队列中预先规定的区间内(分别为75-133和65-153.9),则表明治疗之间具有等效性。
在78例患者中评价了对基因组中的逆转座子LINE-1去甲基化的治疗效果。在ANOVA模型中,口服和静滴间最大LSM% LINE-1去甲基化的绝对差异≤1%,口服和静脉给药对整体DNA甲基化的影响无临床或统计学差异。
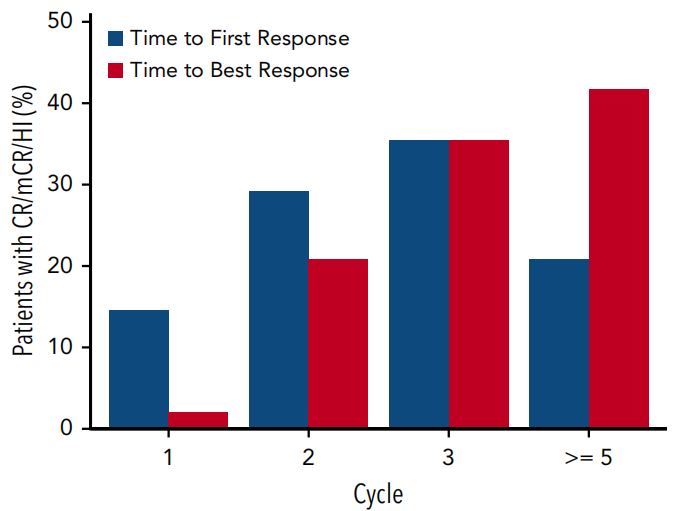
临床缓解
所有接受治疗的患者均被纳入疗效分析。在80例患者中,观察到48例(60%)临床缓解,包括17例(21%)完全缓解,完全的中位缓解持续时间为13.3个月(95%CI:6.5-13.8)。
图2按周期显示至首次缓解时间和至最佳缓解时间。大多数受试者在第三个疗程开始出现缓解,达到最佳缓解需≥5个疗程。
总生存期
总体治疗人群的中位至AML或死亡时间为12.1个月(95%CI:5.9-不可估计)。图3按随机序列和总体人群显示了生存期。所有接受治疗的患者的中位总生存期为18.3个月(95%CI,9.1-无法估计)。

安全性
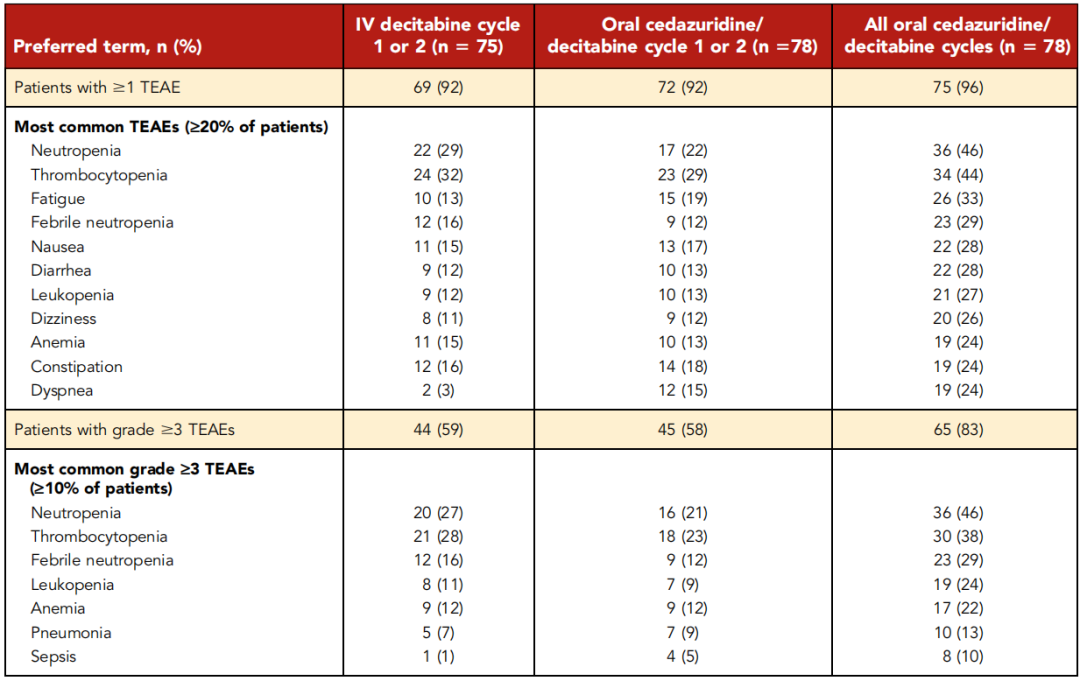
表3总结了治疗人群中最常见的不良事件。口服和静脉给药相比,全部疗程内各种所有级别的不良反应发生率相似,口服地西他滨未明显增加胃肠道反应。
小结
综上所述,这些结果表明,口服100 mg cedazuridine+35 mg地西他滨与静脉给药时的药物暴露量相当,其临床疗效和安全性与标准方案相似。口服地西他滨为治疗骨髓恶性肿瘤带来新的选择,有望进一步改善患者的治疗结局和生活质量。
参考文献
[1] Garcia-Manero G, Griffiths EA, Steensma DP, et al. Oral cedazuridine/decitabine for MDS and CMML: a phase 2 pharmacokinetic/pharmacodynamic randomized crossover study. Blood. 2020;136(6):674-683.