PD-1抗体的疗效
很多病友都想知道:有没有一些指标,可以提前预判PD-1抗体的疗效?毕竟这药需要两三个月才能评估疗效,也不便宜。
随着PD-1药物的普及,相关的研究也越来越多。事实上,存在4大类不同的基因突变,可能与PD-1抗体的疗效相关。今天,咚咚再给大家总结一下。

四类可能影响PD-1疗效的基因
提醒:以下数据均来自已发表的临床杂志,仅作为治疗参考,不构成任何治疗建议。
1 敏感基因:携带这类基因PD-1有神效
目前,已经发现不少基因突变与PD-1抗体的疗效密切相关,包括MSI、POLE、POLD、P53、BRCA、ATM、PRBM1、TERT和NOTCH。其中,MSI、POLE、P53等与DNA损伤修复有关的基因,咚咚已经多次介绍,参考:
什么?有些癌症是可以遗传的!
肿瘤有POLE突变?恭喜你,中大奖了!
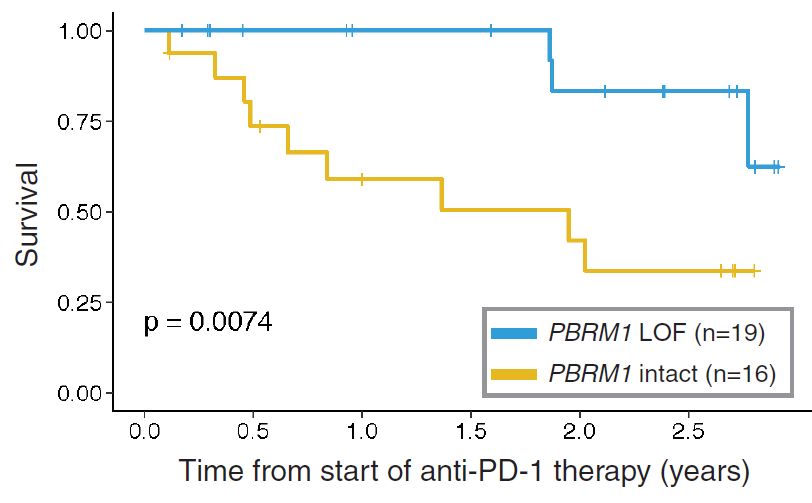
PRBM1。2018年年初,《科学》杂志发表了一篇重要研究论文[1]:发现携带PBRM1失活突变的肾癌患者,PD-1抑制剂治疗有效率为78.8%;而PBRM1基因无突变的患者,PD-1抑制剂的有效率只有18.9%——两者相差4倍多!具体如下:
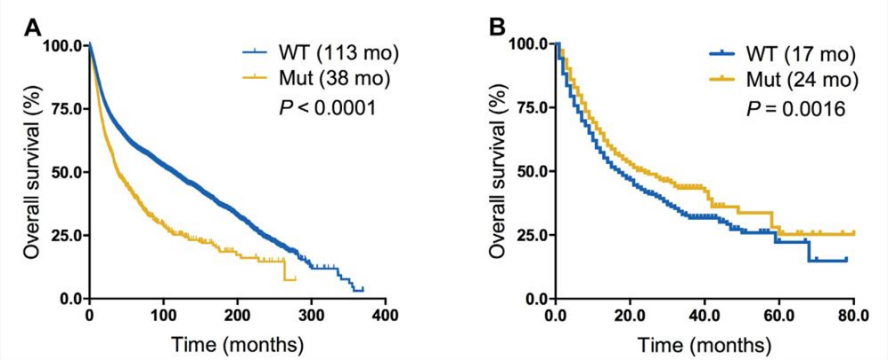
TERT。周彩存和张力教授团队联合发表了一项研究[2],分析了521名接受免疫治疗的患者,其中携带TERT基因突变患者的中位生存期24个月,而无突变患者只有17个月。在非小细胞肺癌患者中,TERT突变的患者有效率更高(35.4%vs 17.4%)、中位无疾病进展生存时间更长(8.8个月vs 3.1个月)。
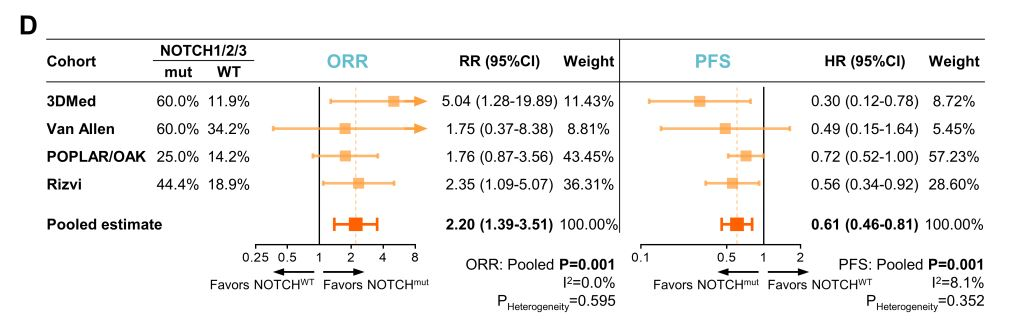
NOTCH。湖北省肿瘤医院、武汉协和医院的教授联合梅奥诊所的华人教授,利用公开数据库及自身临床数据,分析了1557名接受PD-1治疗的晚期非小肺癌患者的资料[3],发现:NOTCH突变可以将PD-1抑制剂的有效率提高2.2倍,疾病进展的风险下降39%,患者死亡的风险降低44%。
2 低效基因:携带这类基因PD-1疗效不佳
正如一个硬币有两面,有敏感基因,也有低效基因。目前,一些研究提示:EGFR突变、ALK突变、MET基因第14号外显子跳跃突变等驱动基因突变以及SKT11功能缺失突变、PTEN基因功能缺失突变等,会导致PD-1抗体疗效大打折扣。
EGFR/ALK等。EGFR、ALK、MET等驱动基因突变,导致患者对靶向药敏感,单独使用PD-1抗体不敏感,这一点咚咚已经反反复复强调,详情参考:权威总结:EGFR耐药后再用PD-1,有效率低,还可能爆发进展。针对靶向药耐药的患者,国内有临床试验正在探索PD-1+化疗的联合治疗方式,已经取得了不错的数据,参考:颠覆认知! EGFR突变患者并非无缘“神药”PD-1, 这些情况仍有奇效。
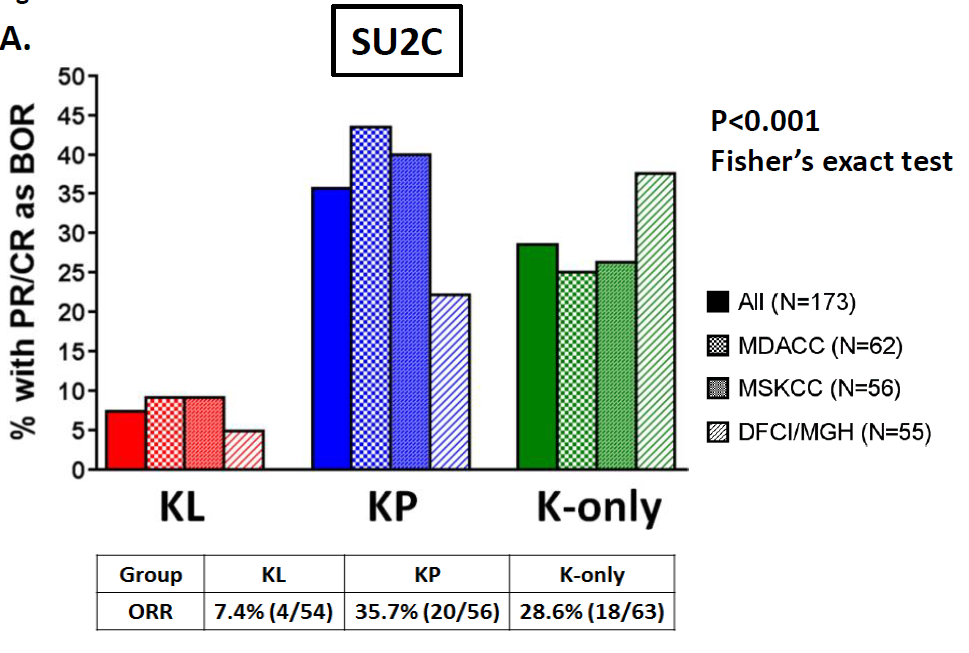
STK11。这是近几年比较火热的一个基因,大家发现STK11和KRAS同时突变的患者,使用PD-1抗体治疗的效果不佳。2018年《Cancer Discovery》发布一份数据[4],173位KRAS突变的肺癌患者使用PD-1抗体治疗:54位同时携带STK11突变,有效率7.4%;56位携带P53突变,有效率35.7%;63位不携带STK11或P53,有效率28.6%。
PTEN。基因缺失和突变,结果可能完全不一样。2016年一项针对恶黑患者使用PD-1的数据表明:PTEN基因缺失的患者,使用PD-1有效率比较低[5]。我们还报道过一位平滑肌肉瘤的患者[6],用了PD-1抗体之后,全身的肿瘤都基本消失了,只有一处转移瘤一直在长大,通过基因测序发现:这个转移瘤的PTEN基因是缺失的(PD-1抗体+局部处理=肿瘤完全消失!)。
3 耐药基因:携带这类基因PD-1天然耐药
除了PD-1敏感和低效基因,还有一类基因突变,更狠毒,意味着对PD-1类药物基本是无效的,属于耐药基因。主要包括:JAK、B2M。
JAK蛋白和B2M蛋白分别参与了T细胞抗癌的战斗过程、T细胞识别癌细胞的情报工作,因此这两个基因要是缺失突变,很可能会导致患者对PD-1抑制剂耐药。
《Cancer Discovery》上的案例[7]:23例黑色素瘤患者中1例具有JAK1/2失活突变;16例错配修复缺陷的直肠癌患者中,1例有JAK1/2失活突变;两者虽然都有较高的突变负荷,但PD-1抗体治疗均无效。
《新英格兰医学杂志》的案例[8]:深入研究了4名对PD-1抗体耐药的患者,发现其中最主要的原因就是JAK和B2M基因失活突变。
4 爆发进展:携带这类基因使用PD-1抗体可能疾病大爆发
使用PD-1抗体后,不仅无效,反而帮了倒忙,导致疾病爆发进展。
美国的A.K. Singavi教授在这方面进行了深入的研究[9],他对爆发进展的定义是:
接受PD-1抗体治疗后第一次复查CT,就出现了疾病进展;
肿瘤大小增大了50%;
肿瘤生长速度增快了2倍以上。
他一共找到了5位符合上述条件的爆发进展的患者,其中4位有足够的组织标本进行基因分析,发现:MDM2/MDM4基因扩增、EGFR基因扩增、以及11号染色体13区带相关基因(CCND1, FGF3, FGF4, FGF19)扩增,是最常见的基因变异。
随后,A.K. Singavi教授又找到了10位符合以上基因改变的癌症患者,发现:
3名MDM2/MDM4扩增的患者,接受了PD-1抗体治疗,2名出现了疾病爆发进展。
2名EGFR扩增的患者,接受了PD-1抗体治疗,1名出现了疾病爆发进展。
7名11号染色体13区扩增的患者,接受了PD-1抗体治疗,3名出现了疾病爆发进展。
后面研究揭示,MDM2高倍扩增(大于7倍)才有快速进展风险。而且,这类患者使用联合方案,如化疗联合PD-1抗体,靶向药物联合PD-1抗体,可能会抑制肿瘤爆发进展。
当然,目前爆发进展的具体机理我们还不清楚,而且对爆发进展的定义和真伪也存在争议,但是为了自己的安全,如果恰好携带这些突变的患者,使用PD-1抗体,还是要格外小心。
参考文献:
[1]. Miao, D. et al. Genomic correlates of response to immune checkpoint therapiesin clear cell renal cell carcinoma. Science359, 801-806,doi:10.1126/science.aan5951(2018).
[2]. Zhang, K. et al. Identification of DeleteriousNOTCH Mutation as Novel Predictor to Efficacious Immunotherapy in NSCLC. Clin Cancer Res 26, 3649-3661, doi:10.1158/1078-0432.CCR-19-3976(2020).
[3]. Jiang, T. et al. Pan-cancer analysis identifiesTERT alterations as predictive biomarkers for immune checkpoint inhibitorstreatment. Clin Transl Med,doi:10.1002/ctm2.109(2020).
[4]. Skoulidis, F. et al. STK11/LKB1 Mutations and PD-1Inhibitor Resistance in KRAS-Mutant Lung Adenocarcinoma. Cancer Discov 8,822-835, doi:10.1158/2159-8290.CD-18-0099(2018).
[5]. Peng, W. et al. Loss of PTEN Promotes Resistanceto T Cell-Mediated Immunotherapy. CancerDiscov 6, 202-216, doi:10.1158/2159-8290.CD-15-0283(2016).
[6]. George, S. et al. Loss of PTEN Is Associated withResistance to Anti-PD-1 Checkpoint Blockade Therapy in Metastatic UterineLeiomyosarcoma. Immunity 46, 197-204,doi:10.1016/j.immuni.2017.02.001(2017).
[7]. Shin, D. S. et al. Primary Resistance to PD-1Blockade Mediated by JAK1/2 Mutations. CancerDiscov 7, 188-201,doi:10.1158/2159-8290.CD-16-1223(2017).
[8]. Zaretsky, J. M. et al. Mutations Associated withAcquired Resistance to PD-1 Blockade in Melanoma. N Engl J Med 375,819-829, doi:10.1056/NEJMoa1604958(2016).
[9]. Kato, S. et al. Hyper-progressors afterImmunotherapy: Analysis of Genomic Alterations Associated with AcceleratedGrowth Rate. Clin Cancer Res,doi:10.1158/1078-0432.CCR-16-3133(2017).