遗传性妇科肿瘤高风险人群管理专家共识
作者:中国抗癌协会肿瘤内分泌专业委员会,中国优生科学协会女性生殖道疾病诊治分会,中国优生科学协会肿瘤生殖学分会
通讯作者(按姓氏笔画排序):王玉东(上海交通大学医学院附属国际和平妇幼保健院,上海 200233,电子信箱:[email protected]);张师前(山东大学齐鲁医院,山东 济南 250012,电子信箱:[email protected]);周琦(重庆大学附属肿瘤医院,重庆 400030,电子信箱:[email protected]);薛凤霞(天津医科大学总医院,天津 300052,电子信箱:[email protected])
执笔者(按姓氏笔画排序):王玉东(上海交通大学医学院附属国际和平妇幼保健院);王颖梅(天津医科大学总医院);王建东(首都医科大学附属北京妇产医院);王丹波(辽宁省肿瘤医院);向阳(北京协和医院);张师前(山东大学齐鲁医院);张玉敏(山东大学齐鲁医院);邹冬玲(重庆市肿瘤医院);周琦(重庆大学附属肿瘤医院);薛凤霞(天津医科大学总医院)
参与讨论专家(按姓氏笔画排序):王永军(北京大学国际医院);王静(湖北省肿瘤医院);王树森(中山大学附属肿瘤医院);王莉(河南省肿瘤医院);孙蓬明(福建医科大学妇幼保健院);田小飞(陕西省肿瘤医院);阳志军(广西医科大学附属肿瘤医院);李庆水(山东省肿瘤医院);李长忠(山东省立医院);张树泉(山东大学齐鲁医院);张友忠(山东大学齐鲁医院);吴绪峰(湖北省妇幼保健院);吴绮楠(重庆大学附属肿瘤医院);陈兵(陆军军医大学第一附属医院);陈洁(中山医科大学第一附属医院);杨英捷(贵州省肿瘤医院);范江涛(广西医科大学第一附属医院);周坚红(浙江大学医学院附属妇产科医院);娄阁(哈尔滨医科大学肿瘤医院);高春英(吉林省肿瘤医院);黄奕(湖北省肿瘤医院);谢榕(福建省肿瘤医院);程晓东(浙江大学医学院附属妇产科医院);蔡建良(首都医科大学北京世纪坛医院);蔡红兵(武汉大学中南医院);魏代敏(山东大学附属生殖医院)
< h3>1 共识制定背景
遗传性肿瘤综合征系一个或多个基因致病性突变使个体某一器官或多个器官发生肿瘤,且突变基因可在家系中世代遗传,多为常染色体显性遗传,约占全部肿瘤的5%~10%。遗传性肿瘤与癌变通路上癌基因或抑癌基因等的胚系突变相关,根据胚系突变外显情况,可分为完全和不完全外显突变。妇科肿瘤多为不完全外显突变,根据外显率高低可进一步分为高外显率突变、适度外显率突变和低外显率突变。遗传性肿瘤在人群中所占比例不大,但家族肿瘤遗传的易患性对其家庭成员的影响大。遗传性肿瘤的规范咨询有助于筛查和识别高危个体,依据遗传学原则指导干预措施,不仅有利于肿瘤的预防和早期发现,还可参与患者生育决策的选择和后续内分泌治疗。
遗传性致病基因突变相关的妇科肿瘤除有利于选择遗传相关肿瘤的治疗外,特殊之处还在于采取有效干预措施。某些致病性基因突变与妇科肿瘤有关,同时增加包括前列腺癌、胰腺癌、结直肠癌等肿瘤的发病风险。可通过遗传咨询,充分告知妇科肿瘤遗传性致病性突变基因携带者,包括预防性干预、干预措施对年轻女性未来的生育功能影响、致病性基因遗传给后代的风险、预防性输卵管/卵巢切除术后激素补充治疗(HT)等。妇科肿瘤医生、妇产科医生应掌握遗传性妇科肿瘤风险知识,了解降低肿瘤风险的预防策略,联合生殖医学医生,为妇科肿瘤高危患者提供包括生育力保存和植入前遗传学检测等相关咨询,制定诊疗计划。
为了进一步推进遗传性妇科肿瘤高风险患者的筛查、预防与治疗,指导高风险患者制定生殖计划和降风险手术后的内分泌规范化诊治,中国抗癌协会肿瘤内分泌专业委员会联合中国优生科学协会女性生殖道疾病诊治分会、中国优生科学协会肿瘤生殖学分会,组织本领域专家对国内外遗传性妇科肿瘤诊疗指南和相关研究数据进行综合分析、讨论和总结,依据我国国情,特制定本专家共识,以期为遗传性妇科肿瘤提供优化的处理原则。
< h3>2 遗传性妇科肿瘤
卵巢癌、子宫内膜癌、子宫颈癌是最常见的女性三大恶性肿瘤。遗传性乳腺癌-卵巢癌综合征(hereditary breast and ovarian cancer,HBOC)、林奇综合征(Lynch syndromes,LS)和Peutz-Jeghers综合征(Peutz-Jeghers syndromes,PJS)与遗传性卵巢癌、子宫内膜癌、子宫颈癌相关,三者均为常染色体显性遗传,HBOC和LS是临床最多见的遗传性妇科肿瘤,PJS人群发生子宫颈微偏腺癌(minimal deviation adenocarcinoma,MDA)风险增加,但在临床中罕见。
HBOC与抑癌基因致病性突变有关,大多数HBOC为BRCA1和BRCA2基因的胚系突变,约5%乳腺癌和10%~25%卵巢癌由HBOC所致,该综合征患者同时具有较高的胰腺癌和前列腺癌发病风险。BRCA1和BRCA2致病性突变携带者,40岁后卵巢癌患病风险逐渐增加,50岁时卵巢癌发病风险达到20%和3%。70岁以下的BRCA1、BRCA2突变携带者,卵巢癌患病风险分别为39%~46%和10%~27%。除外BRCA1和BRCA2致病性突变与HBOC有关外,BRIP1致病性胚系突变携带者卵巢癌的相对风险(RR)增加8~11倍,RAD51C和RAD51D致病性突变也与卵巢癌患病风险相关,而上述卵巢癌相关突变基因BRIP1、RAD51C和RAD51D则与乳腺癌的发病无明显相关性。TP53、CDH1、CHEK2和ATM突变与乳腺癌风险增加相关而与卵巢癌风险无关。STK11突变与卵巢性索间质细胞肿瘤的发生有关,PTEN突变与乳腺癌和子宫内膜癌风险增加相关,而STK11和PTEN这两种基因突变与卵巢上皮性癌发病风险则无明显相关性。
LS又名遗传性非息肉性病结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC),与结直肠癌、子宫内膜癌、胃癌、乳腺癌、卵巢癌、小肠癌、胰腺癌、前列腺癌、泌尿道癌、肝癌、肾癌和胆管癌等多种肿瘤风险有关。LS主要是由DNA错配修复基因(MLH1、MSH2、PMS2或MSH6)引起的。HNPCC患者在70岁前罹患子宫内膜癌和卵巢癌的风险分别为42%~60%和9%~12%。HNPCC女性患者一生中大约有40%~60%的结直肠癌患病风险,该综合征还与错配修饰基因EpCAM突变有关。携带的致病性突变基因不同,罹患肿瘤的器官、部位、类型和终生累积发病率也有差异。3%~5%的结直肠癌、2%~3%的子宫内膜癌与LS相关。LS突变基因的外显率因人而异,不同肿瘤的发生风险各有差异,LS相关子宫内膜癌终生患病风险高达60%,卵巢癌终生风险为24%。
PJS又名黑斑息肉综合征,与乳腺癌、结直肠癌、胃癌、小肠癌、胰腺癌、卵巢肿瘤、宫颈MDA、子宫内膜癌和肺癌等多种肿瘤风险相关。大多数PJS病例发病是由于STK11基因致病性突变引起。据统计,PJS人群中96种癌症发生风险增加,在20、30、40、50、60、70岁发生癌症的风险分别为2%、5%、17%、31%、60%、85%;其中胃肠来源的癌症最常见。乳腺癌风险为32%~54%,平均发病年龄37~59岁;宫颈MDA发病风险为10%,平均发病年龄34~40岁;子宫内膜癌发病风险为9%,平均发病年龄43岁。
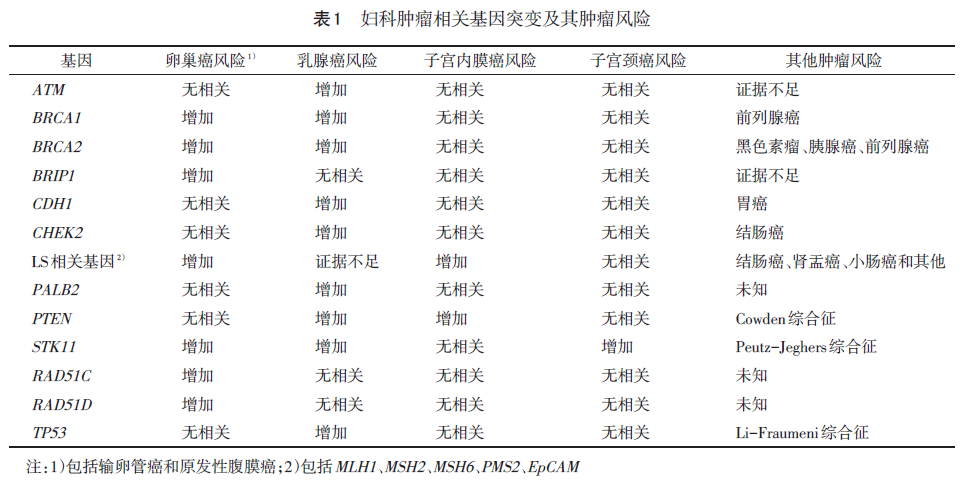
妇科肿瘤密切相关的主要基因表达与肿瘤相关性见表1。证据推荐等级分级采用GRADE证据质量分级标准,见表2。

< h3>3 遗传性妇科肿瘤风险评估
遗传性肿瘤风险评估可有效识别罹患某种肿瘤的高危人群或家族,评估内容包括个人史和家族史,评估病理报告、影像学资料及其他肿瘤高危因素亦涵盖在内。遗传性妇科肿瘤风险评估工作应由妇产科医师或其他妇产科医务人员进行。评估结果如提示遗传性肿瘤风险高,推荐转介给肿瘤遗传学专家或遗传学专家进行更深层次的家族史采集、风险评估、教育和咨询,甚至需进行基因检测和适宜的肿瘤筛查或采取降风险措施干预。
遗传性肿瘤风险评估的初步工作即收集完整的家族史,患者初次就诊即应采集肿瘤家族史信息,并定期更新。再次进行肿瘤风险评估的时机宜定于医生与患者进行医疗决策或计划制定时。采集要点如下:(1)一级亲属有无肿瘤史,包括兄弟姐妹、父母、子女(2)二级亲属有无肿瘤史,包括(外)祖父母、姑姑(姨母)、叔叔(舅舅)、侄子(外甥)、侄女(外甥女)及同母异父或同父异母的兄弟姐妹(3)对于每一位罹患肿瘤的亲属,均应记录以下要点:①原发性肿瘤类型;②原发性肿瘤发病年龄;③母系或父系家族史。推荐家族史采集至少应延伸至三级亲属(推荐等级:B)。一些个人史或家族史特征与遗传性肿瘤相关:(1)诊断为乳腺癌、卵巢癌或直肠癌的年龄较小或<50岁(2)同一家庭成员罹患多类型肿瘤(3)同一家庭成员,尤其是同一器官(如乳腺或结肠)多个原发肿瘤病灶(4)多个近亲家属(如母亲、女儿或姐妹患乳腺癌),尤其是同为父系或同为母系家属,罹患同类型肿瘤(5)某一特定肿瘤出现异常表现(如男性成员患乳腺癌)(6)某些特定的良性疾病如皮肤疾病和骨骼系统发育异常等(7)特定类型的肿瘤,如三阴性乳腺癌(雌激素、孕激素受体阴性及HER2表达缺失)及浆液性卵巢上皮性癌、输卵管癌和腹膜癌提示HBOC,直肠癌伴DNA错配修复缺陷和子宫内膜癌伴DNA错配修复缺陷提示LS。
随着遗传学技术发展,可单基因检测,亦可多个基因或多个成组基因进行检测。对于遗传性肿瘤可疑患者,究竟如何选择基因检测项目,关键在于充分的家族史和个人史评估。本共识建议多基因检测,可同时检测与家族中某一肿瘤或多个肿瘤表型相关的基因(推荐等级:B)。此外,个人史或家族史可能涉及多个基因变异,多基因检测可提高致病性基因突变的检出率。在基因检测前应注意,接受同种异体骨髓移植者和近期或活动性血液恶性疾病者不推荐通过血液或唾液样本进行基因检测,推荐获取个体成纤维细胞培养后进行基因检测(推荐等级:B);如无法获取此类细胞,使用唾液样本有被供体DNA污染的可能。患者年龄<18岁时,不推荐常规进行基因检测,因为此时所获得的检测结果不影响临床管理策略(推荐等级:B)。
< h3>4 遗传性妇科肿瘤的遗传咨询
4.1 遗传性卵巢癌 对于所有罹患卵巢上皮性癌(包括输卵管癌或原发性腹膜癌)的患者以及有卵巢癌个人史或家族史的妇女,建议进行遗传咨询(推荐等级:B)。初步风险评估应包括个人癌症史和家族癌症史及患者的种族背景(推荐等级:C)。具有下列1种或多种情形的妇女患有遗传性卵巢癌、输卵管癌或腹膜癌的可能性增加,应接受遗传咨询并进行基因检测(推荐等级:C):(1)卵巢上皮性癌、输卵管癌或腹膜癌(2)年龄≤50,患有乳腺癌,并有卵巢癌家族史;有卵巢上皮性癌、输卵管癌或腹膜癌家族史(3)患有胰腺癌并有2个或更多的近亲患有乳腺癌,卵巢癌、输卵管癌或腹膜癌,胰腺癌或浸润性前列腺癌(Gleason评分≥7)。未患癌症的妇女,但具有下列1种或多种情形时,患遗传性乳腺癌、卵巢癌、输卵管癌或腹膜癌的可能性会增加,应接受遗传咨询并进行基因检测(推荐等级:C):(1)符合上述1个或多个标准的一级或多级近亲(2)1名近亲携带已知突变的BRCA1或BRCA2(3)1名近亲患有男性乳腺癌。
遗传性卵巢癌遗传咨询包括以下内容:详细族谱,评估风险,知情同意程序(包括就遗传检测的利弊、局限性、可能的结果以及与测试结果有关的实际问题和伦理问题),对患者和家属进行宣教。基因检测的所有可能结果:(1)BRCA突变真阳性:个体存有致病性BRCA突变(2)BRCA突变真阴性:个体不存在致病性基因突变(3)BRCA突变无意义阴性:个体中不存在致病性突变,不过,该阴性结果具有不确定性,可能的原因如下:①其他家庭成员尚未测试;②家族携带致病性BRCA变体,但由于测试的限制未检测到;③家族携带另一种高风险突变的基因;④家族中不存在高风险突变(4)不确定临床意义的变异:存在BRCA基因的异常,但未明确该突变是否与癌症风险相关。
4.2 遗传性子宫内膜癌 大部分子宫内膜癌为散发病例,但约5%的患者是遗传性子宫内膜癌,其特点是发病年龄比散发性子宫内膜癌患者平均年龄小10~20岁。对于遗传性子宫内膜癌的筛查[如患有林奇综合征、遗传性非息肉性结肠癌(HNPCC)者]应在50岁以前进行。小于50岁患者或有家族史的子宫内膜癌或结肠癌患者建议进行基因检测和遗传咨询(推荐等级:B)。林奇综合征患2种恶性肿瘤如结肠癌或者卵巢癌的可能性增加,这些患者的亲属也是林奇综合征的易感人群,因此建议根据子宫内膜癌患病年龄和家族患癌情况进行遗传咨询。
广义的DNA错配修复缺陷筛查基因包括MLH1、MSH2、MSH6、MLH1、PMS2缺失,需要进一步评估甲基化启动子以判断是体系突变抑或胚系突变。所有患者如果有其他DNA错配异常或者其本人无基因改变,亲属有子宫内膜癌病史和(或)结直肠癌者,建议进行DNA错配基因检测和遗传咨询(推荐等级:B)。
有错配修复(MMR)异常的患者均需要进行遗传性肿瘤相关的基因检测,并做遗传咨询。没有MMR异常的患者,有显著的家族性子宫内膜癌和(或)结肠癌的患者,也需要进行遗传咨询和检测(推荐等级:B)。
4.3 遗传性子宫颈癌 子宫颈癌的关键致癌因素是持续性高危型人乳头瘤病毒感染,这是不争的事实。但有极少部分子宫颈癌与致病性基因突变相关,即子宫颈微偏腺癌,主要是由STK11胚系突变所致。PJS临床诊断需包括以下条件任意2项及2项以上:(1)2个及2个以上组织学证实为PJS型错构瘤型息肉(2)口腔、嘴唇、鼻子、眼睛或手指等皮肤黏膜部位出现色素沉着(3)PJS家族史。具备上述任一条件的个体均推荐基因检测和遗传咨询(推荐等级:B)。
< h3>5 遗传性妇科肿瘤致病基因携带者的临床管理
遗传性妇科肿瘤致病基因携带者适时进行肿瘤筛查,能在可治愈阶段发现病变,可降低患者死亡率。筛查方法因遗传性肿瘤类型而异,尽管如此,筛查手段多是临床常用方法,如妇科超声、CA125检测、子宫内膜活检、宫颈细胞涂片等。此外,医源性干预可有效降低遗传性妇科肿瘤风险,包括药物预防、降风险手术。预防性药物多为性激素类药物,主要是口服避孕药。预防性双侧输卵管-卵巢切除术、双侧输卵管切除术和子宫切除术可降低遗传性妇科肿瘤突变基因携带者的肿瘤发病风险,故称之为降风险手术。遗传性肿瘤患者发病时相对年轻,推荐高危患者在35~45岁或完成生育后实施降风险手术(推荐等级:B),降风险手术所致医源性绝经、不孕、低雌激素综合征的干预措施,见本共识第5、6部分。
5.1 筛查
5.1.1 遗传性卵巢癌 目前尚无有效的筛查手段可早期识别卵巢癌,即使在BRCA1和BRCA2突变人群中也无万全之策。经遗传咨询所筛选出的高危人群,基于生理和内分泌的考量,部分人群可能暂不接受或延期接受预防性双侧输卵管-卵巢切除术。对于此类患者,推荐从30~35岁开始,联合血清CA125检测与经阴道超声检查定期筛查(推荐等级:B)。上述手段可做到早发现、早治疗,尽管这种监测与筛查不能明显提高总生存率,从卫生经济学角度而言,可降低卫生经济负担。
5.1.2 遗传性子宫内膜癌 子宫内膜癌筛查手段包括单纯经阴道超声检查或子宫内膜活检,联合筛查包括经阴道超声检查联合子宫内膜活检、宫腔镜检查联合子宫内膜活检、内镜检查和宫腔灌洗液细胞学检查等。LS相关子宫内膜癌的筛查策略,建议从30~35岁开始,每1~2年进行1次子宫内膜活检(推荐等级:B)。
5.1.3 遗传性子宫颈癌(MDA) 子宫颈癌筛查手段包括人乳头瘤病毒检测和宫颈细胞学涂片。推荐有性生活的PJS人群,从18~20岁开始每年进行1次妇科检查和宫颈细胞学涂片筛查(推荐等级:B)。
5.2 药物预防
5.2.1 遗传性卵巢癌 基线研究提示,多种药物如口服避孕药(OCPs)、非甾体类抗炎药、维生素A、抗血管生成药物、多聚ADP核糖聚合酶(PARP)抑制剂和酪氨酸激酶抑制剂可以部分性预防卵巢癌的发生,其中以OCPs最为肯定。OCPs不仅能够降低普通人群50%的卵巢癌患病风险,对BRCA1和BRCA2突变人群还具有良好的保护作用[总的相对风险(SRR)0.50;95%CI 0.33~0.75]。OCPs预防卵巢癌的保护效用随着用药时间的延长而增加,至于OCPs是否会增加BRCA突变人群乳腺癌的风险尚有争议,研究表明OCPs会小幅增加普通人群乳腺癌的发病率,但在BRCA1和BRCA2突变人群的病例对照研究中并未得到验证;荟萃分析表明,OCPs增加BRCA1(ES=1.59;95%CI 1.32~1.92)和BRCA2(ES=1.85;95%CI 1.30~2.64)突变人群乳腺癌的风险。基于上述2项互相矛盾的研究结果,慎重起见,对于无乳腺癌病史的BRCA1和BRCA2突变人群,可推荐应用OCPs以降低患卵巢癌风险(推荐等级:B),但应做到充分的知情同意。
5.2.2 遗传性子宫内膜癌 一般人群应用OCPs可以降低50%的子宫内膜癌患病风险。LS患者应用甲羟孕酮或OCPs 3个月后,子宫内膜即可由增殖期转化为分泌期,提示甲羟孕酮和OCPs或可用作子宫内膜癌的预防手段。左炔诺孕酮宫内缓释系统治疗子宫内膜癌前病变,能够降低一般人群中子宫内膜癌的发生风险,但对LS相关子宫内膜癌预防证据尚不充分。一项回顾性研究显示,应用OCPs时间1年以上的LS人群,较应用不足1年者的子宫内膜癌风险显著降低(HR=0.39[95%CI 0.23~0.64];P<0.001)。推荐孕激素为基础的OCPs用于预防LS女性相关子宫内膜癌(推荐等级:C)。
5.2.3 遗传性子宫颈癌 目前,尚无在PJS人群或动物模型中开展药物预防的报道。
5.3 降风险手术
5.3.1 遗传性卵巢癌
5.3.1.1 降风险的输卵管-卵巢切除术(risk-reducing Salpingo-oophorectomy,RRSO) RRSO是目前降低卵巢癌风险最有效的方法,实施RRSO可降低卵巢癌发病率70%~85%。RRSO除了能够降低高危人群卵巢癌死亡率,还能同时降低该人群乳腺癌的肿瘤死亡率和全因死亡率;推荐高危女性在完成生育计划后实施RRSO(推荐等级:A)。RRSO的时机选择依据患者年龄和基因突变而定,BRCA1突变携带者行RRSO的年龄为35~40岁、BRCA2突变携带者为40~45岁(推荐等级:B)。非突变人群不能受益于RRSO,保留卵巢者的全因死亡率反而显著降低,不推荐普通人群实施RRSO(推荐等级:A)。
RRSO所取标本需要仔细的病理学检查,大约10%的RRSO标本中发现存在上皮内瘤变或癌变,但凡RRSO标本,推荐分段式全输卵管尤其是伞端剖切检查(sectioning and extensively examining the fimbriated end,SEE-FIM),以2mm的间隔进行连续切片,以发现或排外隐匿性癌(推荐等级:B)。
实施RRSO前,应告知患者医源性绝经的常见后遗症,包括血管舒缩症状、骨质疏松症、性欲下降、阴道萎缩干涩症状和心血管疾病等,同时也要告知相应的补救措施的利益与风险。
5.3.1.2 降风险的输卵管切除术 大部分年轻BRCA1和BRCA2突变携带者,尤其具有生育要求以及顾虑于医源性绝经患者,往往一时难以接受RRSO。证据表明,高级别浆液性乳头状癌大多起源于输卵管,完整切除输卵管及伞端能够降低卵巢癌发病风险。2010年加拿大不列颠哥比亚卵巢癌研究组首次提出将预防性输卵管切除术作为卵巢癌的一级预防策略,2018年加拿大妇产科医师协会(SOGC)再次推荐预防性输卵管切除术作为降风险手术。韩国妇产科学会(KSOG)和美国妇产科医师学会(ACOG)亦相继发布相关指南,认为子宫切除的同时进行机会性输卵管切除术能够预防卵巢上皮性癌,并且安全可行。实施降风险的输卵管切除术前,告知患者RRSO是降低卵巢癌风险的标准手段;高危且暂不接受RRSO者,方可推荐双侧输卵管切除术(推荐等级:B),同时应重点告知患者,双侧输卵管切除术不等同于RRSO,该预防性措施不能够降低乳腺癌的发病风险,也不能降低卵巢生殖细胞肿瘤和性索间质肿瘤的发生,鼓励这部分患者随着时间的推移,尽量最终接受双侧卵巢切除术。
5.3.1.3 双侧输卵管切除术及延迟性卵巢切除术(BS/DO) 目前,BS/DO预防高危女性罹患卵巢癌有效性的数据有限。一项前瞻性、非随机、对照研究纳入43例BRCA1/2突变携带者,44%女性选择BS/DO,各有28%女性选择RRSO或定期筛查;BS/DO组未发生术中并发症,且无隐匿性肿瘤,RRSO组仅1例发现输卵管浆液性上皮内癌(STIC)。BS/DO的手术时机与RRSO年龄范围相同,术后随访发现RRSO和BS/DO组患者总体上满意自己的选择,且显著降低了对癌症风险的担忧和焦虑;但BS/DO组提早进行BS是否获益更多,还需长期随访。荷兰筹划的一项前瞻性、非随机、多中心研究,将BS/DO手术时机推迟到指南推荐RRSO年龄5年之后,目前尚无研究结果发表。BS/DO有效性和安全性证据有限,期待有更完善的前瞻性研究提供BS/DO有效性和安全性证据(推荐等级:B)。
5.3.1.4 附加性同步子宫切除术 在RRSO的同时,预防性子宫切除术是否能兼顾降低BRCA突变人群子宫内膜肿瘤风险尚有争议。小规模研究,对20例子宫内膜浆液性乳头状癌(UPSC)患者基因检测,发现4例携带BRCA1突变。具备RRSO指征而未切除子宫者,虽然子宫内膜癌总体发病风险未见升高,但BRCA1突变者的UPSC风险较Ⅰ型中高分化子宫内膜样癌高(证据等级:B)。因此,对于高危人群,RRSO同时是否附加性行子宫切除术应遵循个体化原则,单纯RRSO即可显著降低输卵管-卵巢-腹膜癌风险,具有手术风险低、术后恢复快等优点。附加性子宫切除术的最大优势在于,不存在子宫内膜癌的后顾之忧,术后HT方案可直接过渡为单一雌激素治疗,用药简便。RRSO是否附加子宫切除术,需将子宫切除术的风险和收益充分告知患者,在考虑指征的同时还应综合患者个人意愿。RRSO同时行预防性子宫切除术的指征为:伴有子宫或宫颈病变具有明确的子宫切除手术指征,长期服用他莫昔芬者也可通过附加性子宫切除术获益(证据等级:C)。
5.3.2 遗传性子宫内膜癌 降低LS人群子宫内膜癌和卵巢癌的措施是全子宫和双侧输卵管-卵巢切除术(total hysterectomy and bilateral salpingo-oophorectomy,THBSO),预防性THBSO应基于以下因素并结合个体化原则:绝经期状态、有无合并症和明确的基因突变等,手术时机选择在完成生育计划后,尤其是年龄>40岁者(证据等级:B),THBSO前应当常规进行子宫内膜活检,排除隐匿性子宫内膜癌(证据等级:C)。
5.3.3 遗传性子宫颈癌 尽管已有证据证实预防性手术可降低HBOC和LS人群肿瘤风险,但目前尚无临床研究探索预防性手术在PJS人群中降低遗传性子宫颈肿瘤(MDA)风险的有效性。
< h3>6 遗传性妇科肿瘤的生育力保护
6.1 保留生育功能 遗传性妇科肿瘤人群肿瘤预防与生育力保留二者的理想平衡策略是完成生育后进行降风险手术,实施RRSO的最佳年龄段是35~45岁;若直系亲属发病年龄较早,推荐手术时机适当提前。妇科肿瘤高危女性的“育龄期”时间窗相对更短,如尚未完成生育而不得不考虑接受RRSO降风险手术时,建议借助冻卵或冻胚辅助生殖技术(ART)完成生育(推荐等级:B)。BRCA1和BRCA2突变携带者确诊为妇科肿瘤,生育力保存(fertility preservation,FP)还需兼顾化疗相关的不孕、早发性卵巢功能不全(premature ovarian insufficiency,POI)或医源性绝经等诸多因素。
妇科肿瘤医师要有肿瘤生殖学(oncofertility)的意识和理念,指导BRCA1和BRCA2突变携带者就诊于生殖内分泌科,以便有相对富裕的时间评估基础卵巢储备,指导和实施生育力保存计划,患者也能够在沟通中充分知晓保留生育功能的时机以及植入前遗传学检测的利弊。卵巢储备功能的评估方法有经阴道超声卵巢窦卵泡计数(AFC)、抗米勒管激素(AMH)水平测定、早期卵泡期卵泡雌激素和雌二醇检测,可预测控制性超促排卵的反应,医患双方共同决策是否需要或何时启动生育力保存计划(证据等级:C)。
两项队列研究表明,BRCA1和BRCA2突变携带者自然绝经年龄较非携带者提前。另有几项研究比较了BRCA携带者与非携带者卵巢对促排卵的反应、AMH水平与卵巢窦卵泡计数,发现BRCA携带者卵巢储备功能存在不同程度的降低;当然有些研究并未证实BRCA突变携带者存在妊娠率降低或更多其他生育力下降等问题。BRCA1/2突变携带者伴有生育障碍时,借助冷冻卵子和(或)胚胎ART完成生育计划(证据等级:B)。
关于遗传性妇科肿瘤患者冷冻卵子和冷冻胚胎有关的医患沟通问题,首先要告知患者,卵子和胚胎冷冻保存只是争取自身生育的机会,并不代表活产;其次,妊娠成功率在很大程度上取决于年龄,也受医疗技术、生活方式等其他因素的影响;再次,成功率可能因诊疗机构而异(证据等级:C)。患者自愿决策体外受精(IVF)的时机、意向可接受的ART周期数,医生充分、全面告知患者与ART相关的肿瘤风险,尽管截止目前未发现助孕药物会增加BRCA突变携带者乳腺癌的患病风险,但谨慎起见,助孕过程中要严格控制雌二醇水平,升幅尽量达到最小化,可选择的方案是芳香化酶抑制剂(来曲唑)联合促性腺激素刺激方案。一项关于助孕药物对乳腺癌患者生存结局影响的研究,FP组120例患者接受促性腺激素联合来曲唑促排卵治疗,与非FP组217例患者对照,结果发现FP组患者生存率无明显降低。关于妇科肿瘤高风险女性进行ART的安全性问题,有限数据证实ART至少在短期内不增加BRCA突变携带者的卵巢癌风险。
6.2 降风险手术后的生育问题
6.2.1 RRSO后的选择 已保存冷冻卵子或胚胎而接受RRSO者,可借助体外受精-胚胎移植完成生育;否则可以考虑供卵完成生育。领养子女也是一种选择。
6.2.2 子宫切除术后的选择 育龄期妇女因子宫内膜癌或子宫内膜癌高风险而切除子宫者,如手术保留卵巢,理论上,患者仍可通过IVF等手段获得生物学意义上的后代。
子宫移植术是实现生育计划的新技术,最近有活产病例报道;但遗传性妇科肿瘤高风险妇女,子宫移植术在保留生育功能中的作用和风险尚未确定。
< h3>7 遗传和生殖
遗传性妇科肿瘤为常染色体显性遗传,突变基因携带者有50%的概率将致病性突变传递给子代。植入前遗传学检测和产前诊断技术能最大程度地降低致病性突变向子代传递的风险(推荐等级:B)。
7.1 植入前遗传学检测 携带致病性基因突变的女性罹患癌症风险较高,这类患者应接受植入前遗传学检测(preimplantation genetic testing,PGT)相关的遗传咨询(推荐等级:B)。PGT首先通过体外受精技术获得胚胎,对胚胎(常在囊胚期)进行活检,通过遗传学检测筛选不携带致病性基因突变的胚胎移植。对胚胎活检细胞进行单基因缺陷(preimplantation genetic testing for monogenic/single gene defects;PGT-M)检测的同时也可进行非整倍体检测(preimplantation genetic testing for aneuploidy;PGT-A)。
不同于产前诊断的是,PGT-M在妊娠前就可以识别携带致病性突变基因的胚胎,有效规避妊娠期的担忧和顾虑,避免妊娠期发现胚胎携带致病性突变终止妊娠。选择PGT-M前,应充分告知下列相关事宜:首先,可获得囊胚的数量受年龄、卵巢储备等多种因素的影响;其次,理论上50%的胚胎不携带致病性基因突变,并不意味每例患者获得的囊胚中有50%不携带致病性突变,有时这种概率可能为0。一项BRCA基因突变患者PGT的观察性研究显示,720枚胚胎中有294枚(40.8%)未携带BRCA突变基因;再次,PGT时机很重要,如有冷冻保存的卵子,一旦决定卵子体外受精便可考虑PGT-M,暂无生育计划者冻存PGT检测后胚胎。患者对借助PGT达到优生优育的策略仍有较多的顾虑。调查发现,高危妇女中仅有32.5%表示会选择PGT-M。优化遗传性妇科恶性肿瘤患者的生殖决策,为患者提供PGT相关的教育和咨询仍十分必要(证据等级:C)。
7.2 产前诊断 产前诊断是妊娠期对胎儿进行染色体数目、结构异常及遗传基因突变检测等的技术手段,近几十年来,绒毛取样(chorionic villus sampling,CVS)和羊膜腔穿刺术已广泛用于胎儿非整倍体或结构性染色体畸变的检测,检测时机分别为妊娠10~14周和15周后。CVS和(或)羊膜穿刺术提取胎儿/绒毛细胞通过不同技术路线不仅能确定胎儿染色体核型和染色体结构异常,还可检测特定的致病性基因突变(证据等级:C)。随着分子检测技术的迅速发展与提高,胎儿游离DNA检测技术(妊娠10周左右)内容不断得以扩展,除传统用于筛查排除胎儿非整倍体外,也可用于染色体大片段重复或缺失,致病基因拷贝数变异(CNV)筛查。随着测序技术深度的不断进步,通过提取外周血胎儿游离细胞,对于胎儿血型进行鉴定以及家族遗传性疾病的基因检测也开始逐渐开展。但因为胎儿游离DNA检测技术尚处于筛查目的阶段,临床上尚不能作为产前最终诊断,同时也未被推荐用于肿瘤相关基因的产前诊断。根据CVS或羊膜穿刺术结果,诊断为携带致病性基因突变的胎儿,是否终止妊娠需考虑道德和伦理方面的问题。
7.3 RRSO后的随诊与HT 自然绝经前接受RRSO或THBSO,意味着提早进入医源性绝经期。降风险手术后每年1次盆腔检查,监测CA125水平,鼓励体育锻炼,补充钙元素和维生素D,每隔1~2年进行1次骨扫描(推荐等级:C)。
RRSO后是否适用于HT存在不同观点,研究认为,只要不存在禁忌证即可接受HT。HT能缓解绝经期症状,是否增加高危患者乳腺癌风险尚无定论。前瞻性研究发现,BRCA1突变患者RRSO后接受HT,不增加乳腺癌风险。50岁前行THBSO普通人群,术后心血管疾病风险明显增加,全因死亡率升高。考虑到上述风险及手术干预引起的雌激素水平下降,无乳腺癌病史者接受HT其潜在获益可能大于风险。患者存在HT禁忌证或无接受HT意愿,也可选择非激素治疗缓解血管舒缩症状,其中包括选择性5-羟色胺再摄取抑制剂(Selective Serotonin Reuptake Inhibitors,SSRIs)、α2肾上腺素受体激动剂、饮食和生活方式调节等。绝经期症状的治疗需结合病史和治疗目标,遵循个体化原则,综合考虑潜在肿瘤风险与机体获益。HT用于妇科肿瘤高危女性的推荐见表3。

遗传性致病基因突变相关的妇科肿瘤除涉及肿瘤本身的规范治疗与干预,降低肿瘤风险获益,但非生理年龄丧失正常的解剖、生理乃至生殖功能,因此遗传性妇科肿瘤的预防性医疗干预是一把“双刃剑”,虽然从中可以获益,对生育和内分泌功能的影响也不容忽视。妇科肿瘤遗传性致病性突变基因携带者面临近远期的诸多问题,这包括预防性干预、干预措施对年轻女性未来的生育功能影响、致病性基因遗传给后代的风险、预防性输卵管/卵巢切除术后HT等。
遗传性肿瘤风险评估可有效识别罹患某种肿瘤的高危人群或家族,主要内容为系统性个人史和家族史评估,应由遗传咨询师、妇科肿瘤医师、妇产科医师以多学科联合形式进行。根据遗传性肿瘤指南,在知情同意前提下,进行家族史询问,应包括一级亲属、二级亲属和三级亲属,记录肿瘤患者的肿瘤类型、发病年龄、父系和母系家族史等(推荐等级:B),绘制家系图评估结果,如提示遗传性肿瘤风险高,推荐转介给肿瘤遗传学专家或遗传学专家进行更深层次的家族史采集、风险评估、教育和咨询,甚至需进行基因检测和适宜的肿瘤筛查或采取降风险措施干预。对于基因检测项目选择,应建立在肿瘤风险评估的基础上,选择适宜的项目。推荐选择多基因检测,提高致病性基因突变的检测率;接受骨髓移植和近期或活动性血液恶性疾病者不推荐通过血液、唾液样本检测,推荐培养成纤维细胞后检测;年龄<18岁者不推荐进行基因检测(推荐等级:B)。
有卵巢上皮性癌个人史或家族史的妇女,建议进行遗传咨询(推荐等级:B);遗传性卵巢癌综合征初步风险评估应包括个人史和家族史(推荐等级:C);当风险评估表明可能存有特定的易感基因时,建议进行基因检测(推荐等级:C)。遗传性子宫内膜癌的筛查(如患有LS者)应该在50岁以前进行,小于50岁或有家族史的子宫内膜癌或结肠癌患者建议进行基因检测和遗传咨询(推荐等级:B)。无论患者有无基因突变,有显著的家族性子宫内膜癌和(或)结肠癌的患者均应进行遗传咨询和检测(推荐等级:B)。具备以下任意1项者需行基因检测和遗传咨询:(1)2个及2个以上组织学证实为PJS型错构瘤型息肉(2)口腔、嘴唇、鼻子、眼睛或手指等皮肤黏膜部位出现色素沉着(3)PJS家族史(推荐等级:B)。
推荐BRCA1/2突变携带者从30~35岁开始行经阴超声联合血清CA125筛查(推荐等级:B);LS人群从30~35岁开始每隔1~2年进行1次子宫内膜活检(推荐等级:B);推荐具有性生活的PJS人群从18~20岁开始每年进行1次妇科检查和宫颈细胞学涂片筛查(推荐等级:B)。无乳腺癌病史的BRCA1/2突变人群,推荐应用OCPs以降低患卵巢癌风险(推荐等级:B);LS人群可应用孕激素为基础的OCPs预防子宫内膜癌(推荐等级:C)。推荐BRCA1突变携带者35~40岁、BRCA2突变携带者40~45岁实施RRSO(推荐等级:B),标本推荐分段式全输卵管及伞端剖切检查(SEE-FIM),显微镜检查排外或发现隐匿性癌(推荐等级:B);如高危患者暂不接受RRSO,方可推荐预防性双侧输卵管切除术(推荐等级:B);RRSO是否附加子宫切除术,应遵循个体化原则。LS人群在完成生育计划后(尤其年龄>40岁)推荐预防性THBSO(推荐等级:B);THBSO前应常规进行子宫内膜活检,排除隐匿性子宫内膜癌(推荐等级:C)。PJS人群目前尚无药物预防和降风险手术相关推荐。
妇科肿瘤高危女性的“育龄期”时间窗相对更短,推荐接受RRSO降风险手术者,借助冻卵或冻胚ART完成生育(推荐等级:B)。妇科肿瘤医师要有肿瘤生殖学的意识和理念,指导BRCA1和BRCA2突变携带者就诊生殖内分泌科,以便有相对富裕的时间评估基础卵巢储备,指导和实施生育力保存计划(推荐等级:C)。如患者未保存冻卵或冻胚,可考虑供卵或领养子女等。
携带致病性基因突变的女性罹患妇科肿瘤风险较高,推荐接受植入前遗传学检测(PGT)的教育和咨询(推荐等级:B)。产前诊断包括CVS和羊膜腔穿刺术用于胎儿遗传性肿瘤的检测,尚无推荐依据。
降风险手术后,推荐每年1次盆腔检查,监测CA125水平,鼓励体育锻炼,补充钙和维生素D,每隔1~2年进行1次骨扫描(推荐等级:C)。无乳腺癌个人史的BRCA1/2突变人群推荐HT(推荐等级:B);有乳腺癌个人史的BRCA1/2突变者不推荐HT(推荐等级:A);LS人群推荐HT(推荐等级:A)。
本共识旨在为遗传性妇科肿瘤的遗传咨询、筛查、预防、生育力保护、医疗干预后的诸多问题提供指导性意见,在临床实践中需考虑患者的个体需求、所属地的医疗资源以及医疗机构的性质决定。本共识制定不排除其他学术组织有关建议的合理性(参考文献略)