靶向绽放,免疫齐飞:肺癌系统治疗新时代的放疗进展全面梳理
2020年9月5日,“放疗靶向学院”大会于杭州线下和线上成功召开,大会汇聚肺癌和放射科领域多位专家学者,探讨肺癌靶向与放疗的最新前沿进展。大会邀请杭州市第一人民医院集团/杭州市肿瘤医院的马胜林教授担任会议主席,杭州市第一人民医院集团/杭州市肿瘤医院的夏冰教授担任会议执行主席和上半场主持,浙江省肿瘤医院的余新民教授担任下半场主持,多位专家学者在学术盘点中分享了放疗及靶向治疗在早期、局晚期及晚期非小细胞肺癌(NSCLC)治疗中的应用策略。
夏冰教授指出:“虽然受疫情的影响,学术交流有了地域的障碍,但得益于互联网技术的进步,我们依然可以及时地通过线上的方式探讨最新进展。本次会议聚焦放疗技术理念的更新,各种治疗方式的优化组合,探讨从早期、局晚期再到晚期NSCLC,药物与放疗在NSCLC中的应用。”
马胜林教授在开场致辞中表示:“本次会议以线下线上结合的方式进行,与会的各位讲者和专家也都是放疗和肿瘤内科领域的‘新星’级精英,这样的讨论有望进一步在国内推动进步迅速的肺癌治疗。放疗在肿瘤中的地位不言而喻,而肺癌需要多学科治疗,随着各种药物、放疗等治疗手段的不断进步,在早期新辅助和辅助、晚期治疗阶段,我们要进一步思考到如何进行优化组合和排兵布阵,这需要临床医生不断进行学术探讨,更新知识储备,以推动临床研究和治疗进步,从而造福患者。”
王艳阳教授:
放疗与药物在早期NSCLC治疗中的探索
宁夏医科大学总医院的王艳阳教授分享了放疗治疗不可手术早期肺癌、放疗辅助治疗不完全切除早期肺癌,以及早期肺癌的辅助化疗和靶向治疗进展。
(1)早期不可手术NSCLC的放疗治疗
放射治疗目前已进入精准放疗时代,其中立体定向体部放疗(SBRT)有分割次数少、单次治疗剂量高的特点,可实现高度适形,靶区外剂量迅速跌落,在不能手术的NSCLC治疗中被广泛使用,治疗的局部控制率可达90%以上,且不良反应轻,是不可手术/拒绝手术患者的最佳治疗选择。
一系列数据库和临床研究结果显示,SBRT治疗早期不可手术NSCLC的疗效优于常规分割放疗(CFRT)。如美国NCDB数据库统计了2004-2015年确诊的早期NSCLC患者,其中2286例(10%)患者接受CFRT治疗,20802例(90%)患者接受SBRT治疗,两组中位总生存(OS)为38.8个月对28.1个月,SBRT显著延长患者中位OS。
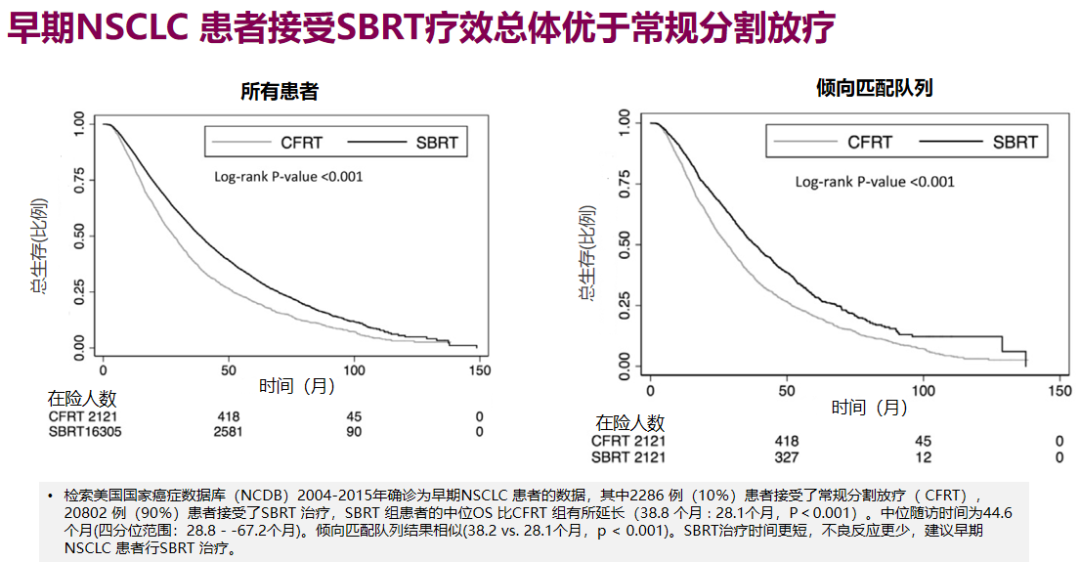
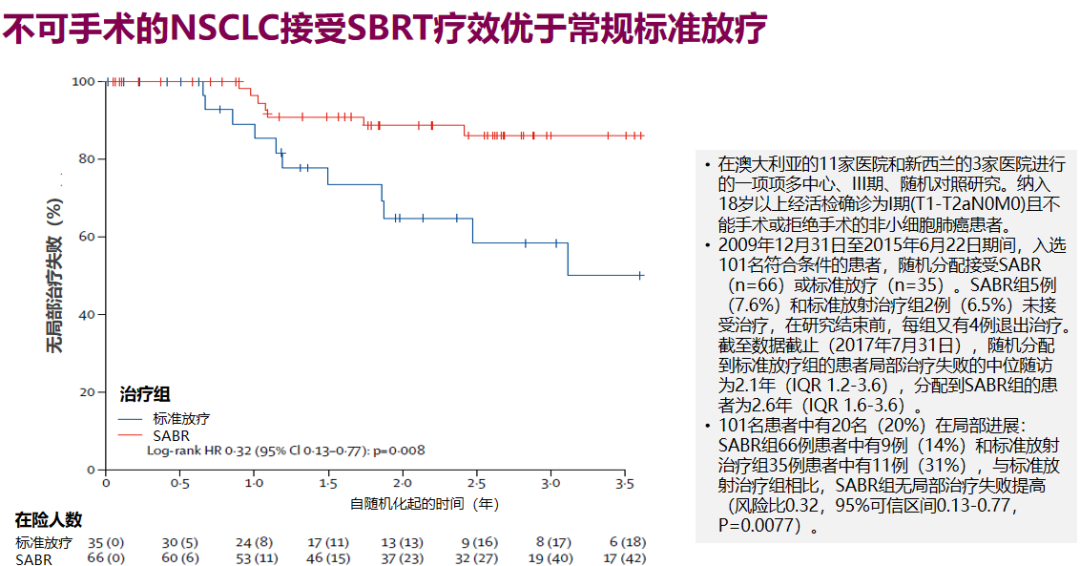
临床III期随机对照研究TROG 09.02 CHISEL、RTOG 0236等,同样提示SBRT放疗的优势。但对不可手术的中央型肺癌,SBRT剂量分割选择仍应谨慎考虑,严格限制靶区体积,探索最佳剂量分割方案以减少相关毒性,此外早期NSCLC患者在SBRT治疗后,全身化疗可能会不利预后,化疗或仅限于肿瘤大小>5cm的患者。
(2)早期NSCLC的术后辅助放疗或化疗
随着放疗技术的进步,术后辅助放疗在早期NSCLC患者的治疗中,逐渐体现了改善患者预后的明确作用。但一些荟萃分析和回顾性研究显示,在II-IIIA期NSCLC患者中,只有存在N2淋巴结转移的患者才能从术后放疗中获益,且局限于肿瘤直径较大、淋巴结转移度(LNR)高的患者,而N0/1的早期患者无明显获益。
此外基于美国NCDB数据的多项回顾性研究也提示,接受不完全切除术(R1/R2)的早期NSCLC患者,才可能从术后辅助放疗中获益,因此美国国家综合癌症网络(NCCN)指南也建议对术后辅助放疗谨慎考量,即使是N2患者也需要经多学科诊疗(MDT)确定。
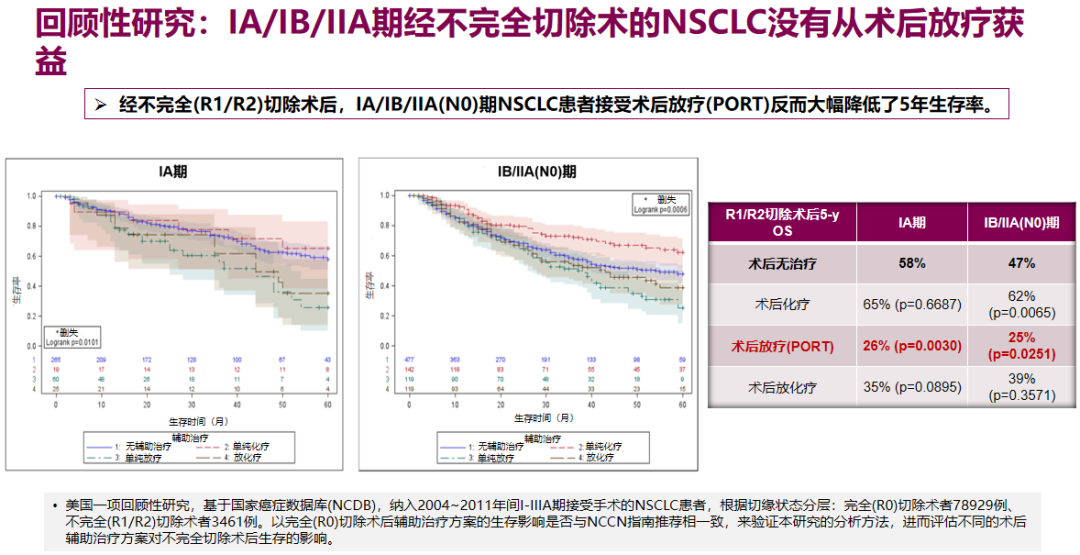
在术后辅助化疗方面,如果不加选择地在早期NSCLC治疗中应用辅助化疗,并不能带来显著的生存获益。NCCN指南目前建议,对IB期以下患者不进行术后常规辅助化疗,除非患者存在高危因素,而II期以上患者术后应考虑辅助化疗。临床可通过分子检测,识别高危的早期NSCLC患者,指导辅助化疗的应用。
(3)术后辅助靶向治疗在早期NSCLC中的探索
E1505等随机对照试验显示,术后辅助化疗加用贝伐珠单抗等抗血管生成药物,不能使IB-IIIA期的NSCLC患者获益。回顾性研究数据显示,EGFR突变阳性的早期NSCLC患者,术后预后相对更好。ADJUVANT试验结果显示,术后辅助EGFR靶向治疗在无病生存(DFS)方面带来了显著获益,但OS未能达到有统计学意义的显著延长。
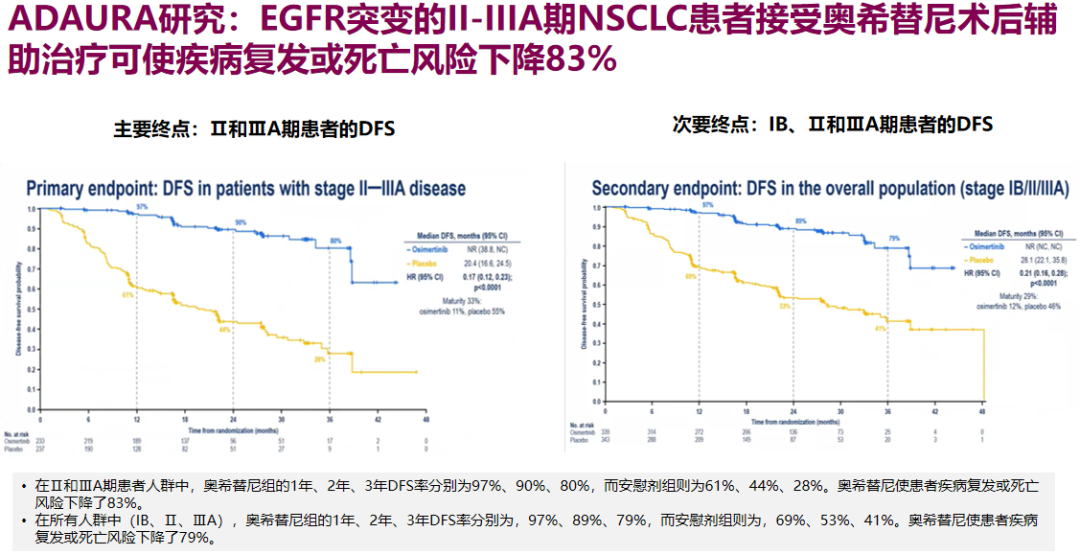
与一代EGFR-TKI相比,2020年美国临床肿瘤学会(ASCO)年会上公布结果的ADAURA研究数据显示,三代EGFR-TKI奥希替尼效果更强,在用于EGFR突变的II-IIIA期NSCLC患者术后辅助治疗时,可使疾病复发或死亡风险下降83%(HR 0.17),是术后辅助靶向治疗目前已知最好的HR值,且为所有亚组带来了显著获益。
• 讨论要点:
浙江省肿瘤医院的封巍教授和中日友好医院的熊英教授,对SBRT在早期NSCLC中的作用,以及辅助、新辅助放疗与药物联合治疗的可能性进行了剖析:
1. 临床可能存在多病灶、肉瘤样癌、微乳头状癌、黏液样癌、良性疾病等特殊情况的早期NSCLC,手术难以实现完全切除,SBRT治疗是更加常用的选择;对相对常见的不可手术早期NSCLC,SBRT治疗的局部控制率也已相当出色。
2. 如果患者检出EGFR等基因突变,则放疗的定位可能转变为辅助/新辅助放疗,从而实现与药物的联合,尤其对IIIA期这一早期肺癌中预后相对最差的群体,放疗+术后靶向治疗有望显著延长患者的生存期。
朱正飞教授:
放疗与药物在局晚期NSCLC治疗中的探索
复旦大学附属肿瘤医院的朱正飞教授基于目前不可切除局部晚期NSCLC治疗策略和临床诊疗中的问题,分析了EGFR突变患者采用放化疗联合EGFR-TKI的治疗前景。
(1)不可切除局部晚期NSCLC患者的现有治疗模式
我国有约四分之一的NSCLC肺癌患者确诊时已为III期,这些患者仍可通过MDT,接受以治愈为目标的根治性治疗,使生存获益最大化。但多数III期患者,可能已失去最佳的手术治疗时机,即不可切除的局部晚期NSCLC患者。
根治性同步放化疗从20世纪80年代开始用于不可手术局晚NSCLC的治疗,大量研究已确立其长期生存获益和标准治疗地位。但围绕同步放化疗的诱导、巩固化疗等策略并未取得进展,患者的中位生存期约为25个月,仍难以令人满意。
(2)免疫治疗联合同步放化疗,开启III期肺癌治疗新时代
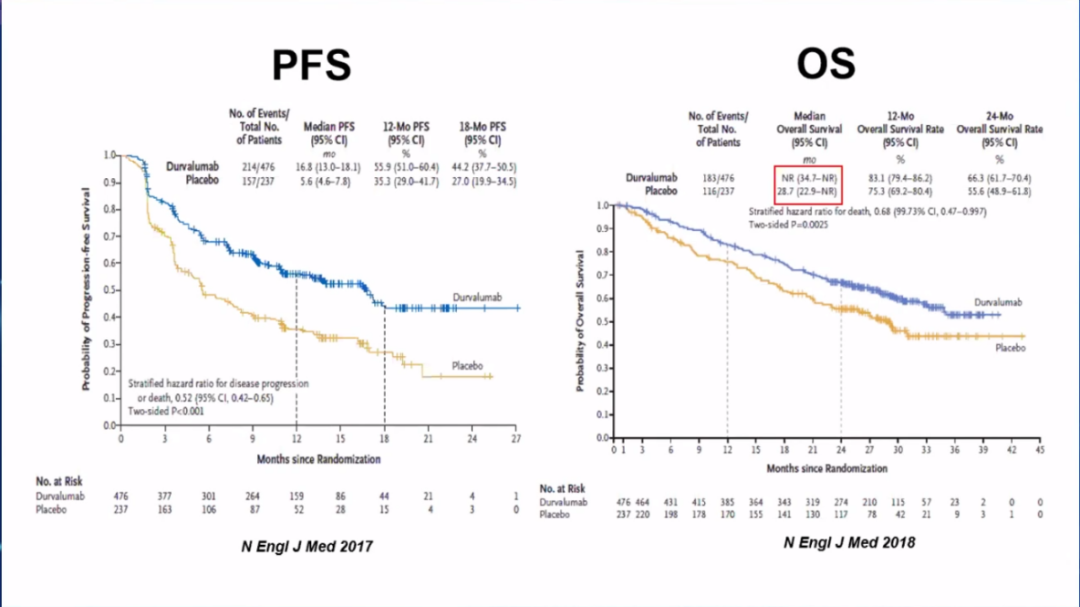
免疫治疗的出现,为提升局晚NSCLC的疗效带来了新机会。PACIFIC研究是免疫联合放化疗的首次成功,研究中患者在同步放化疗后,接受PD-L1抑制剂度伐利尤单抗维持治疗,3年OS率达到57%,中位OS和无进展生存(PFS)都较安慰剂组显著改善,而且免疫治疗的加入,并未导致放射性肺炎等3级以上不良事件的明显增多。
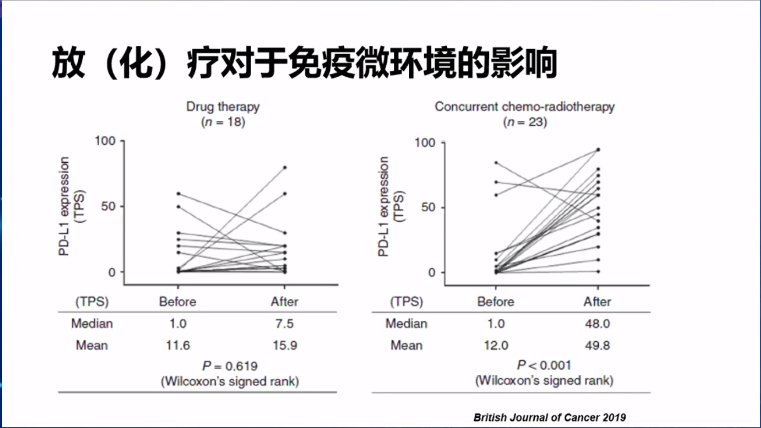
帕博利珠单抗的临床II期LUN 14-179研究,疗效终点数据也与PACIFIC研究接近,充分证明放化疗对肿瘤微环境存在调节作用,研究显示新辅助放化疗可上调PD-L1表达水平、增加CD8+T细胞浸润等,有利免疫治疗的使用。
除PACIFIC研究的“免疫巩固”模式外,免疫诱导、免疫同步等治疗模式也被提出,如NICOLAS、DETERRED、KEYNOTE-799等免疫同步早期研究,已经证实了免疫同步治疗的疗效,且放射性肺炎发生率并不高,已进入临床III期验证阶段,PACIFIC2、EA5181等研究有望进一步改写局晚治疗临床指南。
2020年ASCO年会的一项初步研究(Abstract #9045)显示免疫诱导模式治疗的疗效和安全性较好。从理论上免疫诱导模式存在患者未经治疗创伤,免疫系统相对完善;免疫治疗有望缩瘤,缩小放疗靶区以减轻副作用;免疫治疗可改善效应T细胞浸润等,作用机制有待研究进一步证实。
但EGFR等驱动基因阳性的不可切除III期肺癌患者,目前仍被视为不适合免疫治疗的群体,这类局晚患者需要寻找新的治疗优化出路,以进一步改善预后。
(3)放疗联合TKI,带来治愈新希望
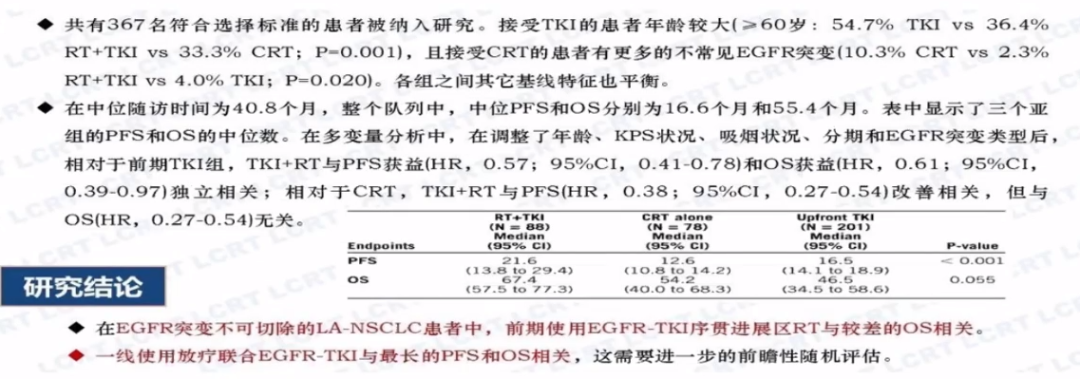
放疗联合EGFR-TKI的临床探索一直在进行,如2020年ASCO年会一项中国多中心、回顾性研究(Abstract #9047)共入组435例EGFR突变阳性的不可切除局晚NSCLC患者,分为三组接受:1)放疗+EGFR-TKI±化疗;2)先使用EGFR-TKI,出现进展则加入放疗/化疗;3)仅放化疗,评价不同治疗模式对患者生存期的影响。
放疗+EGFR-TKI±化疗,可使EGFR突变阳性局晚NSCLC患者的中位PFS达到21.6个月,中位OS为67.4个月,获益相对最大,而先使用EGFR-TKI可能会减小OS获益,以上两组相比单纯放化疗均显著延长生存,但结论有待前瞻性研究证实。
而在奥希替尼获批后,同步放化疗+奥希替尼维持治疗也已经开展了临床探索,由于奥希替尼可以高效地抑制EGFR-TKI敏感突变及T790M耐药突变,它在不可切除III期患者中的应用前景备受期待。LAURA研究将入组200例CRT后的局部晚期患者,探索奥希替尼维持治疗对EGFR阳性不可切除III期患者的治疗价值。
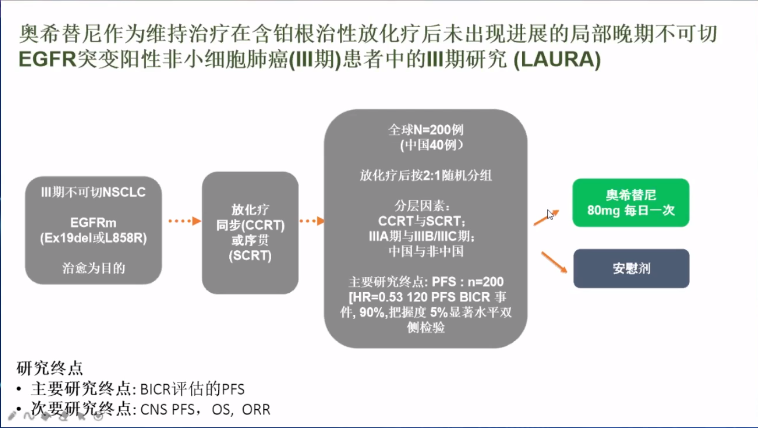
• 讨论要点:
针对局晚期放疗与TKI治疗模式应选择同步还是序贯、免疫治疗在局晚放化疗中的最优使用模式等问题,四川大学华西医院的薛建新教授和浙江省肿瘤医院的盛李明教授进行了解读:
1. 虽然回顾性研究数据显示放疗同步TKI可能获益最大,但目前尚无大规模临床研究支持这一观点,RECEL等研究也面临患者例数不足的问题,因此不能排除TKI诱导治疗,再序贯同步放化疗缩瘤、改造免疫微环境等价值。
2. PACIFIC研究首次证实了免疫巩固治疗的获益,而免疫同步模式可能不是局晚NSCLC免疫治疗的最优解,因为化疗、分割放疗可能对免疫微环境中的效应T细胞产生杀伤,削弱免疫治疗的作用。
周蓉蓉教授:
放疗与药物在晚期NSCLC治疗中的探索
中南大学湘雅医院的周蓉蓉教授结合晚期NSCLC放疗和药物治疗的现状,分析了放疗联合靶向治疗用于不同远处转移部位的疗效和安全性差异。
(1)晚期NSCLC放射治疗现状
放疗在晚期NSCLC的治疗中目前仍有一席之地,除局部姑息治疗、局部消融等用法外,对寡转移的治疗效果也得到NCCN临床实践指南的认可,研究显示放疗剂量达到63Gy以上,与患者预后更好有关。
2020年ASCO年会上公布的中国临床III期SINDAS研究(Abstract #9508)数据提示,对存在寡转移的患者,EGFR-TKI联合放疗一线治疗,可显著延长患者PFS(20.2个月 vs 12.5个月)和OS(25.5个月 vs 17.4个月),且安全性良好。
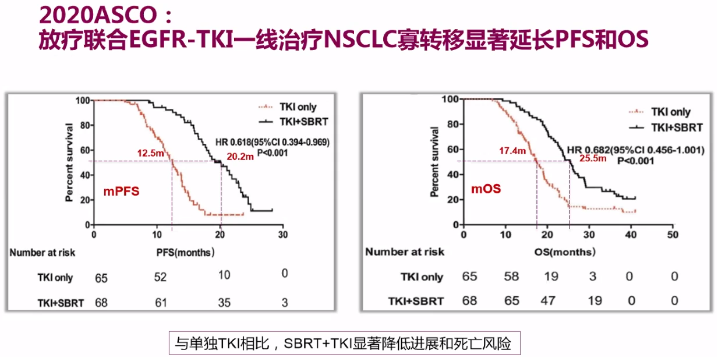
(2)放疗联合药物在脑转移NSCLC中的应用
放疗联合化疗、TKI等药物治疗,用于脑转移患者也存在增效机制,其中放疗破坏血脑屏障增加药物渗透性是增效性的基础。但与单纯含铂化疗相比,同步或序贯放化疗仅能改善颅内缓解率,并未真正改善NSCLC脑转移患者的生存。

放疗联合TKI的增效机制与化疗类似,而在EGFR-TKI当中一二代TKI入脑效果不佳,三代TKI奥希替尼则更易通过血脑屏障,脑脊液(CSF)穿透率可达44%,在FLAURA等多项临床研究中都体现了对脑转移的良好疗效,还有降低患者发生脑转移风险的预防作用,ALK突变的TKI药物阿来替尼也体现了类似优势。
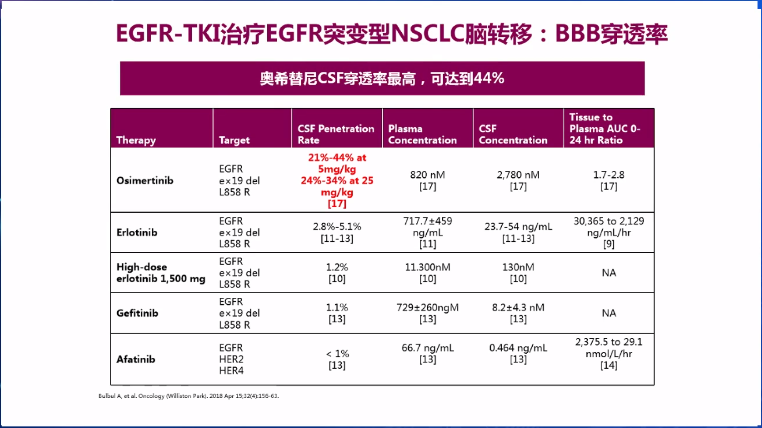
放疗联合EGFR-TKI治疗脑转移NSCLC患者的获益,已得到Meta分析数据证实,但治疗最优模式仍存在较大争议,对先放疗后序贯TKI治疗、先TKI治疗后放疗以及TKI同步放疗三种模式的探索,就主要集中于脑转移患者。
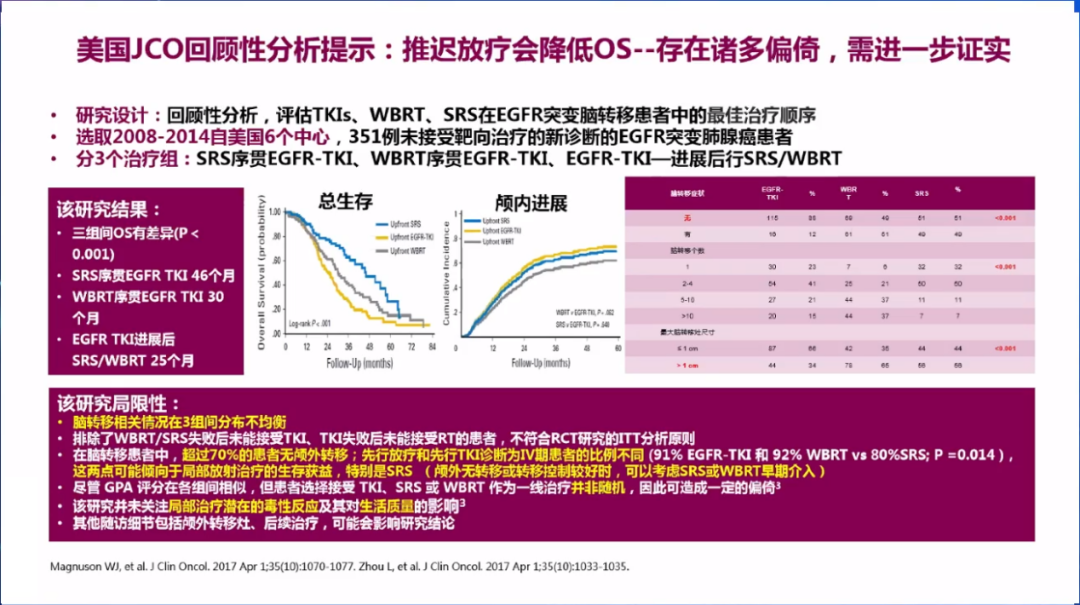
2017年一项美国多中心回顾性分析显示,TKI治疗进展后使用立体定向放射外科(SRS)/全脑放疗(WBRT)患者的OS,明显低于SRS序贯TKI和WBRT序贯TKI治疗,提示推迟放疗可能影响脑转移的治疗效果,但研究未关注副作用和患者生活质量,局限性较为明显。
2017年的临床III期BRAIN研究提示,对多发脑转移的EGFR突变阳性患者,先使用TKI药物埃克替尼治疗,疾病进展后再行WBRT,PFS获益显著优于化疗(10.0个月 vs 4.8个月),但研究设计存在多方面问题,如并未对比先TKI后放疗和TKI单药治疗的效果,也未采用SRS放疗,且研究终点并非OS,临床指导价值有限。
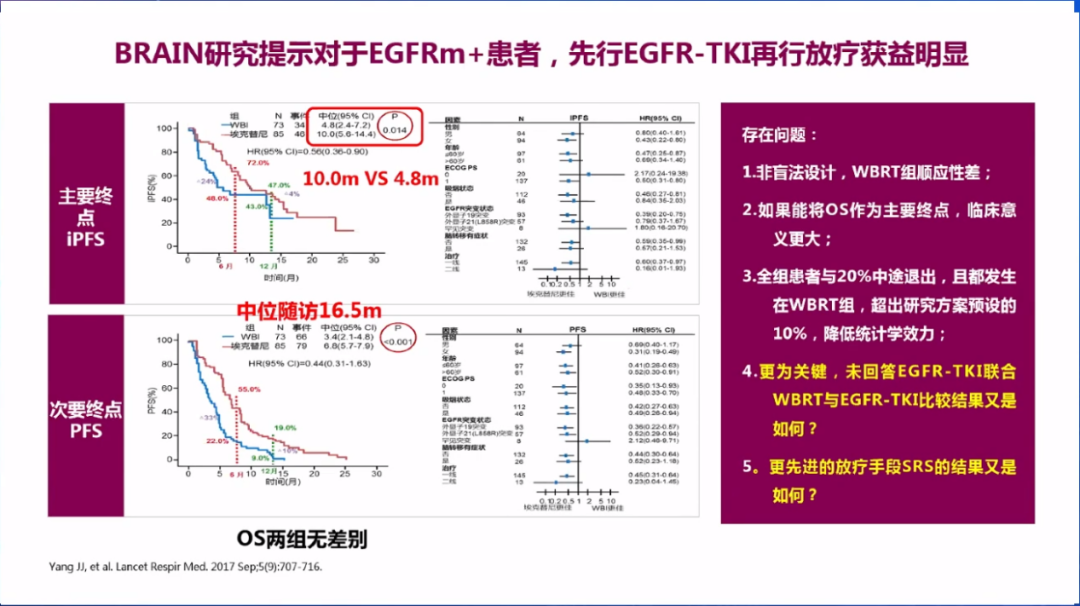
而EGFR-TKI同步放疗目前临床研究仍然非常有限,少数研究报告了PFS/OS获益,但WBRT相关副作用可能被TKI治疗放大,导致脑白质病变、2-3级认知功能受损等发生率增加。奥希替尼联合放疗的临床研究已经开展,结果值得期待。
(3)放疗联合药物在NSCLC其它远处转移中的应用
骨转移、肝转移等也是晚期NSCLC常见的转移部位,其中骨转移的真实发生率较高,是患者预后明显不佳的预测因素。放疗是控制骨转移的常用手段,而EGFR-TKI可抑制骨重吸收,减少病理性骨折发生,因此联合治疗有望为患者带来获益。
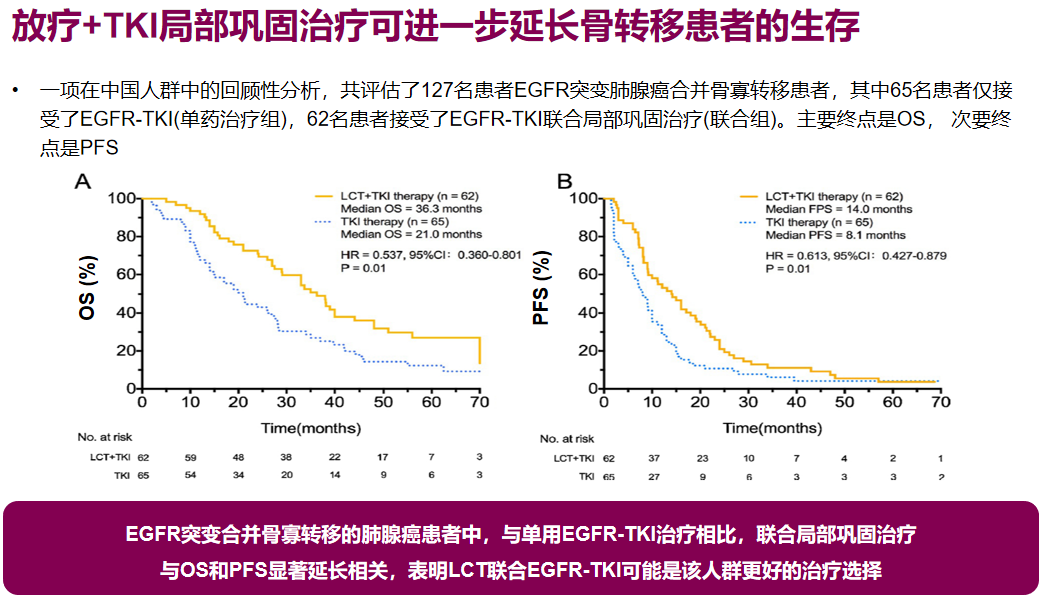
一项对中国127例患者的回顾性分析显示,对存在骨转移的EGFR突变阳性肺腺癌患者,放疗+EGFR-TKI局部巩固治疗,可较TKI单药治疗进一步延长PFS和OS,提示放疗+TKI局部巩固治疗是更好的治疗选择。
肝转移同样是晚期NSCLC患者预后不佳的因素之一,SBRT对1-3个肝转移病灶治疗有一定效果,但可能发生新的转移。对EGFR突变阳性患者的肝转移,TKI联合放疗可能有潜在价值,但需要更多数据证实。
• 讨论要点:
围绕寡转移患者放疗联合TKI治疗的价值,以及脑转移、肝转移、骨转移患者的联合治疗,华中科技大学附属同济医院的张莉教授和苏州大学附属第一医院的秦颂兵教授发表了个人见解:
1. 多数临床医生此前倾向于对寡转移患者使用放疗+TKI治疗,放疗可以控制局部转移灶症状,从而延长一代、二代EGFR-TKI的治疗时间,延缓T790M耐药突变出现,而奥希替尼等三代药物的联合,还需要临床实践积累经验;
2. 为了减轻药物联合放疗治疗脑转移的副作用,立体定向放疗应成为联合使用时的首选,但由于肝脏内部容易再发转移灶,联合TKI治疗的价值可能相对有限,而免疫治疗情况又有不同,脑转移的损伤或更难逆转,临床更应重视副作用。
陈雪琴教授:
EGFR突变阳性NSCLC与免疫治疗
杭州市第一人民医院集团/杭州市肿瘤医院的陈雪琴教授分析了EGFR突变阳性NSCLC患者使用免疫治疗的理论依据,以及现有的单药治疗、联合治疗探索进展。
(1)EGFR突变阳性NSCLC与免疫治疗
EGFR突变阳性NSCLC,过往被视为不适合接受免疫治疗的一类肺癌,这与多方面原因有关,如EGFR突变与PD-L1表达负相关。多项国内外人群研究和Meta分析也显示,EGFR突变阳性肺癌的PD-L1表达较EGFR野生型更低。
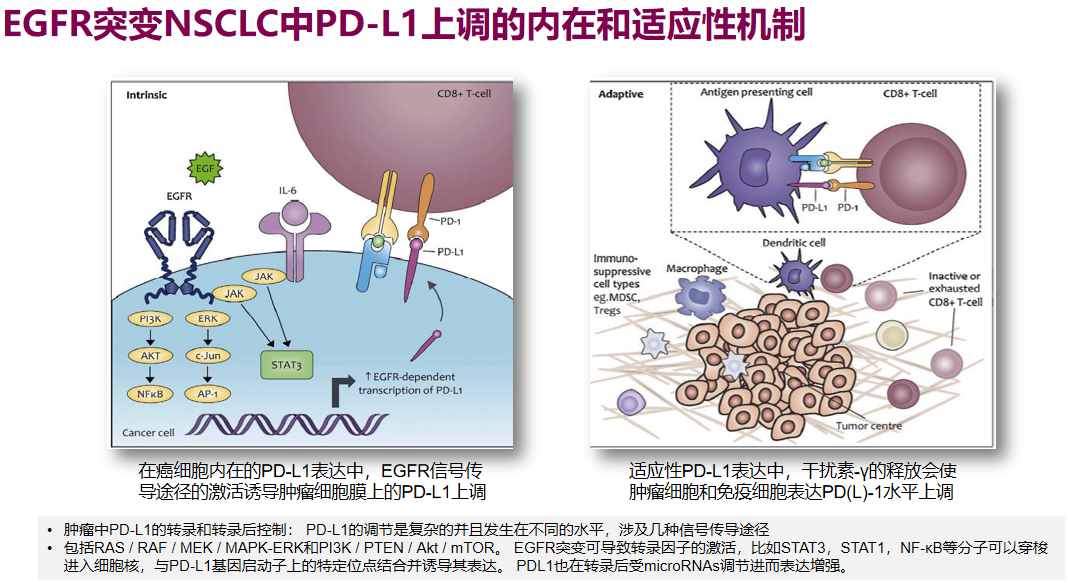
此外EGFR突变阳性肺癌免疫原性差、缺少免疫细胞浸润,都制约了PD-1/L1抑制剂应用,肿瘤突变负荷(TMB)水平较低还与EGFR-TKI的靶向治疗效果差有关。
(2)EGFR突变NSCLC患者免疫单药治疗
帕博利珠单抗、纳武利尤单抗等PD-1抑制剂,在一线/二线治疗肺癌中均未给EGFR突变阳性患者带来明显获益,PD-L1抑制剂度伐利尤单抗的临床II期ATLANTIC试验中,也仅有PD-L1≥25%的患者体现OS获益趋势。
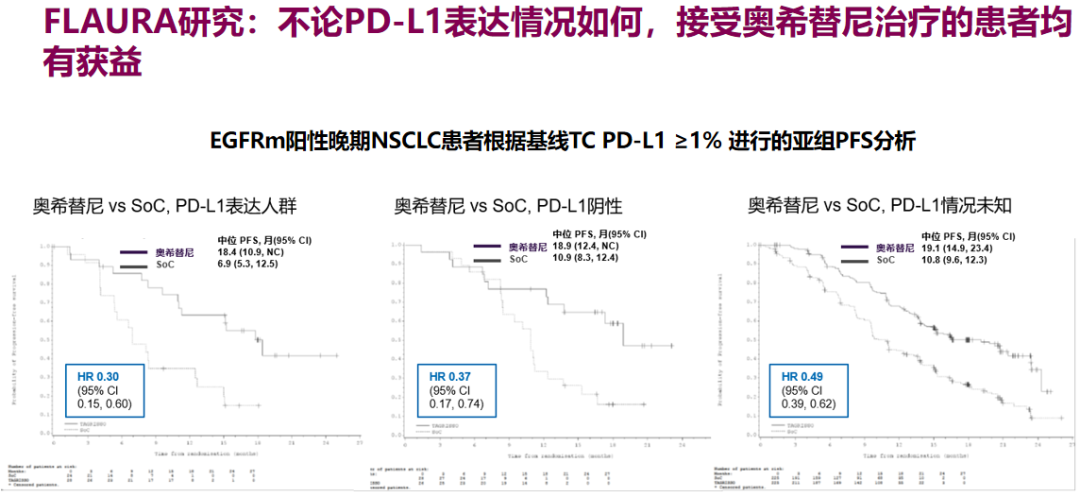
不过FLAURA研究数据提示,三代EGFR-TKI奥希替尼一线治疗的疗效不受PD-L1水平的影响(PD-L1阳性,PFS HR 0.30;PD-L1阴性,PFS HR 0.37),且研究显示靶向治疗会对肿瘤微环境产生明显影响,PD-L1上调可能是一部分患者EGFR-TKIs耐药的原因,尤其是T790M阴性患者,这为PD-1/L1抑制剂的使用提供了依据。
(3)EGFR突变NSCLC患者免疫联合治疗
PD-L1抑制剂阿替利珠单抗的IMpower150研究,是目前少数入组EGFR突变阳性患者的免疫治疗研究,但该研究采用的方案是阿替利珠单抗+贝伐珠单抗+含铂双药化疗(ABCP)对比BCP方案,并未使用EGFR-TKI进行更精准的靶向治疗。
研究的探索性分析显示,EGFR突变阳性患者接受免疫治疗(ABCP),中位PFS达10.2个月,对比不含免疫治疗的BCP方案,PFS HR为0.61,但中位OS未达显著差异(21.4个月 vs 18.7个月,HR 0.87),且研究的EGFR突变阳性患者数量偏少(约10%),证据级别有限,也并未结合患者PD-L1表达水平做进一步分析。
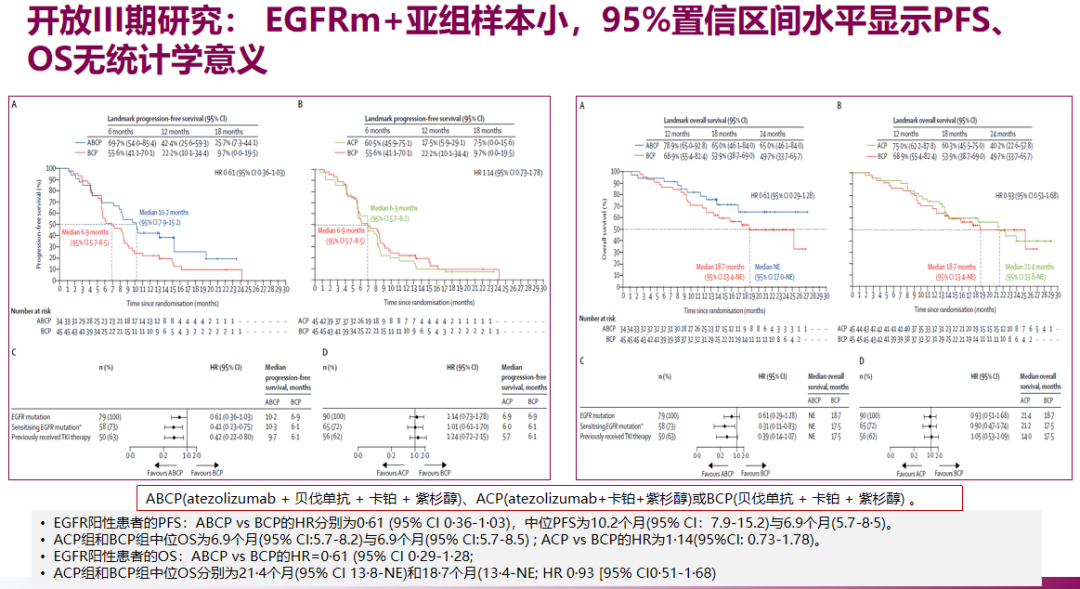
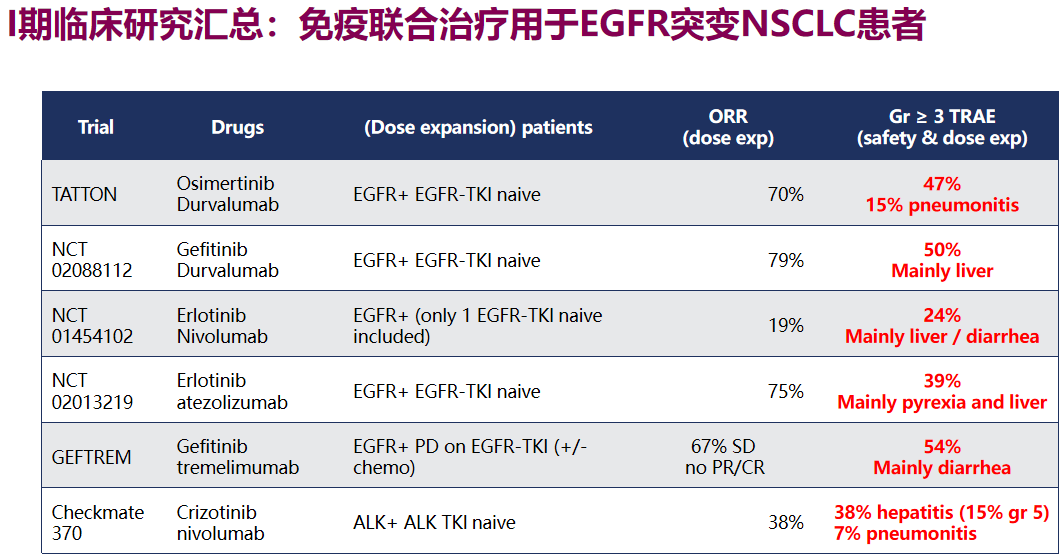
此外IMpower150研究还显示,ABCP方案治疗EGFR突变阳性患者的不良反应发生率达到57%-64%,明显高于免疫单药的水平,其中间质性肺炎的发生风险显著上升。TATTON、CheckMate-370等多项EGFR-TKI联合免疫治疗的临床早期研究,也报告了相似的不良事件倾向,安全性问题可能会制约免疫联合靶向治疗的应用。
• 讨论要点:
针对EGFR突变阳性患者耐药后免疫治疗的使用,浙江大学附属第二医院的夏旸教授和武汉大学人民医院的许斌教授进行了探讨:
1. 针对EGFR突变患者的免疫治疗,现有的证据提示突变患者TMB普遍较低,而对于EGFR突变患者的PD-L1表达情况没有统一的结论。有一些文章提示,PD-L1表达的升高可能是EGFR-TKI耐药的一个机制,但这一情况与EGFR突变后使用免疫治疗疗效不佳是相悖的。因此我们可以从微环境的角度进行更多的考虑,比如EGFR突变的患者有更多的T细胞的耗竭、CD73通路的过度活化等,我们可以采用针对性的治疗,联合或者不联合现有的PD-1/PD-L1抑制剂,另外就是在EGFR突变患者中筛选优势人群。
2. EGFR-TKI耐药的具体机制,也会影响免疫治疗的使用,如三代药物常见的c-MET扩增耐药,对免疫治疗的影响目前仍属未知,T790M突变并非唯一的判断依据,相关问题仍有待后续临床探索。
最后,担任会议主席的杭州市第一人民医院集团/杭州市肿瘤医院马胜林教授对此次会议进行了总结。马教授指出,此次会议对早期、局晚期及晚期NSCLC患者治疗中,放疗和靶向治疗、免疫治疗的联合应用相关知识进行了精彩的探讨。
放射治疗是肿瘤治疗中常用的治疗手段之一,目前已有许多研究探索了各类药物联合放疗的疗效和安全性,在靶向和免疫治疗时代,放疗的地位并没有降低。对于EGFR突变的NSCLC患者,放疗与TKI的联合、序贯应用,可能会给患者带来进一步的生存获益,而以奥希替尼为代表的新型EGFR-TKI及免疫治疗则深刻变革了晚期肺癌的治疗,二者联合有望进一步提高患者的获益,但方案选择、治疗时机和使用的安全性问题,也需要进一步深入研究。
这些年,放射治疗的技术发展可谓十分迅速,放疗技术日趋精准成熟,在靶向和免疫治疗时代下,未来希望多种治疗手段有机结合,NSCLC患者将会得到更佳的个体化治疗。