新模型可提前10年预知癌症风险,国产淋巴瘤新药拟被纳入优先评审
本期提要
Nature Medicine:基因组数据分析最高可提前10年预知癌症风险
Nature Medicine:Avelumab联合阿昔替尼对比舒尼替尼治疗晚期肾细胞癌的生物标志物分析,PD-L1表达与PFS无关
Leukemia: PVd三联疗法治疗初次复发的多发性骨髓瘤患者效果良好
石药集团中诺药业递交的“盐酸米托蒽醌脂质体注射液”上市申请拟被纳入优先审评
1
Nature Medicine:基因组数据分析最高可提前10年预知癌症风险
非整倍体和驱动基因突变先于癌症发生。9月7日,一项新的统计模型被剑桥大学EMBL欧洲生物信息学研究所发布在了Nature Medicine上,这一模型最早可以提前10年识别出食管癌高风险人群。

该研究使用肿瘤前体病变Barrett食管(BE)作为研究对象,通过浅层全基因组测序(sWGS;平均深度0.4×)在一个回顾性病例对照的患者队列中探讨了全基因组拷贝数(CN)的不稳定性与患者疾病进展之间的联系。
通过在食管的多个层面对CN模式进行了检查,研究人员发现,个别进展期患者的基因组在整个基因组中显示出普遍的紊乱,这种紊乱在样本之间会随着时间的推移而变化。随后,研究人员建立了一个统计模型分析基因数据与癌症风险之间的联系。
在长达15年的研究过程中,研究人员发现,该模型最早可以在患者组织病理转化前10年就能区分患者疾病未来的走向。这些发现在76例和248例患者的两个孤立的队列上得到了验证。
这一结果表明基因组风险分层具有非常大的潜力,与目前基于组织病理学和临床表现的管理指南相比,基因组分类可以使高危患者更早地接受治疗,并减少低风险人群不必要的治疗和检测。
2
Nature Medicine:Avelumab联合阿昔替尼对比舒尼替尼治疗晚期肾细胞癌的生物标志物分析,PD-L1表达与PFS无关
9月7日,一项关于Avelumab联合阿昔替尼对比舒尼替尼治疗晚期肾细胞癌(JAVELIN Renal 101 研究)的生物标志物分析结果发表在Nature Medicine上。

JAVELIN Renal 101试验结果显示,Avelumab联合阿昔替尼相比于舒尼替尼一线治疗晚期肾细胞癌,显著延长了患者的无进展生存期(PFS)。这项生物标志物研究包含了来自JAVELIN Renal 101的基线肿瘤样本的分子分析。
结果显示,无论是在试验组还是对照组,PD-L1的表达、肿瘤突变负荷以及Fc&γ;R(Fc-γ受体)单核苷酸多态性都没有对PFS造成影响。但研究者也发现了一些与PFS差异相关的生物学特征,包括新的免疫调节、血管生成的基因表达特征(GESs)、多种人类白细胞抗原、突变谱以及对应的GESs。
这些发现为联合PD-1/PD-L1抑制剂和抗血管生成药物的疗法提供了重要的见解,并有助于改善晚期肾细胞癌患者的治疗策略。
3
Leukemia: PVd三联疗法治疗初次复发的多发性骨髓瘤患者效果良好
2019年9月7日,Leukemia杂志在线发表的一项事后分析显示,相比于硼替佐米+地塞米松二联疗法(Vd),泊马度胺+硼替佐米+地塞米松三联疗法(PVd)可以显著延长来那度胺治疗后初次复发多发性骨髓瘤患者的PFS,且这一结果不受患者前期治疗方案的影响。

OPTIMISMM III期临床试验已经证实,二线PVd三联疗法治疗复发难治性多发性骨髓瘤患者疗效显著优于Vd二联疗法。但是,患者前期的治疗方案是否会影响PVd或Vd的疗效目前尚不清楚。
通过对之前研究数据的分析,研究人员发现,患者初次复发后,无论是否接受过来那度胺、硼替佐米或干细胞移植治疗,二线PVd治疗效果均优于Vd。
具体来说,PVd vs Vd的PFS分别为:
患者接受过来那度胺治疗时,17.8个月 vs 9.5个月(P=0.0276);
患者没有接受来那度胺治疗时,22.0个月 vs 12.0个月(P=0.0491);
患者接受过硼替佐米治疗时,17.8个月 vs 12.0个月(P=0.0068);
患者没有接受过硼替佐米治疗时,20.7个月 vs 9.5个月(P=0.1055);
患者接受过骨髓移植时,22.0个月 vs 13.8个月(P=0.0241);
患者没有接受过骨髓移植时,16.5个月 vs 9.5个月(P=0.0454)。
同时,PVd治疗的总体缓解率也显著优于Vd 。这一结果表明,无论患者在初次复发前接受哪些常规药物的治疗,PVd治疗的效果均显著优于Vd。
4
石药集团中诺药业递交的“盐酸米托蒽醌脂质体注射液”上市申请拟被纳入优先审评
近日,据中国国家药监局药品审评中心(CDE)位点公示信息显示,石药集团中诺药业递交的“盐酸米托蒽醌脂质体注射液”上市申请拟被纳入优先审评。
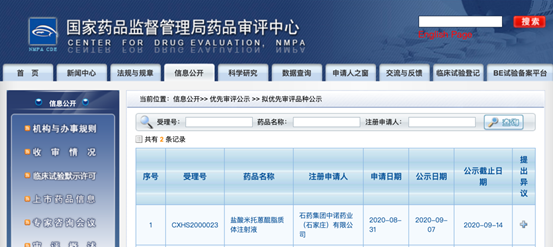
米托蒽醌是一种细胞周期非特异性药物,通过与DNA分子结合,抑制核酸合成从而导致癌细胞凋亡,是临床上常用的广谱抗癌药。不过,由于其严重的心脏毒性及骨髓抑制等不良反应,该药的临床应用受到严重的限制。
盐酸米托蒽醌脂质体是石药集团自主开发的米托蒽醌脂质体制剂,属2.2类改良型新药。通过将米托蒽醌制成脂质体制剂,其药代、组织分布、药效及毒性产生了显著的变化,与普通制剂相比,疗效及安全性显著增加。
此次新药上市申请主要基于一项盐酸米托蒽醌脂质体注射液在复发/难治的外周T细胞和NK/T细胞淋巴瘤中的单臂、开放、多中心的II期研究结果。本次申请上市的适应证为——适用于既往至少经过一线标准治疗的复发或难治的外周T细胞淋巴瘤患者。
据悉,该产品目前在全球没有相似产品,石药正在全力争取该产品上市。
参考资料:
1.Killcoyne, S., Gregson, E., Wedge, D.C. et al. Genomic copy number predicts esophageal cancer years before transformation. Nat Med(2020). https://doi.org/10.1038/s41591-020-1033-y
2.Motzer, R.J., Robbins, P.B., Powles, T. et al. Avelumab plus axitinib versus sunitinib in advanced renal cell carcinoma: biomarker analysis of the phase 3 JAVELIN Renal 101 trial. Nat Med(2020). https://doi.org/10.1038/s41591-020-1044-8
3.Michot J M, Bouabdallah R, Vitolo U, et al. Avadomide plus obinutuzumab in patients with relapsed or refractory B-cell non-Hodgkin lymphoma(CC-122-NHL-001): a multicentre, dose escalation and expansion phase 1 study[J]. The Lancet Haematology, 2020.
4.Dimopoulos, M., Weisel, K., Moreau, P. et al. Pomalidomide, bortezomib, and dexamethasone for multiple myeloma previously treated with lenalidomide(OPTIMISMM): outcomes by prior treatment at first relapse. Leukemia(2020). https://doi.org/10.1038/s41375-020-01021-3
5.http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20