ASCEND研究重磅发表 Acalabrutinib口服单药 R/R CLL患者显著获益
慢性淋巴细胞白血病(CLL)是一种常见的淋巴系统恶性疾病。随着化疗免疫疗法向小分子抑制剂靶向治疗的转变,复发/难治(R/R) CLL患者的治疗发生了巨大的变革。布鲁顿酪氨酸激酶(BTK)作为B细胞受体信号通路的一员,经过临床验证为B细胞恶性肿瘤的重要靶点。Acalabrutinib是一种选择性、强效、共价的BTK抑制剂,在既往的研究中显示出良好的疗效。近日,《临床肿瘤学杂志》(Journal of Clinical Oncology)发表了随机、多中心、开放性Ⅲ期临床研究ASCEND(NCT02970318),探索了Acalabrutinib单药在治疗复发/难治性CLL中的有效性和安全性。

研究背景
I-R:Idelalisib + 利妥昔单抗(Rituximab)[可用于 Ibrutinib耐药患者],无进展生存(PFS)达11~18个月;
B-R:Bendamustine + 利妥昔单抗(Rituximab)[很多国家用于R/R CLL二线治疗],PFS达19.4个月;
Ibrutinib:一线治疗R/R CLL;
Acalabrutinib:在R/R CLL患者(包括高危患者)的I/II期研究中显示了可耐受的安全性和良好的疗效,总体应答率(ORR)为94%,并于2019年获FDA批准用于治疗R/R CLL患者。
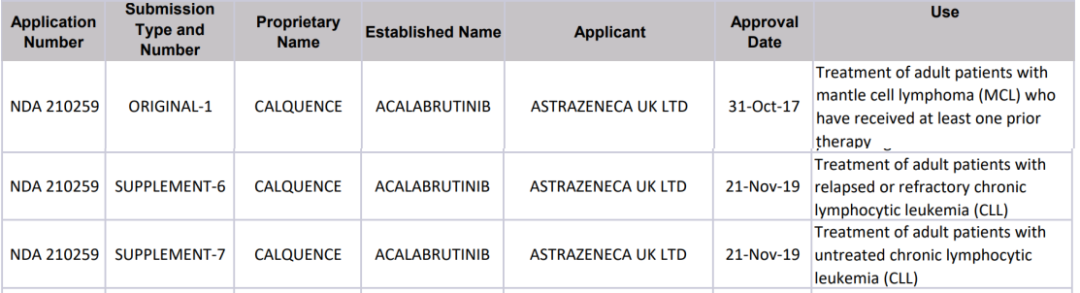
Acalabrutinib FDA获批
研究方法
该Ⅲ期临床研究纳入来自北美、欧洲、中东和亚太地区逇25个国家的102个临床中心的患者进行研究。
入排标准
年龄≥18,既往接受过至少1种治疗;美国东部肿瘤协作组(ECOG)体能状态评分≤2;
既往患有心脑血管疾病、接受过BTK、PI3K、SYK或者BCL-2抑制剂治疗的患者排除研究;
根据del(17p)的突变情况、ECOG体能状态评分 (0~1、2)、以及以往的治疗线数(1~3 v≥4)进行分层,并以1:1随机分配入组。
组别及治疗方案
Acalabrutinib单药组:口服100mg/d*2
I-R:I 口服150mg/d*2;R静脉注射C1 D1,375 mg/m2 ;500 mg/m2 随后2周注射4次;500 mg/m2 随后4周注射3次。
B-R:B静脉注射 70 mg/m2,D1~2;R静脉注射C1 D1,375 mg/m2 ;500 mg/m2 C2~6 D1。
研究终点
主要研究终点:PFS
次要研究终点:ORR,总生存(OS)、持续缓解(DOR)和安全性
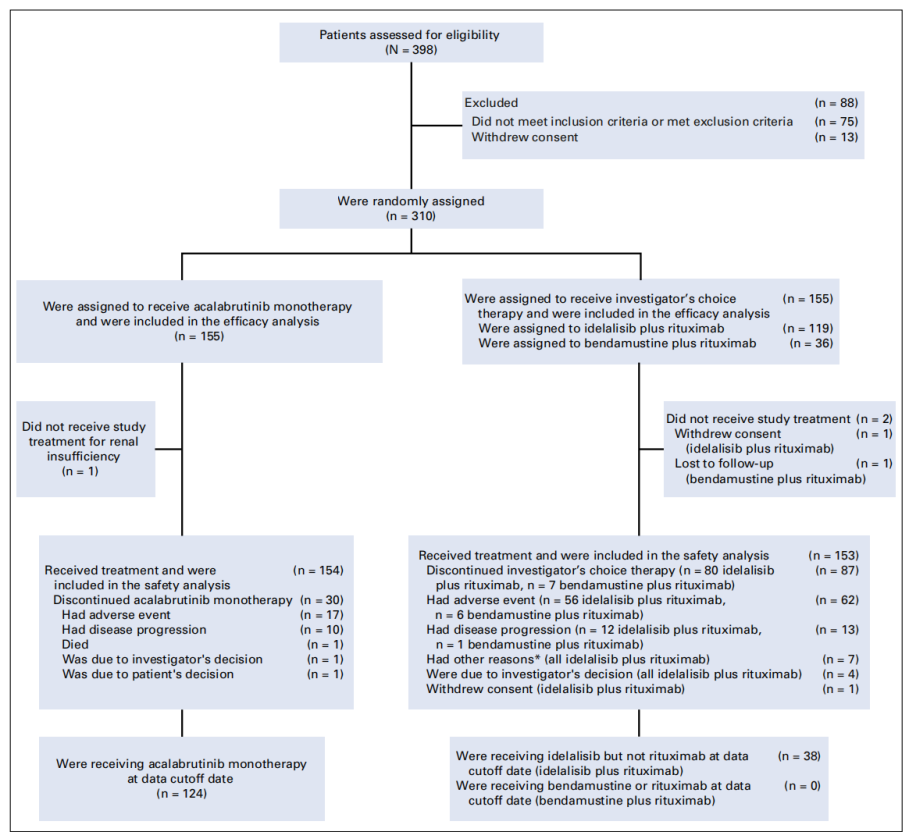
图1 研究设计
研究结果
人群特征
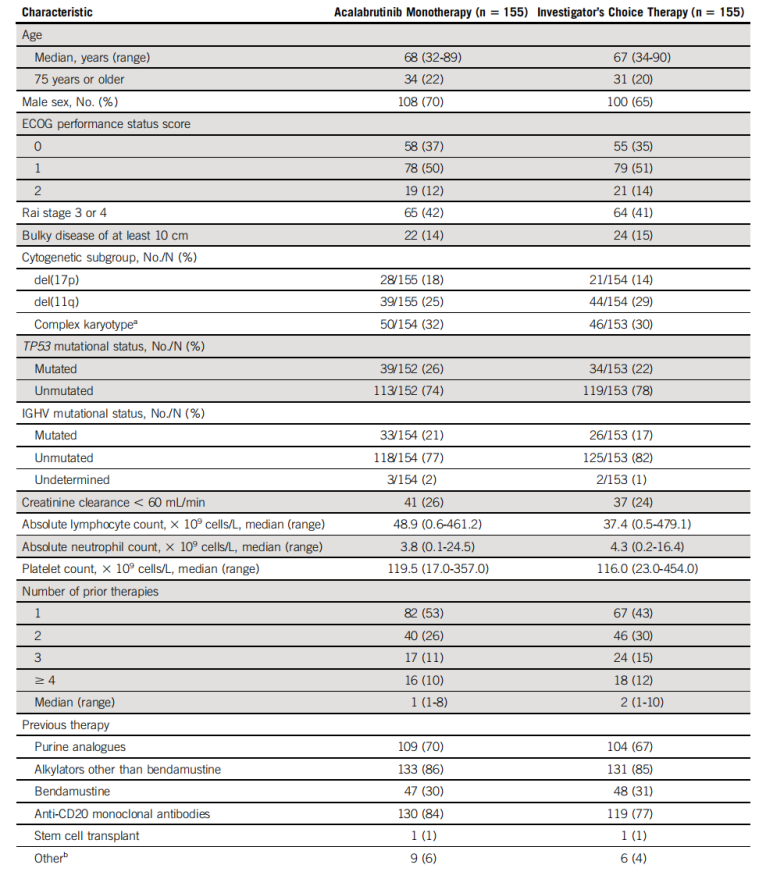
2017年2月21日至2018年1月17日,研究对398例患者进行了资格评估,其中310例患者入组,随机分配至Acalabrutinib单药组(n=155),或研究者分配的I-R组(n=119)和B-R组(n=36)。患者的年龄结构和疾病特征是均衡的,中位年龄为69岁(32~90岁);243例患者(78%)无IGHV 基因突变,49例患者(16%)为del(17p),73例患者存在TP53 突变;患者的中位治疗线数为1(1~8)。
表1 患者基线特征
疗效性
中位随访16.1个月(0.03~22.4个月)后,Acalabrutinib组的128例患者以及研究者选择组的87例患者没有出现疾病进展。Acalabrutinib单药组患者的PFS显著高于研究者选择组(16.5个月[95% CI, 14.0 ~17.1个月]; HR , 0.31 [95% CI, 0.20 ~ 0.49]; P <0.0001)。Acalabrutinib单药治疗将患者的疾病进展或死亡风险降低至69%。Acalabrutinib单药组及研究者选择组,预估1年的PFS分别为88%(95% CI, 81%~92%)和68%(95% CI, 59%~75%)。
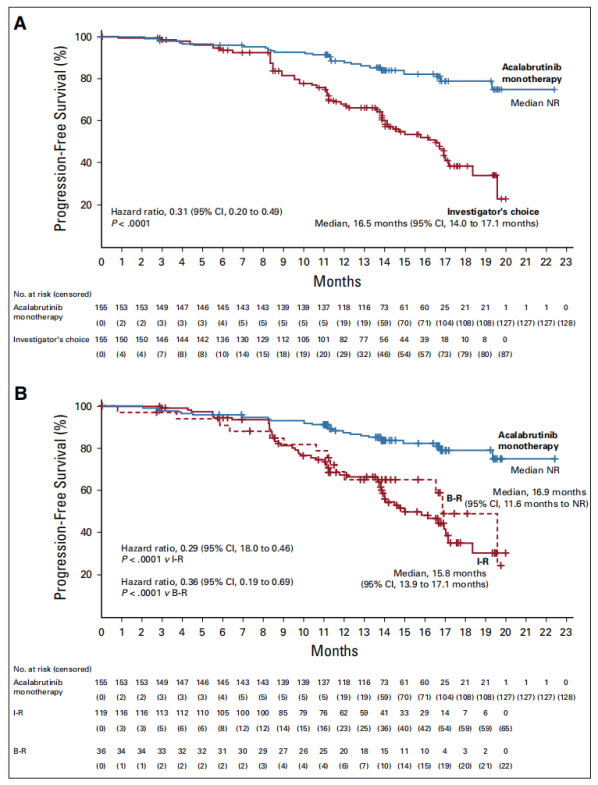

图2 主要研究终点
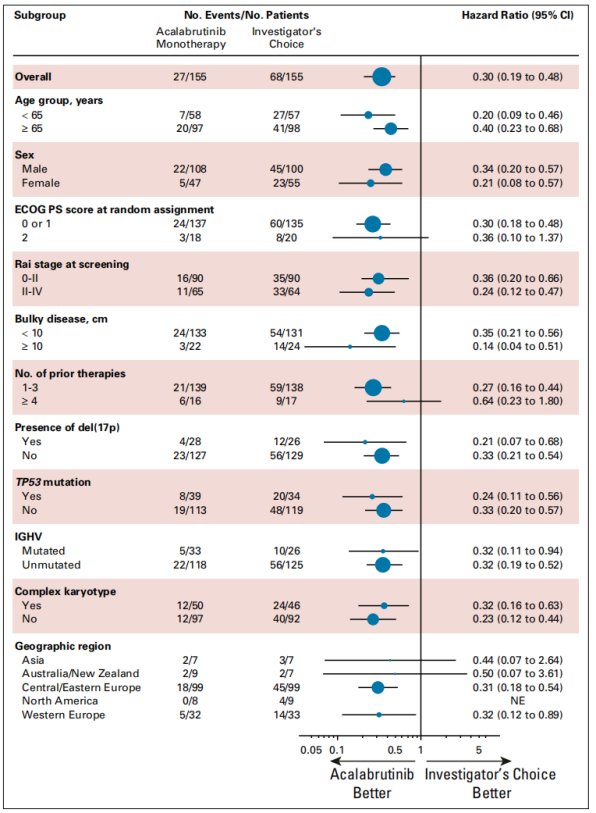
Acalabrutinib单药治疗,在包括存在del(17p) +TP53 突变、del(11q) 或者无IGHV 突变的高危人群在内的所有亚组中,均可显著改善患者的中位PFS。在Acalabrutinib单药治疗组的155例患者中,有4例患者发生Richter转变,另有5例患者接受研究者选择的治疗。
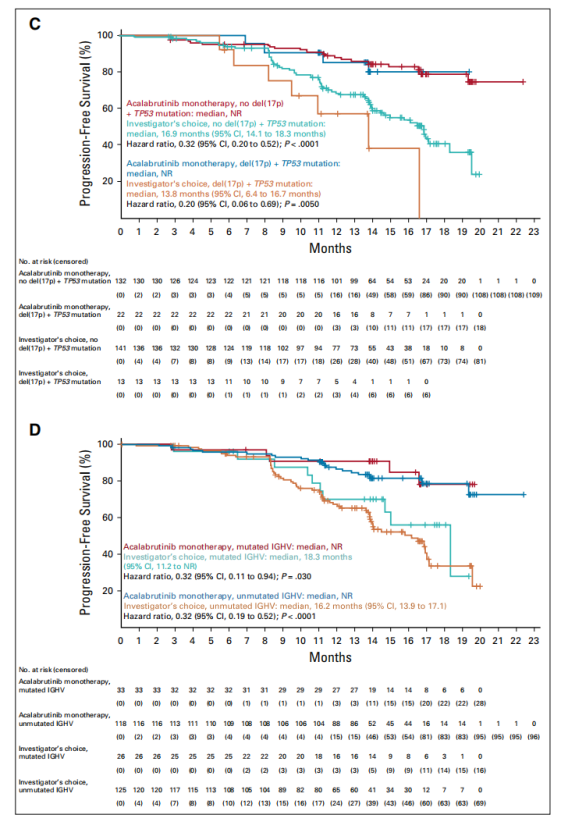
图3 PFS 亚组分析结果
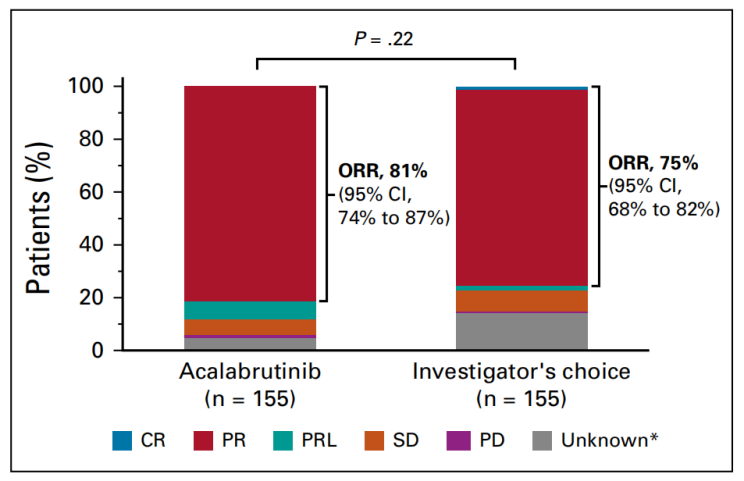
Acalabrutinib单药组与研究者选择组的ORR结果相似,分别为n=126/155; 81% vs n=117/155; 75%。Acalabrutinib单药组中位DOR未达到,研究者选择组结果为,13.6个月(95% CI, 11.9个月~NR),HR, 0.33; 95% CI, 0.19~0.59; P<0.0001。两组患者的中位OS均未达到,Acalabrutinib单药组1年时的OS为 94%(95% CI, 89%~97%),而研究者选择组为91%(95% CI, 85%~94%)。
安全性
常见的不良反应(发生率≥20%)为Acalabrutinib单药组患者头痛;I-R组患者腹泻和中性粒细胞减少;以及B-R组患者中性粒细胞减少、输液相关反应、疲劳和恶心。I-R组3~4级不良反应发生率较高,为86%,Acalabrutinib单药组和B-R组分别为45%和43%。
Acalabrutinib单药组严重不良事件的发生率为29%(44/154),I-R组为56%(n= 66 /118),B-R组为26%(n=9/35)。 Acalabrutinib单药、I-R、和B-R三组死亡事件的发生率分别为 10%(n=15 /154), 11%(n=13/118), and 14%(n=5/35)。
表2 不良事件
研究结论
该III期研究结果提示,与I-R或B-R治疗相比,Acalabrutinib单药治疗显著提高了R/R CLL患者的PFS,并且具有可耐受的安全性。这些研究结果表明,Acalabrutinib是治疗R/R CLL患者(包括部分高危患者)的有效手段,并支持了Acalabrutinib在FDA的获批。
参考文献
Ghia Paolo,Pluta Andrzej,Wach Malgorzata et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J. Clin. Oncol., 2020, 38: 2849-2861.
责任编辑:Flora
排版编辑:Flora