姜达教授 纳米抗体 方兴未艾 未来可期!
20年前,偶然发现骆驼(科)动物体内存在天然的缺失轻链的重链抗体,克隆其可变区可以得到只有重链可变区组成的单域抗原结合片段,称为VHH(Variable domain of heavy chain of heavy chain antibody),也称为纳米抗体(nanobody, a single domain antibody)(Figure1)。
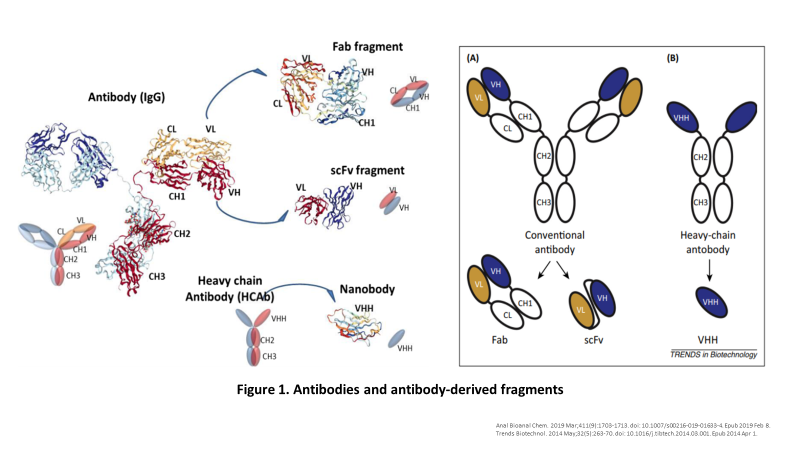
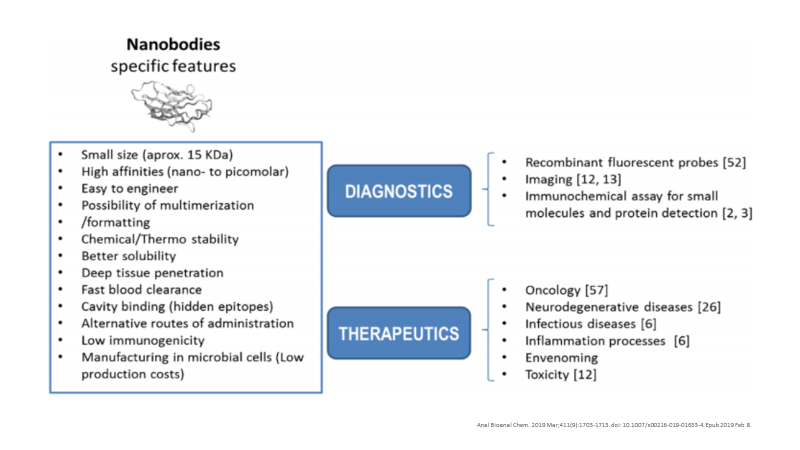
这些VHH域是已知的最小的抗原结合抗体片段。Nbs很容易在原核或真核宿主生物中产生,其出色的理化特性和药理特性(分子大小,溶解度,亲和力,特异性,稳定性等 )、人源化的可能性、独特的抗原识别特性以及成本效益等方面的优势,使得这些分子自然成为药物开发的理想候选者(Figure 2 )。
2018年全球首个纳米抗体Caplacizumab在欧盟获批上市用于治疗获得性血栓性血小板减少性紫癜(aTTP)的成人患者,标志着将Nbs开发成药的概念已在临床上得到验证。
一、mAb
在过去30多年的时间里,人们应用单克隆抗体(mAb)开发靶向抗肿瘤药物取得了很大的成功。但诸多固有的问题也在很大程度上限制了mAb推广使用。
1.生物大分子(150 kDa),结构中携带四个多肽链,限制了mAb的组织和/或肿瘤渗透和生物分布;其通常具有平坦的表面,也意味着mAb不能很好地结合在抗原表面的沟槽或空洞中。
2.生产困难且生产成本高。mAb是大型多聚体蛋白质,通常会进行翻译后修饰,因此,其生产需依赖真核生物所特有的复杂系统来完成。此外,为了达到临床功效,常常必须大剂量给药;这意味着需要使用非常大型的哺乳动物细胞培养物以及较长时间的筛选和纯化步骤,从而导致生产成本昂贵并限制了其作为治疗药物的生产。
3.自身所引发的免疫反应中和其活性,甚至会限制嵌合/人源化mAb的长期使用。
4.mAb通常具有数天的半衰期,强烈的背景信号也限制了它们在分子成像中的应用。
得益于分子生物学领域的重大进步和许多高通量技术的出现,加上其自身的理化特性和合理的价格,Nbs是临床肿瘤诊断和治疗为目的的一种真正有利的替代方法。与传统的mAb相比,Nbs的缺陷相对较少。
二、Nbs
1.Nbs具有强而快速的组织渗透,有利于进入实体瘤中或穿透血脑屏障发挥作用。而快速的血液清除也使Nbs具有优势,避免了毒性作用。Nbs通常会结合到Ag裂隙和隐藏的表位中,也解释了Nbs结合并中和难以被传统mAb击中的靶标的能力。
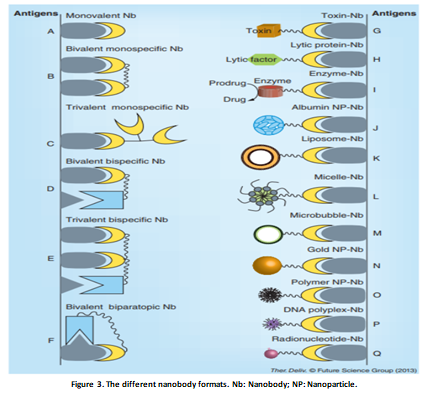
2.Nbs比常规IgG(150 kDa)或其相应的Fab片段(55 kDa)或scFv(28 kDa)小(15 kDa),结构简单,易于进行基因操作,从而形成单价、双价、双特异及多价抗体,同时也能形成融合蛋白进行靶向治疗(Figure 3)。通过基因改造,Nbs形成的多聚体大大提高了抗体与抗原的结合能力。Nbs融合蛋白可以携带酶或者毒素;融合蛋白在组织穿透、清除速度及稳定性上比普通抗体更有优势,可以用于低浓度抗原的检测。
3.Nbs仅有一个结构域,不含传统的连接肽序列。除了域内保守的二硫键,VHH CDR3中的CYS还可以与CDR1或FR2中的CYS形成二硫键,这些增加的序列和loop结构扩大了抗体与抗原结合的面积以及抗体的多样性。Nbs兼具耐热(37°C下1周后仍保持完整的结合能力)、蛋白水解抗性和高溶解度等更好的稳定性也使得其适用于替代的给药途径(即口服给药)。
4.Nbs没有传统的Fc段,从而避免了Fc段引起的补体反应;结构中缺乏轻链,使其免疫原性低;加之骆驼科动物的VHH结构域与人VH结构域具有高度的同源性,这意味着迄今为止Nbs尚未显示出任何意外的免疫原性反应。
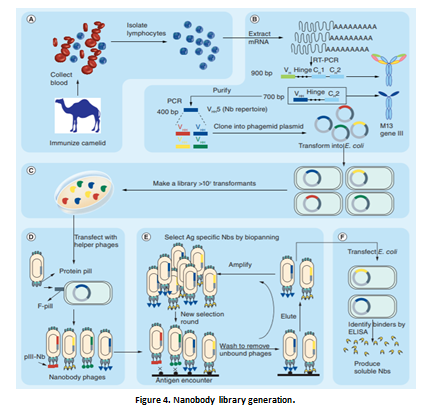
5.Nbs还是解决mAb生产成本问题的一个不错选择。Nbs的获得既遵循许多与传统mAb生产相同的方法,也有传统抗体所不具备的独特优势,如改进的筛选、分离技术,以及不需要牺牲动物个体等(Figure 4)。Nbs很容易地在微生物系统(例如细菌,酵母,真菌)中表达,并可完全恢复免疫特异性;借助成熟的测序技术、高通量筛选,大大提高了生产和选择优势,进一步降低了制造成本。
三、KN035
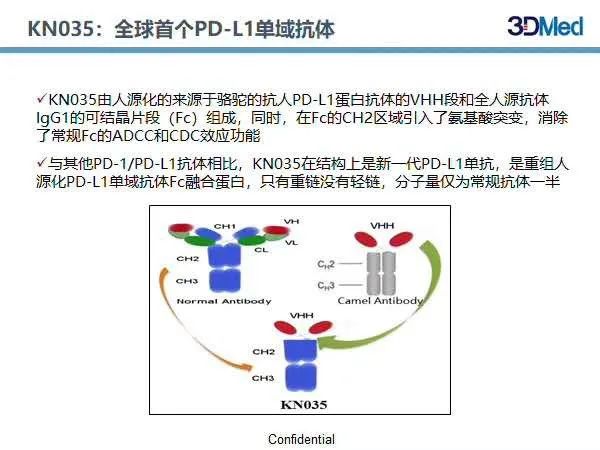
KN035系全球首个PD-L1单域抗体,由人源化的来源于骆驼的抗人PD-L1蛋白抗体的VHH段和全人源抗体IgG1 的可结晶片段(Fc)组成,同时,在Fc的CH2区域引入了氨基酸突变,消除了常规Fc的ADCC和CDC效应功能。其分子量也仅为常规抗体的一半。
KN035-CN-005项目为针对一线不能手术的胆道癌患者的随机、开放、平行对照、多中心III期临床试验,实验组为KN035联合吉西他滨和奥沙利铂(对比吉西他滨和奥沙利铂)。

河北省肿瘤内科诊疗中心自2018年7月31日启动该项目以来,一共筛选12例,成功入组10例,试验组及对照组各5例。截至目前,有9例患者达到PFS,7例患者达到OS。试验组较对照组中位PFS及OS均有所延长,疾病控制率明显增加。发生不良反应均为化疗相关不良反应,未见明显免疫治疗相关不良反应。实践告诉我们,纳米抗体方兴未艾,未来可期!