国际腹膜癌治疗指南 肿瘤细胞减灭术加腹腔化疗临床路径
摘要
腹膜癌是一种预后较差的恶性肿瘤,肿瘤来源较广泛,开展规范化治疗对腹膜癌患者至关重要。腹膜表面肿瘤协作组国际联盟(Peritoneal Surface Oncology Group International,PSOGI)制订了腹膜癌临床指南,本文为国际腹膜癌治疗指南中文版,该指南共分四部分:术前评估、腹膜癌手术、腹膜癌化疗及临床路径。其中,术前评估主要包括术前CT检查、预后评估模型、诊断性腹腔镜探查、腹膜癌指数及细胞减灭程度评分;腹膜癌治疗原则是以肿瘤细胞减灭术(cytoreductive surgery,CRS)和围手术期化疗为核心的综合治疗,但完全CRS是患者获得长期生存的关键;腹膜癌化疗主要包括围手术期化疗及区域性化疗。最后,本指南概述了腹膜癌的临床路径。经PSOGI执行委员会秘书长许可,发表该指南中文版。
前言
近三十年来,来源于胃肠道恶性肿瘤和妇科恶性肿瘤腹膜转移的治疗得到持续进展。以“手术为中心的整合治疗”新模式,即全腹膜切除术联合脏器切除的肿瘤细胞减灭术(cytoreductive surgery,CRS)加围手术期腹腔内化疗,将腹膜癌从不治之症变为可治之症,部分甚至可临床治愈,围手术期严重不良事件率和死亡率大幅度下降,其中腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)应用最广泛。
为规范并推广以CRS+HIPEC为核心的整合治疗策略,腹膜表面肿瘤协作组国际联盟(Peritoneal Sur⁃ face Oncology Group International,PSOGI)制订该临床指南,该指南主要从术前评估、腹膜癌手术、腹膜癌化疗、临床路径等四个方面进行推荐。
01 术前评估
客观评价腹膜癌术前和术中评估方法,根据其应用情况和可靠性评估做出推荐。
1.1 术前CT检查
CRS+HIPEC术前常规行CT或MRI检查,非黏液性癌可选择PET-CT检查。术前CT用于评估全身转移和腹膜转移情况,包括腹膜转移的部位及大小,称CT-PCI。
病变大小影响CT敏感性,因此CT-PCI常低于临床PCI评分。Koh等[1]发现,CT对 < 0.5 cm病变敏感性为11%,对0.5~5 cm病变敏感性为37%,>5 cm病变敏感性为94%。
术前明确CT影像学特征,有助于筛选完全肿瘤细胞减灭术者。表 1为关键影像学特征[2],单个不良影像学特征与不可切除性无相关,但影响转归[3]。关键影像学特征≥2个,无法完全肿瘤细胞减灭。

表 1 根据术前CT关键影像学特征评估腹膜癌预后
1.2 预后评估模型
Pelz等[4]提出了腹膜表面肿瘤严重程度评分(简称PSDSS),对临床症状、CT-PCI和原发肿瘤组织学进行指趾加权评分,得分2~22分,评估CRS+HIPEC预期疗效(表 2)。
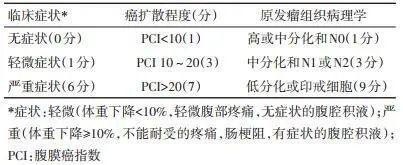
表 2 预后评估模型-腹膜表面肿瘤严重程度评分(PSDSS)[4]
1.3 诊断性腹腔镜探查
影像学对 < 1 cm的肿瘤结节或浸润内脏周围瘢痕组织中的癌组织的诊断准确性差。影像学检查常低估腹膜癌程度和部位,且不能提供组织学诊断。Pasqual等[5]发现,术前CT或FDG-PET/CT检查,腹膜癌漏诊率分别为9%和17%。术前腹腔镜可在直视下评估壁层和脏层腹膜,排除因范围广或肿瘤在关键部位而不能手术者,避免不必要的剖腹探查。
结直肠癌腹膜癌的腹腔镜探查适应证:一般状态差,高龄,难以完全减灭肿瘤细胞。腹腔镜探查小肠及系膜未受侵患者可行手术,多部位小肠受侵和/或肝门部受侵者不推荐手术。腹腔镜探查频率最高的是既往出现腹膜结节或细胞学检查阳性的亚临床胃癌,根据患者对新辅助化疗的敏感程度,决定是否联合HIPEC,若无腹膜转移或PCI < 6分,可行胃切除术+腹膜切除术+HIPEC。
1.4 腹膜癌指数
PCI用以评估腹膜表面肿瘤大小和分布范围(图 1)。根据病灶大小(lesion size,LS)制定标准:LS-0无肉眼可见肿瘤种植结节;LS-1肿瘤结节 < 0.5 cm;LS- 2肿瘤结节0.5~5 cm;LS-3肿瘤结节>5 cm;肿瘤融合或成片,评分LS-3。检查腹盆腔13个分区,每个分区确定一个LS评分,评估腹膜肿瘤分布情况。PCI评分为腹盆腔13个分区LS总和,最大分值39分[5]。
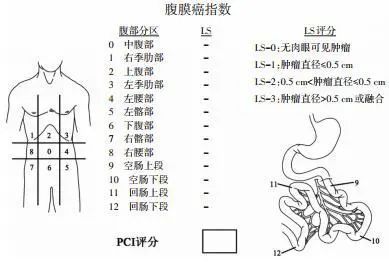
图 1 肿瘤大小和分布情况决定PCI评分值,病灶大小用于量化腹膜瘤结节大小[5]
1.5 细胞减灭程度评分
细胞减灭程度(completeness of cytoreduction,CC)评估腹膜癌预后[6]。阑尾黏液性肿瘤,CC评分:CC-0指CRS后无可见腹膜播散;CC-1指CRS后有 < 2.5 mm肿瘤结节残留,腹腔化疗药物可渗透入肿瘤结节,亦认为是完全肿瘤细胞减灭;CC-2指残余肿瘤结节2.5 mm~2.5 cm之间;CC-3指残余肿瘤结节> 2.5 cm,或腹盆腔内残余不可切除肿瘤结节或融合病灶。CC-2和CC-3为不完全肿瘤细胞减灭。高级别非黏液性肿瘤标准更严格,完全肿瘤细胞减灭仅包括CRS后无肉眼可见肿瘤。
02 腹膜癌手术
腹膜癌治疗原则是以CRS和围手术期化疗为核心的整合治疗。完全CRS是患者长期生存的关键,需完成五大区域腹膜切除术[7]。完全切除肿瘤所涉及脏器及腹膜切除术见表 3。
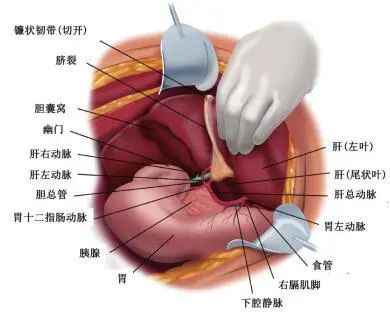
表 3 实现完全肿瘤细胞减灭所需腹膜及脏器切除
2.1 腹膜切除术理论基础
受侵腹膜区域剥除,可实现肉眼无瘤,仅残留微转移灶。孤立肿瘤结节可以电刀局部切除;脏层腹膜受侵,常需联合切除部分胃、小肠或结直肠;腹膜或肠管表面覆盖成片的肿瘤可行腹膜切除或联合肠切除。
2.1.1 腹膜癌累及部位 腹膜转移癌,尤其是黏液性腹膜转移癌,常大量存在于肠管固定于后腹膜的三个特定区域,这些部位的脏层腹膜活动度小[8]。盆腔受侵时,常侵及直肠-乙状结肠。盆腔腹膜切除术需剥离盆腔侧壁腹膜、膀胱表面腹膜、道格拉斯窝,切除部分直肠-乙状结肠;回盲部活动度较局限,常因肿瘤侵及而需切除末段回肠及右半结肠;胃窦部在幽门处固定于后腹膜,癌细胞通过文氏孔在幽门下间隙聚集,导致胃流出道梗阻型肠梗阻[9],当小网膜和幽门下间隙的肿瘤融合时,为了达到完全肿瘤细胞减灭,需行全胃切除术。
2.1.2 电烧灼汽化手术 腹膜切除术必须使用电外科设备[10]。腹膜切除和脏层腹膜切除过程中,高压电外科设备在剥离面边缘形成无肿瘤热坏死区域,可最大化减灭肿瘤并减少出血。
2.1.3 腹腔化疗 单纯广泛肿瘤切除术不联合腹腔化疗,会造成腹盆腔腹膜大量种植,并不能延长患者生存期,反而会产生更多损害。肿瘤进展会引起关键结构如输尿管或胆总管梗阻,并进一步侵及盆壁及盆腔血管周围组织结构。因此,当外科医生尝试对腹膜癌患者进行治疗时,必须熟练掌握术中化疗技术。
2.2 腹膜切除步骤及脏器切除
体位及开腹:手术过程中,患者取仰卧位,臀沟位于手术台最下缘,保护双腿,避免腓肠肌坏死。腹部皮肤准备范围为胸中部至股中区(双乳连线水平以下,两侧大腿中上>1/3)。男性外阴部、女性阴道准备。放置Foley导尿管、18号硅胶鼻胃管。腹正中切口,上至剑突下,下至耻骨联合,切除既往手术瘢痕,常规切除脐部,有意愿保留时可重建。粗线将皮肤边缘悬吊于自固定牵开器上,牵引腹腔切口边缘提拉腹壁结构。用力提拉腹壁避免损伤粘连于前腹壁的肠管[11]。手持式3 mm规格的球形电刀是腹膜剥除的标准工具,模式选择为高电压纯电切。切除管道结构附近肿瘤,特别是输尿管、小肠和结肠时,小心进行电灼烧汽化手术。温盐水冷却操作部位以防止热蓄积。球形电刀纯电切时,对组织电灼烧汽化产生大量烟雾,烟雾过滤单元可保持术野清晰及无烟环境,过滤器尖端保持在在剥离界面5.1~7.6 cm位置。
剑突切除术:术前影像学提示需行膈肌腹膜切除时,应切除剑突[12]。沿腹正中切口向上延伸至剑突-胸骨结合点上方约4 cm处,切除腹直肌后鞘上的上腹部脂肪垫,用自固定牵开器暴露剑突及其与胸骨连接处。电刀逐渐分离剑突与腹直肌前后鞘以裸化剑突,同步调整自固定牵开器位置,孤立时高压电凝控制出血。当剑突充分裸化至其胸骨起始点时,用高压电刀在剑突与胸骨结合处做一横切标记线。电刀电流使剑突基底部骨中蛋白质变性,沿此线向下按压,剑突会在较小按压力度下沿着标记线精确断裂。胸骨上切除剑突后,Kocher钳夹住其根部,切开其与膈肌间连接,将其从下面组织剥离。剥离膈肌表面腹膜要避免进入左侧胸腔或心包腔。
完全前腹壁腹膜切除术:腹膜从腹直肌后鞘上剥离后,在上腹部切口下腹膜上打开一个进入腹腔的小口(腹膜窗),便于完全前壁腹膜切除术。若前壁腹膜上触及肿瘤结节,完全腹膜剥离实现完全肿瘤细胞减灭。若未侵犯壁腹膜,则保留大部分腹膜。
根据手术进度调整自固定牵开器位置,使其在剥离点处提供腹膜与其下方组织间的最大张力。球形电刀剥离操作全程使用烟雾过滤单元[13]。当腹膜剥离至腹横肌正上方遇粘连时,可从上下方位分别向粘连部剥离,以完成本区域腹膜切除术。壁腹膜剥离范围上至左右膈肌表面腹膜,下至全盆腔腹膜。当剥离界面达结肠旁沟(Toldt's线)时,腹膜下有疏松结缔组织,剥离速度加快。
粘连松解术:腹膜和脏器切除术前,需松解腹腔粘连,并尽可能切除粘连组织送病理检查。浸润至手术瘢痕的肿瘤细胞,不易被化疗清除[14]。这种肿瘤细胞种植于既往手术解剖区域的机制为“肿瘤细胞包裹学说”。
左膈下腹膜切除术:腹膜切除术时,用自固定牵开器辅助牵拉,暴露腹部区域。从腹直肌后鞘剥离上腹部脂肪垫和腹部切口边缘腹膜。牵拉肿瘤组织将其从膈肌、左肾上腺及上半部肾周脂肪囊剥离。沿Toldt's线剥离腹膜,将结肠脾曲从左侧结肠旁沟处与腹壁分离,移至腹腔中部。球形电刀剥离膈肌表面腹膜,剥离前须将此处血管电凝。球形电刀(单纯电切模式)剥离平面,切断前对所有血管电凝。
左膈肌腹膜切除术:左上腹腹膜切除术后,胃移向中间位置,显露出被结扎的胃网膜动脉分支、左肾上腺、胰尾、左肾周脂肪囊及横结肠系膜前叶。避开胃左右动静脉,保护胃供血血管。
大网膜切除术及脾切除术:提拉大网膜,用电刀从横结肠表面剥离,剥离平面保持在横结肠系膜前叶,显露胰腺下缘。逐步结扎并切断胃网膜与胃大弯之间血管分支。左上腹腹膜切除术完成后,垫起左侧膈肌下方深部组织,直视下离断胃短血管。轻度牵拉脾脏,电刀或钝性剥离胰腺被膜,胰腺被膜若无肿瘤则完整保留。胰尾部有脾动静脉,手术时应注意保护胰体或胰尾。
右膈下腹膜切除术:从右侧腹直肌后鞘剥离腹正中切口附近的腹膜,开始进行右上腹腹膜切除术。用力牵拉膈肌组织,将膈肌提拉至手术区域。在肿瘤与正常组织中间以球形电刀(单纯电切模式)操作,电凝处理显露出的血管。
剥离Glisson被膜表面肿瘤:持续剥离右膈肌表面腹膜至肝裸区。电烧灼汽化肝脏表面肿瘤,至无肉眼肿瘤残留。球形电刀(高电压,单纯电切模式)在Glisson被膜下剥离厚层肿瘤组织。用电刀远端2 cm球形弯头对肝脏表面孤立性结节灼烧剥离。同样方法切除镰状韧带和肝圆韧带肿瘤。
右膈下腹膜切除术完成后操作:自固定牵开器用力向上牵拉右侧肋缘,向内侧推动肝右叶,可见右膈下腹膜切除术后结构。膈肌表面可见保留的膈动静脉前支,下方可见肝右静脉和下腔静脉。右肝下包括右侧肾上腺、右肾周脂肪囊等组成剥离面底部。当肿瘤粘连于左右膈肌中心腱时,切除受侵组织,在膈肌上做椭圆形部分切除,间断缝合膈肌缺损;该修补术在胸腔和HIPEC术后进行。
小网膜切除术、胆囊切除术及肝十二指肠韧带剥离术:自胆囊基底部起游离胆囊,断扎胆囊动脉和胆囊管[15]。肝十二指肠韧带常受侵,肝下方腹膜返折剥离后,用俄罗斯钳将包裹在肝门附近肿瘤组织从胆囊床基底部向十二指肠方向钝性分离,注意保护胃右动脉。从肝1段与肝2、3段分隔的裂隙继续分离肝胃韧带,切除小网膜,以球形电刀电烧灼汽化尾状突表面肿瘤。尾状突部分供血血管走形于该肝段表面,表浅损伤亦也出血。副肝左动脉可起源于胃左动脉并走形于肝胃间隙,应注意保护。当副肝左动脉被肿瘤包裹或影响网膜囊暴露时,可将其自进入肝实质处结扎,与肝胃韧带一并切除。
手指辅助环行切除肝胃韧带及小网膜脂肪:左膈肌腹膜切除时,游离三角韧带后,肝左外侧段会自左向右回缩,完整显露肝胃韧带。沿肝2、3段裂隙、左侧尾状叶及胃小弯侧胃右动脉到胃左动脉环形切除小网膜。电刀将腹膜从胃小弯剥离后,手指辅助操作,拇指和食指将小网膜脂肪及肿瘤从血管弓分离,尽可能保留迷走神经前支。将围绕胃左右动脉的肿瘤和脂肪组织从血管弓上剥离。采用上述方式,标本会集中在胃左动脉的主要分支。用力牵拉组织,将小网膜从胃左动静脉上剥离。
剥离网膜囊底:“S”形拉钩辅助或助手手指牵拉左尾状叶下方以显露网膜囊底。电烧灼汽化左尾状叶尾状突表面肿瘤以显露术野。球形电刀剥离肝左侧下方、下腔静脉旁腹膜返折。以俄罗斯钳从右侧膈肌脚和门静脉下方钝性剥离网膜囊上隐窝。电烧灼汽化位于门静脉后方连接尾状叶左右面的肝实质表面肿瘤。剥离网膜囊底时,将剥离层面保持在右膈动脉表面上方。
部分患者肝十二指肠韧带后方肿瘤显露困难,可于第一肝门周围放置0.5英寸规格烟卷引流管以改善下方视野,或用俄罗斯钳钳除肝门下方腹膜组织。
肿瘤聚集在肝十二指肠韧带后侧时,难以完全切除。采用Kocher手法显示肝十二指肠韧带后方并切除此处腹膜转移灶。分离十二指肠和胰头与后腹膜的粘连,使其与肝门结构顺时针旋转,清除肝十二指肠韧带后侧部位[16]。完整切除胆囊、肝十二指肠韧带、肝胃韧带及网膜囊底后示意图见图 2。
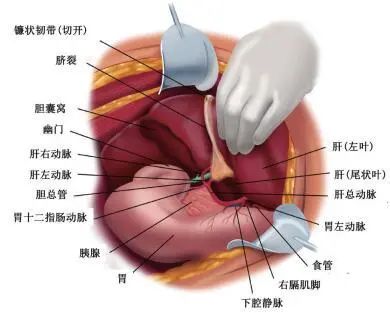
图 2 网膜囊底部及胰体表面腹膜剥离完成后示意图[6]
肠系膜腹膜切除术:壁腹膜切除技术在反复实践中效果良好[6]。部分腹膜转移癌,常累及脏层腹膜。当脏层腹膜肿瘤侵及系膜血管时,应联合脏器切除以达完全肿瘤细胞减灭。小肠系膜受侵,但未侵及血管,可行系膜腹膜切除术。Deraco等[17]介绍该方法常用于腹膜间皮瘤。自小肠系膜根部开始,电刀剥离和钝性剥离相结合,至小肠表面腹膜返折处。当腹膜转移癌侵及升结肠、横结肠或降结肠时,保留回结肠血管、结肠中血管或左结肠血管,切除病灶;侵及直-乙状结肠或直肠时,完整切除病灶后再行降结肠-直肠中段或乙状结肠-直肠中段肠吻合。
沿肝圆韧带剥离肝桥细胞减灭术:肝圆韧带是肝左外侧段和肝4段表面分界标志结构。肝圆韧带裂隙表面肝组织大小因人而异,有的裂隙完全开放,肝圆韧带暴露,直至进入肝脏;有的裂隙上有一道肝实质组成的“肝桥”。肝桥肝实质厚度及肝圆韧带暴露程度因人而异。图 3为CRS时覆盖于肝圆韧带上的肝桥。肝桥中形成一条围绕肝圆韧带通道,内表面为腹膜结构,有肿瘤种植风险。球形电刀(高压模式)切开肝圆韧带上方肝实质探查此通道表面腹膜情况[18]。电烧灼汽化裂隙中肿瘤,剥离其表面腹膜。
图 3 完整肝桥示意图[18]
肝桥通道内表面行腹膜切除术时,避免损伤肝左动脉或肝左动脉分支。切开肝桥后,可在直视下切除肝圆韧带裂隙内肿瘤,以实现完全肿瘤细胞减灭术。
完全盆腔腹膜切除术:沿下腹部切口向下剥离盆底腹膜,显露腹直肌,广泛分离膀胱两侧腹膜后,孤立显露脐正中韧带,使用器械广泛牵拉已经剥离的前壁腹膜使其展开形成平面,同时使用生理盐水冲洗剥离界面,以便精确分离膀胱肌肉组织和附着其上腹膜及脂肪组织,向下剥离至女性子宫颈或男性精囊腺。于结肠旁沟腹膜交界处切开盆腔腹膜,于腹股沟管内环口段结扎女性子宫圆韧带,注意分离保护两侧输尿管,孤立显露并于肾下极水平结扎切断卵巢血管。于盆腔肿瘤上方以直线切割闭合器切断乙状结肠,于根部缝扎后切断肠系膜下动脉,随后便可将包括近端乙状结肠在内的全部脏器推向上腹部。
直肠-乙状结肠及道格拉斯窝切除术:使用电外科设备处理直肠系膜,由外向内、由上向下操作。于输尿管近膀胱基底部上方腹膜外结扎子宫动静脉,孤立子宫膀胱间隙,电刀切断阴道前后穹隆,显露直肠阴道隔,剔除腹膜返折以下直肠周围脂肪组织,裸化直肠壁,以切割闭合器切断直肠,可将所有盆底肿瘤完整切除。
保留直肠-乙状结肠的盆腔腹膜切除术:对于低侵袭性肿瘤或PCI评分较低的患者,可行保留部分脏器的盆腔腹膜切除术。由于直肠中部上方与腹膜之间存在一层脂肪组织,在此处进行腹膜剥除不会损伤肠管,而其他直肠-乙状结肠表面脏层腹膜附着紧密,剥离时难免损伤肠管。因此对于盆底腹膜转移较少的患者,可行保留直肠但剥离直肠表面腹膜的盆腔腹膜切除术。对于男性患者,可将腹膜从盆壁、膀胱表面及下方精囊腺表面剥离。对于女性患者,需完整切除盆腔腹膜、子宫、卵巢及道格拉斯窝表面腹膜。将切除直肠旁窝、阴道后穹隆/精囊腺及中上三分之一直肠表面腹膜称为“道格拉斯窝切除术”。图 4为保留部分脏器的盆腔腹膜切除术的示意图。
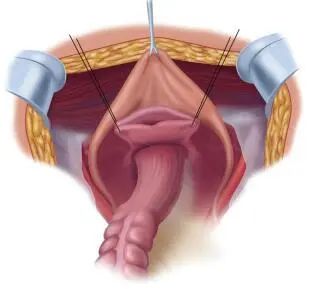
图 4 保留直-乙状结肠盆腔腹膜切除术完成示意图[19]
关闭阴道残端和低位结直肠吻合术:为避免化疗药物经阴道泄露,需在HIPEC前关闭阴道残端。但关闭阴道残端前应充分冲洗盆腔以清除肿瘤细胞,减少其包埋于阴道缝合组织中的可能。
避免行预防性回肠造口术须进行的完全盆腔腹膜切除术:道格拉斯窝腹膜切除术(女性)/膀胱直肠陷窝腹膜切除术(男性)后,从低位直肠向近端剥离直肠壁表面系膜约10~15 cm脂肪,或至肿瘤同肠壁无法分离的位置后,以切割闭合器横断直肠。近端自降结肠-乙状结肠交界处横断肠管,完成内脏切除术。HIPEC前,间断缝合关闭阴道残端。于降结肠远端置入吻合器钉砧,充分消毒直肠残端后手动扩张直肠括约肌,将吻合器探入直肠残端,在关闭直肠残端的排钉线中刺入吻合尖端。
此时通常在直肠残端排钉线侧面留置单丝缝合线,在吻合器收紧过程中,使用此单丝缝合线将直肠残端收入环形吻合器内,收紧后激发吻合器,完成环形结直肠端端吻合。盆腔注水,直肠充气检查吻合口气密性,同时检查吻合器中近远端切缘完整性。
以丝线间隔1 cm左右间断缝合加固结直肠吻合口,将吻合口排钉包埋,这一操作较困难,但非常重要,是常用预防吻合口漏的方法,吻合口后方常规放置闭式引流管。
完成低位结直肠无张力吻合所需的左结肠松解术:避免结直肠吻合口术后并发症的关键是吻合口处无张力。适当松解左半结肠系膜可降低结直肠吻合口张力:从根部结扎切断肠系膜下动脉及分支,保留系膜血管弓完整,将左半结肠及乙状结肠Y形血管弓调整成V形。肠系膜下部有静脉环绕于十二指肠周围,孤立后将其切断。自左侧肾周脂肪囊表面松解横结肠肠系膜及结肠脾曲,使降结肠-乙状结肠交界下拉至低位直肠甚至肛门水平,完成无张力吻合。术中HIPEC及术后早期腹腔化疗所需管路及引流:通常留置四根腹腔闭式引流管,分别放置于右肝下、左膈下及两侧盆腔各一根。通常将入水管放置于腹腔复发风险最高处,并于入水管和出水管管口放置温度探头,HIPEC结束后,移除温度探头,保留闭式引流管。通常放置双侧直角胸管,预防因膈下腹膜切除术产生的胸腔积液。
2.3 小肠及肠系膜的肿瘤细胞减灭术
使用电刀行壁腹膜切除术安全可行[10],但在小肠表面使用电外科设备时,可能会引起术后肠瘘;用电外科设备处理小肠系膜较为安全,对于合适病例可行小肠系膜腹膜切除术。
CRS+HIPEC广泛用于阑尾黏液性肿瘤治疗,也用于其他类型肿瘤,特别是结肠癌和弥漫性腹膜恶性间皮瘤。根据浸润程度、瘤结节大小及与肠壁解剖关系,侵犯小肠的肿瘤可分为以下五种类型[20],同类型肿瘤所采用的细胞减灭方法如下。
类型1:无浸润性结节。此类型包括因肿瘤体积较小尚未侵透浆膜的侵袭性肿瘤结节。此类型还包括播散性腹膜黏液瘤在腹膜上广泛分布的大而无浸润性的黏液结节以及核分裂1级腹膜间皮瘤结节。可使用弯组织剪处理小肠表面无浸润性结节以及肠壁浆膜。较大结节常需要使用剪刀分块切除,以避免损伤深层肠壁,此技能需一定时间训练以避免损伤肠道固有肌层。通常不需要进行浆肌层缝合修补。
类型2:小肠对系膜缘存在小浸润性结节。小肠对系膜缘上小浸润性结节无法同肠壁肌层分离,行一定厚度切除。切除浆肌层,保留黏膜和黏膜下层。弯组织剪操作,也可用电切模式电刀切除,切除时持续冲洗冷却电切部位。首选剪刀或刀片分离。行HIPEC术后,行浆肌层折叠缝合修补。
类型3:小肠对系膜缘存在中等大小浸润性结节。与小浸润性结节相比,中等大小结节需将对系膜缘肠壁全层行椭圆形切除。切除后肠壁分两层缝合,首先使用可吸收缝线全层缝合肠壁,HIPEC后使用不可吸收线间断褥式缝合加固肠壁。
类型4:小肠壁和系膜交界处存在小浸润性结节。若这些小浸润性结节位置表浅,且附近无供血血管,可使用电刀局部切除。对切除后缺损部位行双层缝合修补。结节所在部位行节段性小肠切除并进行手工端端吻合术,可降低术后肠漏等并发症发生率。
类型5:大浸润性结节。切除较大浸润性结节时,将部分小肠同其系膜组织同时切除,使用直线切割闭合器离断肠管,HIPEC后行手工端端缝吻合术。
2.4 回肠造口
对于全结肠切除术的患者,由于结肠和末段回肠的广泛切除,无法行回肠-直肠吻合,因此往往需行永久性末段回肠造口术;此外,患者如行低位结直肠吻合,则需进行末段回肠保护性造口术。若患者计划进行二次探查术,也可将近端结肠盲端保留在腹腔中部,而行末段回肠单腔造口,这是一种与Hart⁃ mann手术类似的术式。
2.5 二次探查手术加腹腔化疗
随着腹膜癌患者临床数据库的建立,患者选择标准的完善,部分结肠癌腹膜癌患者需二次探查术[21]。原发性腹膜癌,特别是间皮瘤,也可从初次术后6~9个月的二次探查术中获益。
二次探查术中,应充分暴露腹腔,松解腹膜粘连便于探查,并根据探查情况,进一步行肿瘤细胞减灭,若达CC评分1分,则再次进行HIPEC治疗。
若二次探查术显示大多数解剖区域对最初的HIPEC方案和术后早期腹腔化疗方案有效,继续用此方案。若化疗效果不佳且前期腹膜切除术区域复发,则应更换化疗方案。
03 腹膜癌化疗
3.1 围手术期化疗-腹腔热灌注化疗
经验丰富的腹膜癌治疗中心发展了多种不同的HIPEC方法用来治疗腹膜癌。梅德史塔华盛顿医疗中心应用排烟设备制造气雾屏障配合完成开放式HIPEC。在完成CRS后暂不行吻合,经腹壁放置闭式引流管,并将温度探头固定于皮肤边缘;以1号单丝缝合线缝合皮肤,牵拉缝合线升高皮肤边缘;将四个排烟器放置于腹部四个象限,防止药物气溶胶污染(图 5)。在灌注过程中翻动腹腔内脏器,消除粘连并使腹腔内受热均匀。体外加热设备将入体温度保持在42~46℃,使腹腔内药液保持41~42℃。
图 5 开放通道进行腹腔热灌注化疗,烟雾疏散系统产生蒸汽屏障[19]
HIPEC完成后,冲洗腹腔并排尽液体,再进行消化道重建,此处再次强调应在HIPEC完成后进行吻合重建,唯一例外的是,应在热灌注化疗前关闭阴道残端,以避免化疗药液渗漏。
具有开放通道的封闭HIPEC技术称Landager技术,是在HIPEC过程中使用塑料薄膜覆盖腹腔,在其表面作十字切口,将手伸入腹腔翻动脏器,将排烟器放置于塑料罩中以防止化疗气溶胶污染手术室,此法需在HIPEC前关腹,HIPEC后开腹进行吻合术。在此HIPEC技术中,包括皮肤在内的前腹壁结构均可接触到化疗药物。
还有一种全封闭的技术,在此方法中,完成CRS后直接进行肠吻合并关腹,在关腹前留置HIPEC管路,然后在手术室进行HIPEC,术后患者转入外科重症监护室治疗。表 4详细列出了开放式和闭合式HIPEC技术的特点比较。
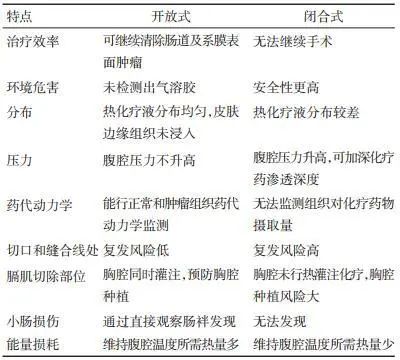
表 4 腹腔热灌注化疗两种不同技术的比较
开放式HIPEC安全性已被反复证明,在手术室环境中未检测到任何药物气溶胶。然而某些药物理论上只能在封闭式HIPEC中使用,如左旋苯丙氨酸氮芥(马法兰),它是一种易挥发的芳香化合物,中等热量下会弥散到手术室环境中。
3.2 区域性化疗
3.2.1 HIPEC方案
1)腹膜假黏液瘤、阑尾黏液腺癌和结肠癌化疗方案
丝裂霉素C方案[22-23]:
Sugarbaker方案:
a.将丝裂霉素C加入2 L 1.5%葡萄糖腹膜透析液中;
b.将多柔比星加入上述腹膜透析液中;
c.丝裂霉素C和多柔比星剂量均为15 mg/m2;
d.将5-FU(400 mg/m2)和亚叶酸钙(20 mg/m2)分别加入250 mL生理盐水并快速静脉滴注,静脉化疗与腹腔化疗同时进行。
荷兰大剂量丝裂霉素C方案:
“三重给药方案”:
a.将丝裂霉素C加入3 L 1.5%葡萄糖腹膜透析液;
b.在1.5%葡萄糖腹膜透析液中加丝裂霉素C,剂量为17.5 mg/m2,30 min后加8.8 mg/m2,60 min后加8.8 mg/m2;
c.丝裂霉素C总剂量为35 mg/m2,HIPEC治疗90 min。
美国腹膜表面恶性肿瘤协会小剂量丝裂霉素C方案:
“浓度基础方案”:
a.将丝裂霉素C加入3 L 1.5%葡萄糖腹膜透析液;
b.在1.5%葡萄糖腹膜透析液中加丝裂霉素C,剂量为30 mg/3 L,60 min后加10 mg;
c.丝裂霉素C剂量40 mg/3 L,HIPEC 90 min。奥沙利铂方案[24-25]:Elias大剂量奥沙利铂方案—开放式HIPEC:
a.将奥沙利铂加入2 L/m2 5%葡萄糖溶液;
b.奥沙利铂剂量为460 mg/m2
c.43℃、HIPEC 30 min。
d.分别在250 mL生理盐水加5-FU 400 mg/m2和亚叶酸钙20 mg/m2。腹腔化疗前1 h快速静脉滴注;
Glehen中等剂量奥沙利铂方案-封闭式HIPEC:
a.将奥沙利铂加入2 L/m2 5%葡萄糖溶液;
b.奥沙利铂剂量为360 mg/m2
c.43℃、HIPEC 30 min。
d.分别在250 mL生理盐水中加5-FU 400 mg/m2和亚叶酸钙20 mg/m2,腹腔化疗开始前1h快速静脉滴注;
维克森林大学奥沙利铂方案:
a.将奥沙利铂加入3 L 5%葡萄糖溶液;
b.奥沙利铂剂量为200 mg/m2;
c.42℃、HIPEC 2 h。
2)肉瘤、胃癌、卵巢癌和腹膜间皮瘤治疗顺铂方案[26-27]
Sugarbaker方案:
a.将顺铂加入2 L 1.5%葡萄糖腹膜透析液;
b.将阿霉素加入上述透析液;
c.顺铂剂量50 mg/m2,阿霉素15 mg/m2,HIPEC 90 min;
d.将异环磷酰胺1,300 mg/m2加入1 L 0.9%氯化钠溶液。持续静滴超过90 min,行腹腔化疗;
e.每次在100 mL 0.9%氯化钠中加入美司钠260 mg/m2,异环磷酰胺输注前15 min、4 h后、8 h后静脉滴注。
米兰国立癌症研究所方案:
a.阿霉素15.25 mg/L和顺铂43 mg/L,HIPEC 90 min;
b.4~6 L溶液腹腔灌洗。
法国HIPEC治疗卵巢癌[28-29]:
3 L 0.9%氯化钠加入顺铂80 mg,42℃、HIPEC 60 min。
Sugarbaker吉西他滨为基础方案治疗胰腺癌和顺铂耐药的卵巢癌:
a.吉西他滨加入2 L 1.5%葡萄糖腹膜透析液,总化疗液1.5 L/m2;
b.吉西他滨剂量1 000 mg/m2,HIPEC 60 min。
Sugarbaker马法兰为基础方案治疗再次CRS后顺铂耐药的卵巢癌:
a.马法兰加入2 L 1.5%葡萄糖腹膜透析液,总化疗液1.5 L/m2;
b.马法兰50~70 mg/m2,HIPEC 60 min。
Sugarbaker脂质体阿霉素方案治疗肉瘤、印戒细胞癌和顺铂耐药的卵巢癌:
a.2 L 1.5%葡萄糖腹膜透析液加入脂质体阿霉素50~100 mg/m2,总溶液量2 L;
b.HIPEC 3 h。
3.2.2 术后早期腹腔化疗
1)术后第1~4天行5-FU腹腔化疗治疗阑尾癌、结肠癌、胃癌
a.5-FU(女性400 mg/m2,男性600 mg/m2,最大剂量1 400 mg)和1.5%葡萄糖腹膜透析液中加50 mg碳酸氢钠,Tenckhoff导管连续4天腹腔灌洗;
b.体表面积≤2.0 m2,腹腔液量1 L,体表面积>2.0 m2,腹腔液量1.5 L;
c.腹腔灌注前排出所有液体后夹闭腹腔引流管;
d.化疗液通过Tenkhoff导管尽快注入腹腔,使其在腹腔内停留23 h,下一次灌注前1h排出;
e.利用重力使5-FU在腹腔内分布最大化,右侧卧位时将化疗药完全注入,30 min后,患者左侧卧位,每30 min转换体位,灌注化疗6 h继续转换体位;
f.腹腔灌注化疗前6 h脉搏血氧计监测;
g.持续腹腔引流,直到移除Tenkhoff导管。
2)术后第1~5天紫杉醇腹腔灌注治疗腹膜间皮瘤和卵巢癌
a.紫杉醇(20~40 mg/m2、最大剂量80 mg)+1 000 mL 6%羟乙基淀粉,Tenckhoff导管腹腔灌注;
b.Tenckhoff导管中尽快注入化疗药,腹腔内保留23 h,下一次灌注前1 h从Jackson-Pratt导管排出;
c.化疗最初6 h,患者水平位,灌注时右侧卧位,灌注完成30 min后转向左侧,每30 min转换体位,持续6 h;
d.腹腔化疗前6h脉搏血氧计监测;
e.最后一次腹腔化疗后,以Jackson-Pratt导管腹腔引流。
3.2.3 双向辅助常温化疗(BANC)
1)腹腔灌注5-氟尿嘧啶与静脉注射奥沙利铂
a.5-FU(600 mg/m2、最大剂量1 400 mg),1 000 mL 1.5%葡萄糖腹膜透析液中加入50 mg碳酸氢钠;
b.尽快腹腔注射,化疗药物腹腔滞留24 h;
c.化疗最初6 h,患者保持水平,灌注时右侧卧位,30 min后转向左侧,每30 min转换体位,持续6 h;
d.腹腔化疗前6 h脉搏血氧计监测;
e.5-FU腹腔灌注2 h,250 mL D5W溶液加入奥沙利铂(130 mg/m2),静滴。
2)腹腔灌注5-FU与静脉注射丝裂霉素C
a.5- FU(600 mg/m2、最大剂量1 400 mg),1 L 1.5%葡萄糖腹膜透析液加50 mg碳酸氢钠;
b.尽快腹腔注射,化疗药腹腔滞留24 h;
c.化疗最初6 h,患者保持水平,灌注时右侧卧位,30 min后转向左侧,每30 min转换体位,持续6 h;
d.腹腔化疗前6 h脉搏血氧计监测;
e.化疗6 h后取下静脉加压靴,便于转换体位;
f.5-FU腹腔灌注2 h,250 mL D5W溶液加入丝裂霉素C(10 mg/m2),静滴。
3)腹腔灌注培美曲塞联合静脉注射顺铂治疗腹膜间皮瘤
a.叶酸1 mg/d,第1次给药前1~3周口服,停药后继续口服1~3周;
b.维生素B12 1 000 μg,第一次注射培美曲塞前1~3周内肌肉注射,每9周重复一次,直到停用培美曲塞;
c.化疗前2 h将大口径导管植入外周静脉;
d.200 mL/h静滴D5W生理盐水;
e.培美曲塞(500 mg/m2)加入1 000 mL 1.5%葡萄糖腹膜透析液,60 min腹腔化疗泵快速灌注;
f.培美曲塞静滴30 min,静滴甘露醇12.5 g+100 mL生理盐水,15 min;
g.培美曲塞静滴60 min,静滴顺铂(75 mg/m2)+ 250 mL生理盐水,120 min。
4)改良GOG 172、Armstrong方案治疗Ⅲ期卵巢癌最佳减瘤术后
a.静脉注射紫杉醇135 mg/m2;
b.腹腔灌注顺铂75 mg/m2+1 L生理盐水+可耐受生理盐水;
c.腹腔灌注紫杉醇80 mg/m2+1 L生理盐水+可耐受生理盐水;
d.每3周重复一次,共6个周期。
3.2.4 单药腹腔辅助化疗[30-31]
1)Sugarbaker吉西他滨方案治疗胰腺癌、胆囊癌、肝内胆管癌切除术后
a.吉西他滨加入1 L 1.5%葡萄糖腹膜透析液;
b.吉西他滨剂量1 000 mg/m2;
c.以1 L/h的速度腹腔灌注;
d.第1、8和15天重复灌注,每28天为1个周期,共6个周期。
2)Kelsen氟脲苷方案(FUDR)治疗结肠癌和复发性卵巢癌
a.FUDR 1 000 mg/m2/d+1 L生理盐水,连续3天腹腔化疗泵注入;
b.亚叶酸钙240 mg/m2/d,静滴3天;
c.21天重复一次,共6周期。
3.2.5 具有细胞学阳性或腹膜转移的胃癌新辅助腹腔化疗+系统化疗(NIPS)[32-34]
1)Yonemura方案(2016)
a.S-1(60 mg/m2/d,d1~14),7天后腹腔化疗;
b.第1天,多西他赛(30 mg/m2),顺铂(30 mg/m2),腹腔化疗泵注入;
c.第8天,顺铂(30 mg/m2),静脉输注;
d.每3周重复一次。
2)Ishigami方案(Phoenix方案)
a.S-1(40 mg/m2,d1~14),21天为1个周期;
b.第1、8天,紫杉醇(50 mg/m2,ivgtt),紫杉醇20 mg/m2加入1 L生理盐水腹腔内化疗,滴注1 h以上;
c.每3周重复一次。
3)Fujiwara方案
a.S-1,40 mg/m2,bid,d1~14;
b.1 L生理盐水加入多西紫杉醇40~60 mg/m2,腹腔化疗;
c.每3周重复一次。
4)Sugarbaker方案
a.经腹腔化疗泵或Tenkhoff导管灌注紫杉醇20 mg/m2加入1 L 6%羟乙基淀粉;
b.连续5天尽可能快速灌注化疗液,使其自然流动;
c.第三天静滴奥沙利铂(100~150 mg/m2,溶于250 mL D5W溶液,2 h),紫杉醇腹腔化疗30 min。
04 临床路径
腹膜癌、原发或复发卵巢癌、原发或复发性胃癌腹膜转移、原发性胰腺癌或胆囊癌、恶性腹膜间皮瘤临床路径推荐如下:
4.1 腹膜癌治疗临床路径
本路径适用于结直肠癌、阑尾黏液性囊腺癌、阑尾黏液蛋白病的CC-2切除患者(图 6)。
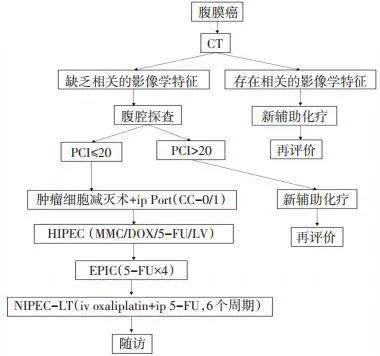
MML:丝裂霉素C;DOX:多柔比星;5-Fu:5-氟尿嘧啶;LV:亚叶酸钙
图 6 腹膜癌治疗临床路径
4.2 原发或复发卵巢癌治疗的临床路径
本路径适用于原发或复发卵巢癌患者(图 7)。
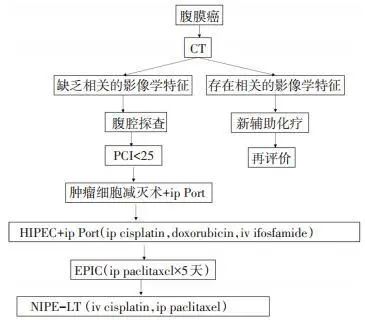
图 7 原发或复发卵巢癌治疗的临床路径
对顺铂耐药者,HIPEC方案推荐应用三聚氰胺或聚乙二醇化脂质体阿霉素;NIPEC-LT方案推荐应用腹腔灌注5-FU+静脉注射丝裂霉素C,或腹腔灌注吉西他滨。
4.3 原发或复发性胃癌腹膜转移治疗的临床路径
本路径适用于原发或复发性胃癌腹膜转移患者(图 8)。
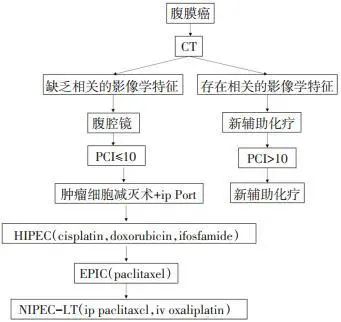
图 8 原发或复发性胃癌腹膜转移治疗的临床路径
4.4 原发性胰腺癌或胆囊癌治疗的临床路径
本路径适用于原发性胰腺癌或胆囊癌患者(图 9)。
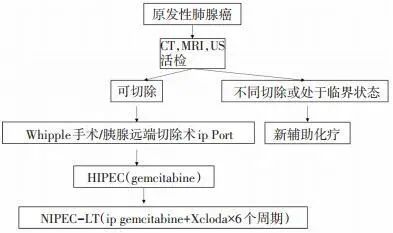
图 9 原发性胰腺癌或胆囊癌治疗的临床路径
4.5 恶性腹膜间皮瘤的临床路径
本路径适用于恶性腹膜间皮瘤患者(图 10)。
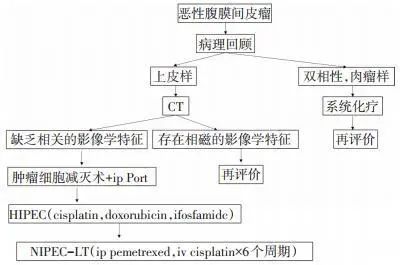
图 10 恶性腹膜间皮瘤的临床路径
End
参考文献:
[1] Koh JL, Yan TD, Glenn D, et al. Evaluation of preoperative computed tomography in estimating peritoneal cancer index in colorectal peritoneal carcinomatosis[J]. Ann Surg Oncol, 2009, 16(2): 327-333.
[2] Sugarbaker PH, Sardi A, Brown G, et al. Concerning CT features used to select patients for treatment of peritoneal metastases, a pictoral essay[J]. Int J Hyperthermia, 2017, 33(5): 497-504.
[3] Rivard JD, Temple WJ, McConnell YJ, et al. Preoperative computed tomography does not predict resectability in peritoneal carcinomatosis[J]. Am J Surg, 2014, 207(5): 760-765.
[4] Pelz JO, Stojadinovic A, Nissan A, et al. Evaluation of a peritoneal surface disease severity score in patients with colon cancer with peritoneal carcinomatosis[J]. J Surg Oncol, 2009, 99(1): 9-15.
[5] Pasqual EM, Bertozzi S, Bacchetti S, et al. Preoperative assessment of peritoneal carcinomatosis in patients undergoing hyperthermic intraperitoneal chemotherapy following cytoreductive surgery[J]. Anticancer Res, 2014, 34(5): 2363-2368.
[6] Jacquet P, Sugarbaker PH. Current methodologies for clinical assessment of patients with peritoneal carcinomatosis[J]. J Exp Clin Cancer Res, 1996, 15(1): 49-58.
[7] Sugarbaker PH. Peritonectomy procedures[J]. Surg Oncol Clin N Am, 2003, 12(3): 703-727.
[8] Carmignani P, Sugarbaker TA, Bromley CM, et al. Intraperitoneal cancer dissemination:mechanisms of the patterns of spread[J]. Cancer Metastasis Rev, 2003, 22(4): 465-472.
[9] Sugarbaker PH. The subpyloric space:an important surgical and radiologic feature in pseudomyxoma peritonei[J]. Eur J Surg Oncol, 2002, 28(4): 443-446.
[10] Sugarbaker PH. Dissection by electrocautery with a ball tip[J]. J Surg Oncol, 1994, 56(4): 246-248.
[11] Sugarbaker PH. Circumferential cutaneous traction for exposure of the layers of the abdominal wall[J]. J Surg Oncol, 2008, 98(6): 472-475.
[12] De Lima Vazquez V, Sugarbaker PH. Xiphoidectomy[J]. Gastric Cancer, 2003, 6(2): 127-129.
[13] De Lima Vazquez V, Sugarbaker PH. Total anterior parietal peritonectomy[J]. J Surg Oncol, 2003, 83(4): 261-263.
[14] Sethna KS, Sugarbaker PH. New prospects for the control of peritoneal surface dissemination of gastric cancer using perioperative intraperitoneal chemotherapy[J]. Cancer Therapy, 2004, 2: 79-84.
[15] De Lima Vazquez V, Sugarbaker PH. Cholecystectomy, lesser omentectomy and stripping of the omental bursa, a peritonectomy procedure[J]. J Surg Oncol, 2003, 84(1): 45-49.
[16] Han SS, Sugarbaker PH. Kocher maneuver to facilitate cytoreduction within the Foramen of Winslow[J]. J Surg Oncol, 2017, 115(7): 788-790.
[17] Deraco M, Baratti D, Kusamura S, et al. Surgical technique of parietal and visceral peritonectomy for peritoneal surface malignancies[J]. J Surg Oncol, 2009, 100(4): 321-328.
[18] Sugarbaker PH. Pont hepatique(hepatic bridge), an important anatomic structure in cytoreductive surgery[J]. J Surg Oncol, 2010, 101(3): 251-252.
[19] Sugarbaker PH. Cytoreductive Surgery & Perioperative Chemotherapy for Peritoneal Surface Malignancy[M]. 2rd ed. Canada: CineMed, Inc. Press, 2017: 1-239.
[20] Bijelic L, Sugarbaker PH. Cytoreduction of the small bowel surfaces[J]. J Surg Oncol, 2008, 97(2): 176-179.
[21] Honore C, Goere D, Souadka A, et al. Definition of patients presenting a high risk of developing peritoneal carcinomatosis after curative surgery for colorectal cancer:a systematic review[J]. Ann Surg Oncol, 2013, 20(1): 183-192.
[22] Van der Speeten K, Stuart OA, Chang D, et al. Changes induced by surgical and clinical factors in the pharmacology of intraperitoneal mitomycin C in 145 patients with peritoneal carcinomatosis[J]. Cancer Chemother Pharmacol, 2011, 68(1): 147-156.
[23] Turaga K, Levine E, Barone R, et al. Consensus guidelines from The American Society of Peritoneal Surface Malignancies on standardizing the delivery of hyperthermic intraperitoneal chemotherapy(HIPEC) in colorectal cancer patients in the United States[J]. Ann Surg Oncol, 2014, 21(5): 1501-1505.
[24] Elias D, Bonnay M, Puizillou, et al. Heated intra-operative intraperitoneal oxaliplatin after complete resection of peritoneal carcinomatosis:pharmacokinetics and tissue distribution[J]. Ann Oncol, 2002, 13(2): 267-272.
[25] Stewart JH. A phase 1 trial of oxaliplatin for intraperitoneal hyperthermic chemoperfusion for the treatment of peritoneal surface dissemination from colorectal and appendiceal cancers[J]. Ann Surg Oncol, 2008, 15(8): 2137-2145.
[26] Van der Speeten K, Stuart OA, Mahteme H, et al. Pharmacokinetic study of perioperative intravenous ifosfamide[J]. Int J Surg Oncol, 2011, 185092.
[27] Deraco M, Baratti D, Cabras AD, et al. Experience with peritoneal mesothelioma at the Milan National Cancer Institute[J]. World J Gastrointest Oncol, 2010, 2(2): 76-84.
[28] Sugarbaker PH, Stuart OA, Bijelic L. Intraperitoneal gemcitabine chemotherapy treatment for patients with resected pancreatic cancer:rationale and report of early data[J]. Int J Surg Oncol, 2011, 2011: 161862.
[29] Bijelic L, Sugarbaker PH, Stua rt OA. Hyperthermic intraperitoneal chemotherapy with melphalan:a summary of clinical and pharmacologic data in 34 patients[J]. Gastroenterol Res Pract, 2012, 2012: 827534.
[30] Sugarbaker PH, Stuart OA, Bijelic L, et al. Hyperthermic intraperitoneal gemcitabine chemotherapy for patients with resected pancreatic cancer:clinical pharmacologic data[J]. Curr Top Pharmacol, 2014, 18: 81-92.
[31] Wagner PL, Jones D, Aronova A, et al. Early postoperative intraperitoneal chemotherapy following cytoreductive surgery for appendiceal mucinous neoplasms with isolated peritoneal metastases[J]. Dis Colon Rectum, 2012, 55(4): 407-415.
[32] Yonemura Y, Canbay E, Li Y, et al. A comprehensive treatment for peritoneal metastases from gastric cancer with curative intent[J]. Eur J Surg Oncol, 2016, 42(8): 1123-1131.
[33] Kitayama J, Ishigami H, Yamaguchi H, et al. Salvage gastrectomy after intravenous and intraperitoneal paclitaxel(PTX) administration with oral S-1 for peritoneal dissemination of advanced gastric cancer with malignant ascites[J]. Ann Surg Oncol, 2014, 21(2): 539-546.
[34] Fujiwara Y, Takiguchi S, Nakajima K, et al. Neoadjuvant intraperitoneal and systemic chemotherapy for gastric cancer patients with peritoneal dissemination[J]. Ann Surg Oncol, 2011, 18(13): 3726-3731.