免疫靶向“强强联手”,全新PD-1特殊Fc段改造为晚期HCC患者带来完全缓解!
晚期肝细胞癌(HCC)的治疗手段有限,部分患者由于身体情况以及肝硬化程度等因素而不适合进行手术。对于这部分高危患者,能否采取免疫联合治疗改善预后?本期将分享一例经特殊Fc段改造的PD-1单抗联合靶向一线治疗晚期HCC患者的病例。

占志强
副主任医师
萍乡市人民医院肿瘤科副主任
萍乡市人民医院肿瘤科领军人才培养对象
江西省整合医学会肺癌专业委员会常委
江西省研究型医院协会肺部肿瘤学分会青委会常委
江西省整合医学会肿瘤分子靶向委员会常委
江西省整合医学会肿瘤免疫治疗委员会委员
IASLC(国际肺癌研究协会)会员
ASCO(美国临床肿瘤学会)会员
CSCO(中国临床肿瘤学会)会员
基本情况
一般资料:患者男性,56岁。
主诉:肝癌切除术后3个月,发现肝内新发占位1个月。
现病史:
患者于2019年10月9日体检发现肝脏占位,并于当月就诊于外院行肝段切除术。术后行TACE一次,过程顺利,后行随诊复查。
2019年12月3日于门诊复查提示AFP动态快速升高至489.3 ug/L,2019年12月4日MRI示肝内见多发小结节,以肝左叶明显,呈等T1稍长T2信号,DWI呈高信号,增强呈明显强化,考虑复发。于外院再次行TACE术一次。
2020年1月30日复查AFP升高至615 ug/L,MRI复查提示多发小结节增大增多,病情进展。
既往史:慢性乙型肝炎病史。
ECOG PS评分:1分。
腹部MRI(2019-10-09):肝内信号不均匀,多发弥漫性T2WI稍低信号,肝S7段可见类圆形异常信号,T1WI呈稍低信号,T2WI-FS呈稍高信号,DWI呈明显高信号,增强扫描后动脉期病灶明显强化,门脉期及延迟期病灶强化程度明显下降,呈快进快出改变,病灶大小31 × 31 × 32 mm,可见假包膜形成,余肝实质内未见强化病灶,肝血管走行正常,腹膜后未见肿大淋巴结,腹腔内未见积液征象。
术后病理(2019-10):中分化肝细胞癌,粗梁型,Ⅲ级肝脏标本(大小8.2 × 6.5 × 4.3 cm),切面可见灰白色肿块4 × 2.2 cm;MVI评级=M2,小结节性肝硬化。
诊断:1.原发性肝癌IIIA期,BCLC C期,cT3bN0M0,MVI=M2,ALBI ≤-2.60,Child-pugh A级,ECOG PS 1分;2.慢性乙型病毒性肝炎。
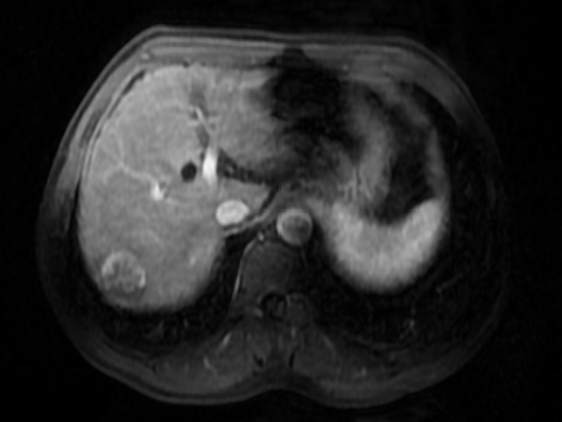
治疗经过
本例患者ECOG PS评分0~1分、Child Pugh A级,一般情况良好,考虑予以免疫联合治疗方案。为观察并监测药物毒副作用,经患者充分知情同意并签署知情同意书后,于2020年2月8日起先行予以靶向治疗方案:“仑伐替尼8 mg”(尽管体重大于60公斤),治疗期间仅出现轻度腹泻,患者可以耐受。于2020年3月8日予以免疫联合靶向治疗方案:“替雷利珠单抗200 mg + 仑伐替尼8 mg”。
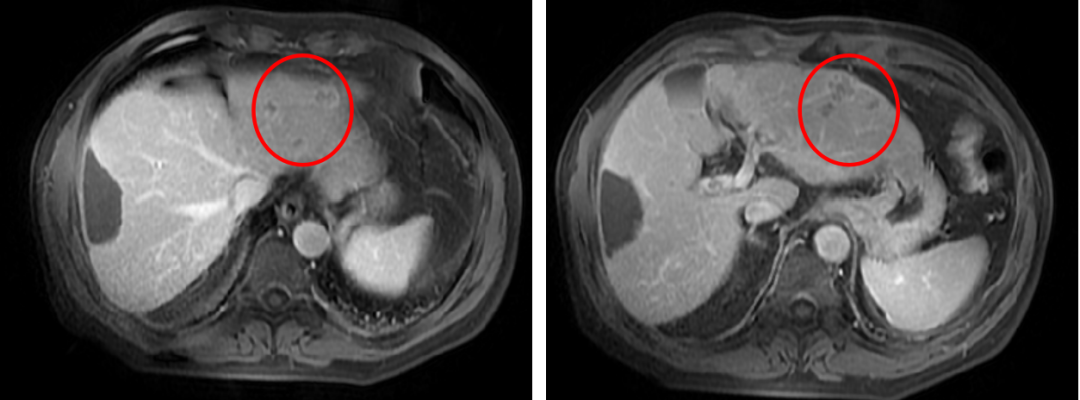
(1)联合治疗2周期
疗效评价:PR
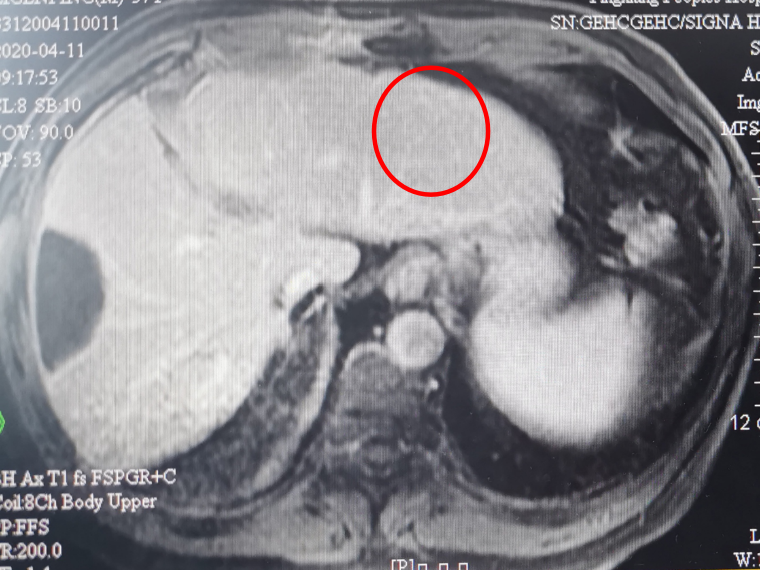
(2)联合治疗6周期
疗效评价:CR。
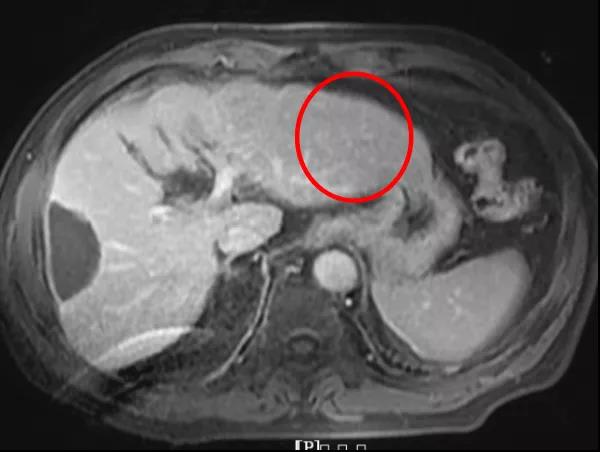
病例总结
本例患者为原发性肝细胞癌切除术后,术后行第一次TACE治疗病情平稳。但术后2个月复查发现肝内新发占位、AFP动态快速升高,考虑复发,予以第二次TACE治疗,病情未得到控制,考虑疾病进展。患者ECOG PS评分1分、Child Pugh A级,身体基线情况较好,于我院就诊后考虑予以免疫联合靶向治疗。为观察并监测药物毒副作用,先行予以靶向药物治疗,不良反应为轻度腹泻,患者可以耐受。靶向治疗1个月后加用替雷利珠单抗免疫治疗,用药2周期疗效即达PR,AFP明显下降。截至最近一次随访,患者的靶病灶完全消失,AFP降低至正常,疗效达到CR,PFS已达6个月。用药期间,患者除轻度的血小板下降之外,无明显主观不良反应。
经验分享

彭济勇 教授
主任医师
萍乡市人民医院肿瘤科党支部 书记
中国抗癌协会会员
江西省抗癌协会化疗、放疗专业委员会委员、肺癌专业委员会委员
江西省抗癌协会肿瘤靶向治疗委员会常委、姑息与营养治疗委员会常务委员
江西省研究型医院肿瘤分会常委
中国南方肿瘤临床研究协会肺癌专业委员会委员
江西省医师协会肿瘤医师分会委员
江西省整合医学会肿瘤学学会常务委员
本例患者在原发性肝细胞癌切除术后2个月即开始出现肝内复发,伴有AFP动态快速升高,行TACE术仍不能有效控制病情,需要重新思考合适的治疗方案。研究资料显示,自抗癌领域进入精准诊疗时代,已有多个靶向治疗药物在晚期HCC的Ⅲ期研究中取得成功[2-5]。除外靶向治疗,近年来免疫疗法也为晚期肝癌患者带来了新的希望。免疫疗法通过使自身免疫系统正常化来抗击肿瘤,而非直接杀伤肿瘤细胞,在治疗上具有长期生存获益、不良反应发生率低等特点。有研究显示,PD-1/PD-L1单抗单药一线治疗晚期HCC患者的ORR约为15%-20%[6-9],疗效有了明显的提升,但PD-1/PD-L1单抗和靶向药物单药治疗HCC的疗效仍然有限。
为进一步延长患者的预后生存,联合用药的方案应运而生。不同药理机制、不同分子构型、不同不良反应的药物联合使用或可提高治疗有效率,是未来研究的热点和发展方向。在2020美国临床肿瘤学会年会(ASCO)上报道了一项PD-1单抗联合靶向小分子抑制剂一线治疗HCC的Ib期研究数据[10],结果显示ORR为36%,mPFS和mOS分别为8.6个月和22个月,与PD-1单抗单药比较疗效明显提高,免疫联合靶向治疗方案在晚期HCC患者中取得了不错的疗效。
在诸多PD-1单抗中,替雷利珠单抗是目前唯一一个对Fc段进行了结构优化的PD-1单抗,没有FcγR结合能力,可以有效避免抗体依赖细胞介导的细胞吞噬作用(ADCP),从而减少T细胞损耗,使药物的抗肿瘤活性更强。此外,替雷利珠单抗还表现出与PD-1结合力强、亲和力高、出现脱靶效应几率低等诸多优点[11,12]。此外,由于不诱导ADCP效应,还可在肿瘤中巨噬细胞数量较多的情况下发挥更优的T细胞激活效应。因此,替雷利珠单抗在巨噬细胞含量丰富的肝脏中或能发挥更好的肿瘤细胞清除作用。
研究显示,替雷利珠单抗单药治疗经治晚期肝癌患者的ORR达到12%,DOR达到15.7个月[13],在2019 CSCO的一项口头报告中[14],替雷利珠单抗治疗中国不可手术的晚期HCC患者ORR达17%,DCR为56%,疗效比肩国外同类药物,且安全性良好,≥3级不良反应发生率低。鉴于替雷利珠单抗的良好数据,一项旨在验证替雷利珠单抗联合仑伐替尼在一线治疗不可切除晚期HCC患者中的有效性和安全性的II期研究正在进行中[15],期待替雷利珠单抗能够获得更好的数据,惠及更多晚期HCC患者。
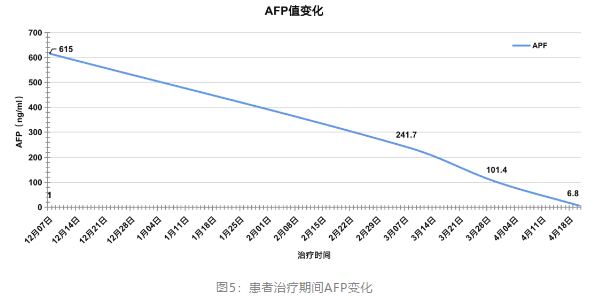
本例患者经替雷利珠单抗联合靶向治疗至今,肝内靶病灶完全消失,AFP也由治疗前的615 ng/ml降至正常(6.8 ng/ml),总体疗效评价达到CR。患者用药至今PFS已超过6个月,除轻度的血小板下降之外,无其他不良反应事件发生。因此,对于ECOG PS评分0~1分、Child Pugh A级等身体基线情况比较好的患者,首次用药时就可以同时联合使用免疫和靶向药物,安全性良好,获益持久。替雷利珠单抗作为肿瘤治疗领域引领突破的PD-1单抗,强强联合一线靶向药物,未来或将成为晚期HCC治疗优选之一,为患者赢得更多生命延长的机会。
本例患者术后很快出现复发和病情进展,未来还需要探索可靠的预后预测标志物,从而提前筛选出可能的高风险患者和治疗优势人群,使原发性肝癌的治疗更加精准。本例患者目前治疗过程顺利,未来还需对免疫联合治疗的疗效和安全性进行规律的监测和把控。此外,在这个信息高度发达的时代,如何平衡规范化诊疗与个体化诊疗,也值得每位临床医师深思。期待替雷利珠单抗在进一步的肝癌研究中获得更好的数据,早日应用于肝癌临床,发挥其疗效和安全性优势,为患者带来更多生存获益。
参考文献
[1] Alsina A, et al. 2019 ASCO-GI Abstract 371.
[2] Masatoshi Kudo, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. REFLECT. Lancet 2018; 391: 1163–73.
[3] Bruix J, Qin S, Merle P, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment(RESORCE): a randomised, double- blind, placebo- controlled, phase 3 trial[J]. Lancet, 2017, 389(10064):56-66.
[4] Zhu AX, Park JO, Ryoo BY, et al. Ramucirumab versus placebo as secondline treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib(REACH): a randomised, double-blind, multicentre, phase 3 trial[J]. Lancet Oncol, 2015, 16(7): 859-870.
[5] Abou-Alfa GK, Meyer T, Cheng AL, et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma[J]. New Engl J Med, 2018, 379(1):54-63.
[6] Thomas Yau, CHECKMATE-459, 2019 ESMO.
[7] Thomas Yau, et al. Nivolumab in advanced hepatocellular carcinoma: Sorafenib - experienced Asian cohort analysis. Journal of Hepatology. CHECKMATE-040. 2019; 71: 543–552.
[8] Zhu AX, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib(KEYNOTE-224): a non-randomised, open-label phase 2 trial. KEYNOTE-224. Lancet Oncol. 2018 Jul;19(7):940-952.
[9] Richard S. Finn, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. J Clin Oncol. 2020 Jan 20; 38(3):193-202.
[10] Andrew X. Zhu, et al. A phase Ib study of lenvatinib(LEN) plus pembrolizumab(PEMBRO) in unresectable hepatocellular carcinoma(uHCC)[J]. J Clin Oncol, 2020, 38(15 suppl): 4519.
[11] Dahan R, et al. FcγRs Modulate the Anti-tumor Activity of Antibodies Targeting the PD-1/PD-L1 Axis. Cancer Cell. 2015;28(3):285-95.
[12] Zhang T, et al. The binding of an anti-PD-1 antibody to FcγRΙ has a profound impact on its biological functions. Cancer Immunol Immunother. 2018;67(7):1079-1090.
[13] BGB-A317-001.
[14] 沈琳,2019 CSCO.
[15] Clinical Trial: NCT04401800.