大咖云集 共同探讨HER2阳性乳腺癌的精准化治疗
第十三届天津国际乳腺癌会议暨2020美国临床肿瘤学会(ASCO)海外会场于2020年8月27日-29日在天津顺利召开。本次会议聚焦精准诊断下乳腺癌治疗的新理念、新智慧、新发现、新成果,国内外顶尖乳腺癌专家云集,共同探讨乳腺癌诊疗规范与诊治难点。HER2阳性乳腺癌侵袭性强、易发生转移、预后差,因此抗HER2治疗发展从未停歇,从曲妥珠单抗(赫赛汀)登陆中国逐步成为惠民的基石治疗;赫帕双靶联手走过辅助、新辅助到晚期的全适应证上市之路全面升级为抗HER2治疗的新标准;今年4月恩美曲妥珠单抗(赫赛莱)的加入填补了标准新辅助治疗后未达到病理完全缓解(non- pCR)患者的治疗空白,让这类预后不佳人群同样拥有治愈机会,曲妥珠单抗+帕妥珠单抗+恩美曲妥珠单抗(HPK)开启抗HER2治疗新时代。
会议期间,医脉通有幸邀请到天津医科大学肿瘤医院张瑾教授,分享HPK在抗HER2治疗中的全程管理。复旦大学附属肿瘤医院的李俊杰教授、余科达教授、中国医科大学附属第一医院的滕月娥教授、中国人民解放军总医院第五医学中心的王涛教授就HER2阳性乳腺癌的精准治疗带来了精彩的学术报告及专题讨论。
HPK抗HER2:全程管理,追求治愈

医脉通:HER2阳性早期乳腺癌治疗的目标是治愈,您认为HPK在HER2阳性早期乳腺癌系统化治疗中地位如何?
张瑾教授:HER2阳性乳腺癌是乳腺癌亚型之一,占乳腺癌发病20%左右。在过去,由于未发现HER2这个靶点以及未明确这种乳腺癌亚型的生物学行为,其预后非常差。1987年UCLA肿瘤学家Dennis Slamon首次发现HER2是乳腺癌驱动基因,自此开启了抗HER2治疗的探索。
1998年,首个抗HER2阳性乳腺癌靶向药物曲妥珠单抗问世,开启了抗HER2治疗的新历程。曲妥珠单抗改变了HER2阳性早期乳腺癌的自然病程,但仍有近30%患者将出现复发或死亡。曲妥珠单抗无法完全满足高风险HER2阳性早期乳腺癌患者,尤其是淋巴结阳性患者的治愈需求。为解决这一问题,帕妥珠单抗随之上市,以赫帕双靶为基础的方案成为HER2阳性早期乳腺癌患者新辅助治疗和辅助治疗的优选方案。
在今年4月,抗体偶联药物(antibody-drug conjugate,ADC)恩美曲妥珠单抗(T-DM1) 被国家药品监督管理局(NMPA)批准上市,填补了新辅助治疗后non-pCR(包括原发灶或者淋巴结仍有侵袭性肿瘤残存)的患者辅助强化治疗的空白。
KATHERINE研究显示,在接受足疗程的抗HER2新辅助治疗后non-pCR的患者,在辅助治疗阶段,与对照组曲妥珠单抗相比,采用14个周期T-DM1的治疗可显著降低复发或死亡风险50%,有效提升3年无病生存率绝对差值11.3%。国内外指南及共识均推荐,恩美曲妥珠单抗作为抗HER2新辅助治疗后仍有残存病灶乳腺癌患者强化辅助治疗的I类治疗方案。作为乳腺癌领域第一个上市的抗体偶联药物,T-DM1给HER2阳性乳腺癌治疗带来了新希望,使我们有更大的信心追求早期HER2阳性乳腺癌的治愈目标。
对于早期HER2阳性乳腺癌患者,无论是新辅助治疗和辅助治疗,HPK环环相扣,贯穿全程,始终是HER2阳性乳腺癌患者各个治疗阶段的标准之选。
医脉通:HER2阳性晚期乳腺癌治疗目标是延长生存,提高生活质量,请您谈谈HPK将如何助力HER2阳性晚期乳腺癌患者实现长期生存?
张瑾教授:对于HER2阳性晚期乳腺癌患者,治疗目标是延长生存,提高生活质量,赫帕双靶联合化疗是国内外指南推荐且能获得长期生存获益的HER2阳性乳腺癌晚期一线双靶方案。
ASCO前主席、CLEOPATRA研究全球PI Sandra M.Swain教授在本次大会中,报告了CLEOPATRA研究8年随访结果,赫帕双靶联合多西他赛组的8年生存率达到37%,而对照组为23%,这意味着赫帕双靶方案可使患者长期生存。Sandra M.Swain教授同时也解读了EMILIA研究结果,证实T-DM1 相对于拉帕替尼联合卡培他滨,总生存期可延长4个月(29.9 个月 vs 25.9 个月)。Sandra M.Swain教授认为,对于HER2阳性晚期乳腺癌患者,一线治疗推荐赫帕双靶方案,二线治疗推荐T-DM1方案。治愈HER2阳性乳腺癌,是全球乳腺癌专家的共同期盼,也是HPK在抗HER2治疗里程中,始终不变的初心与坚定不移的目标。
过去,恶性肿瘤治疗周期长、花费高,使得患者及家属不得不去寻找仿制药和生物类似药来降低治疗成本。目前,原研曲妥珠单抗和帕妥珠单抗均已进入国家医保目录,恩美曲妥珠单抗也在积极筹备医保谈判工作。对于赫赛汀,罗氏积极参与国家医保政策,以近70%的降价幅度,让更多中国HER2阳性乳腺癌患者得到这样一个传奇而又基石的药物治疗。帕捷特更是在上市第一年就进入医保,赫帕双靶相较去年整体降价68%,让更多高复发风险患者可以追求治愈。对于赫赛莱这样一款革命性创新药物,罗氏依然有决心进入医保,使HPK能够更全面地助力每一位中国HER2阳性乳腺癌患者的精准治疗,延长患者生存时间,提高生活质量,朝着治愈的目标迈进!
HER2阳性乳腺癌精准化治疗专题报告
本次会议四位专家HER2阳性乳腺癌精准治疗,从早期到晚期,再到原研生物制剂的优势分别做了精彩的学术报告。
首先我们来看一下李俊杰教授、余科达教授对于HER2阳性早期乳腺癌新辅助和辅助治疗的精彩分享。
HER2阳性早期乳腺癌多临床决策点优化策略
李俊杰教授认为,找到新辅助治疗决策点,重点需关注三个方面:新辅助治疗人群选择、初选及优选方案、根据新辅疗效决定后续治疗策略,以及如何在临床实践中的每一步优化治疗策略值得考量。
➤ 根据治疗目标,有一定肿瘤负荷/“降阶梯”手术需求的HER2阳性患者,优选新辅助治疗,并选择TCbHP为初选方案。
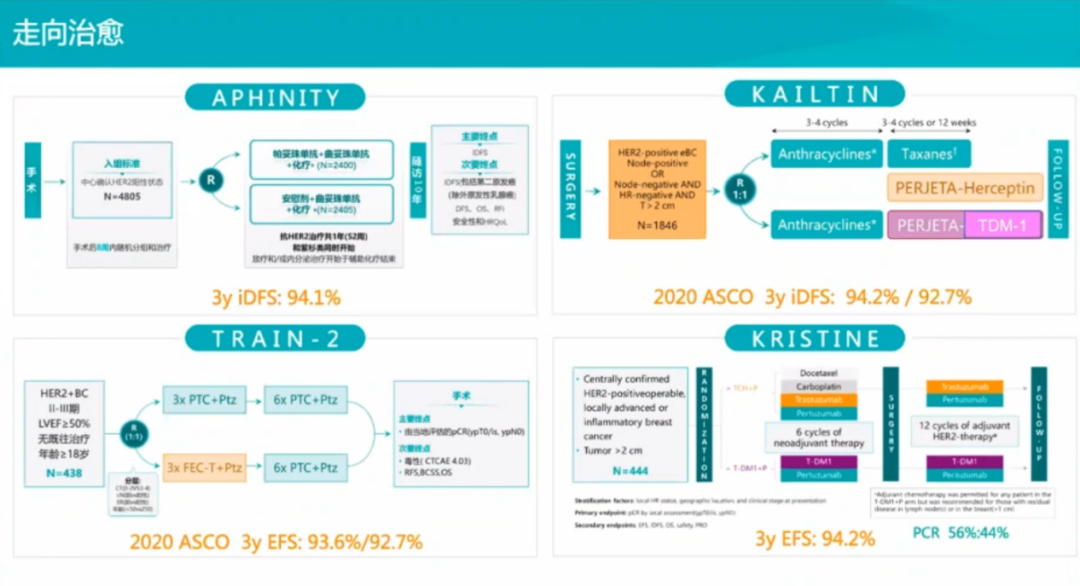
NCCN指南中,对于临床分期≥T2,M0或≥N1,M0的患者,可选新辅助治疗;可手术(≤T3N1)患者,新辅助是可选治疗策略;不可手术的患者,新辅助是必选治疗策略,只有通过新辅助降期之后才可获得手术机会;HER2阳性、有一定肿瘤负荷、有局部治疗需求的患者,新辅助是优选治疗策略。临床实践中,推选TCbHP方案作为HER2+患者的初选治疗策略。
➤ 根据早期疗效评估,有效患者应完成足疗程的TCbHP方案,最终达到pCR,辅助赫帕双靶维持一年全程治疗;non-pCR患者,辅助T-DM1强化治疗。
新辅助治疗后达到pCR的患者预后很好,可尝试降阶梯治疗,non-pCR患者可尝试进行辅助升阶梯治疗,但要提高DFS,有三个关键因素:第一,完成足量、规范新辅助治疗后,才能在选择手术时,根据pCR/non-pCR选择升/降阶梯;第二,当患者达到pCR应乘胜追击完成后续足疗程双靶治疗;第三,对于残留肿瘤,需通过全疗程筛选之后,non-pCR患者才能进行辅助强化。
➤ 如果患者疗效不佳,推荐尽早手术,此时采用两个疗程TCbHP之后完成手术,辅助阶段补足4个疗程EC,随后根据KRISTINE研究方案,用帕妥珠单抗+T-DM1进行全程辅助强化治疗。
HER2阳性乳腺癌新辅助治疗后基于pCR状态的辅助治疗决策
余科达教授指出,新辅助治疗后non-pCR患者,有必要进行T-DM1的后续治疗;达到pCR患者的后续治疗是否都一视同仁,都采取相同策略,需进行探讨。
KATHERINE研究中,对于足疗程新辅助治疗后non-pCR的患者,T-DM1组较曲妥珠单抗组的3年iDFS率提高了11.3%,在中国患者中提高了13.4%。曲妥珠单抗组因不良事件导致停药的几率低于T-DM1组,因此T-DM1在non-pCR人群中的使用需进行全体化和个体化的权衡。余科达教授表示更偏向于全体化,但会有个体化的考量和操作。
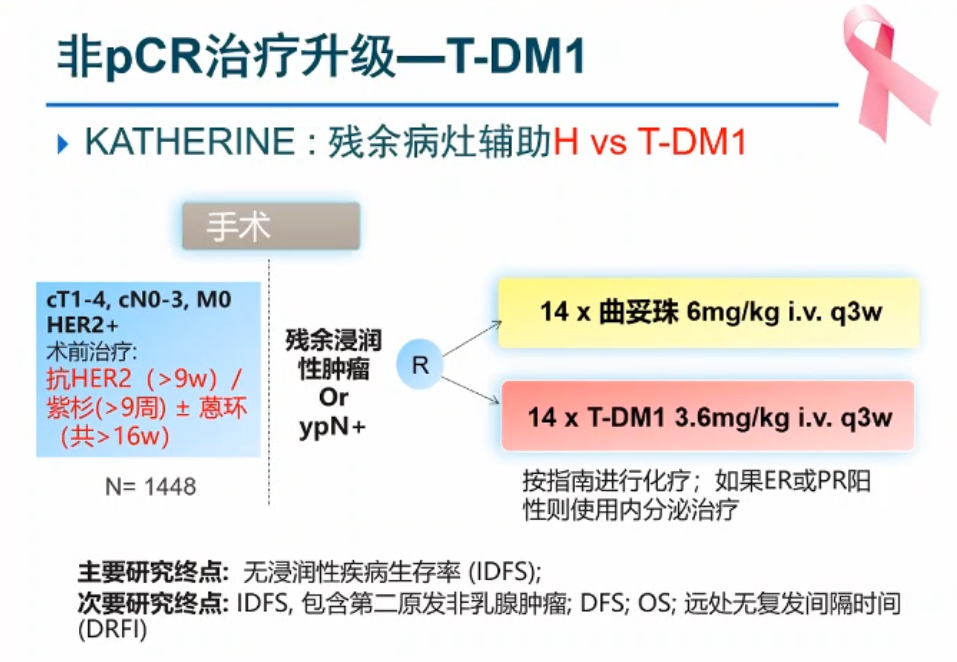
余科达教授表示,选择比实力更重要。APHINITY研究、KAITLIN研究、KATHERINE研究对比结果显示, T-DM1在未经曲妥珠单抗治疗人群中的获益仅有3%,但在曲妥珠单抗经治后的人群中却有11.3%的绝对获益。因此,在对的人群中使用T-DM1会给患者带来更显著的获益。
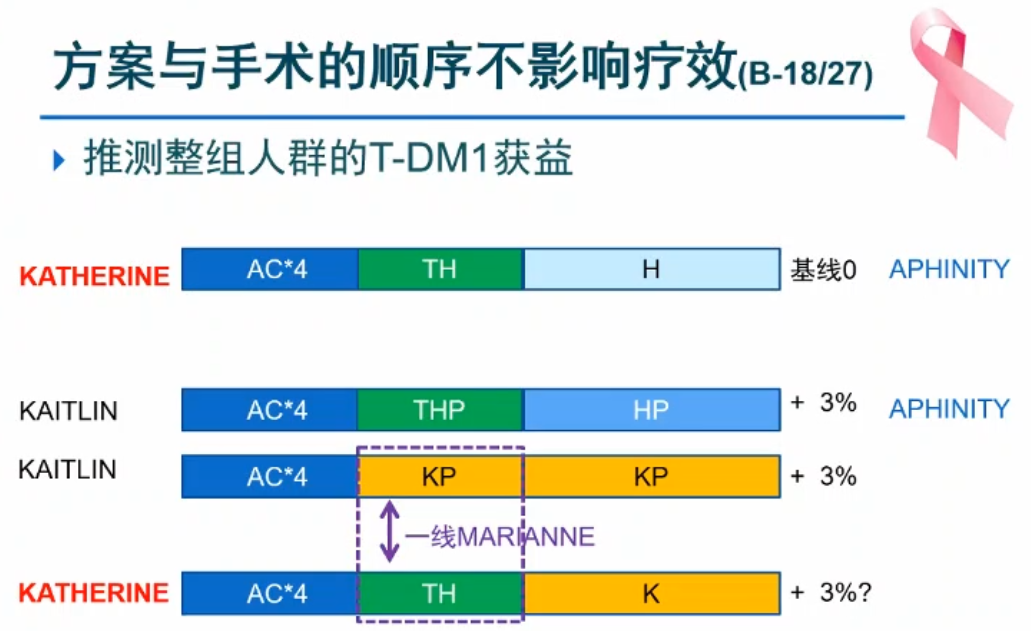
余科达教授对pCR患者预后做了分析,结果显示,赫帕双靶方案3年EFS率优于单靶方案。
最后,余科达教授总结,对于non-pCR患者,后续接受T-DM1治疗。对于达到pCR患者,可优选赫帕双靶方案。
HER2阳性晚期乳腺癌最长生存之道
➤ 晚期乳腺癌治疗目标是延长生存,抗HER2治疗方案的不断变革推动HER2阳性晚期乳腺癌生存率的不断提高。
晚期乳腺癌无论哪一种亚型,最终目的都是延长生存期、提高生活质量。
➤ 自CLEOPATRA和PUFFIN研究,赫帕双靶已成为国际和国内HER2阳性晚期乳腺癌一线首选治疗方案。
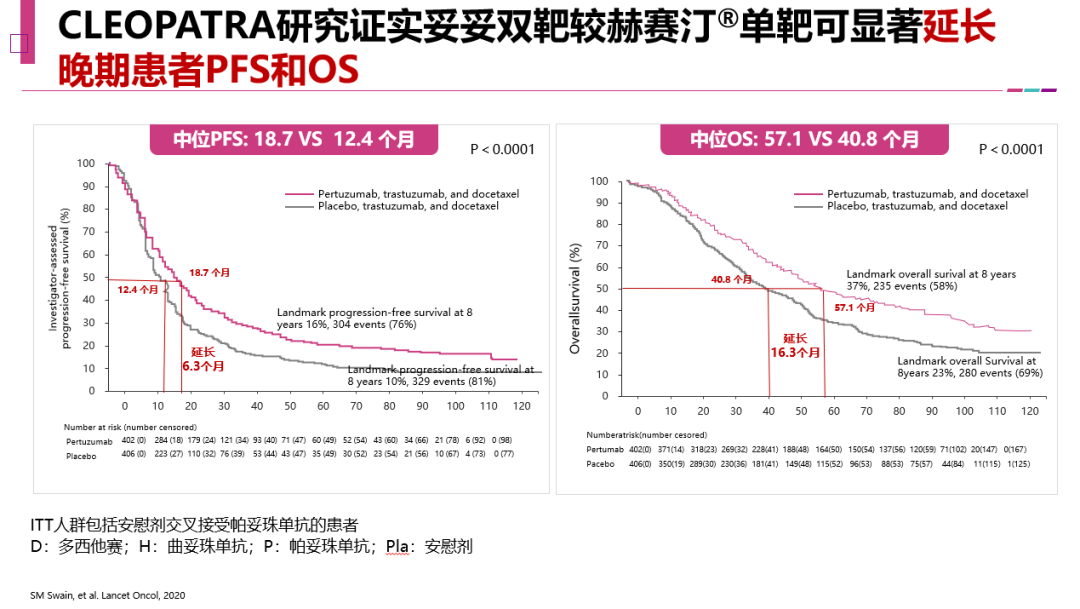
CLEOPATRA研究前所未有的生存获益使赫帕双靶成为HER2阳性晚期乳腺癌一线治疗新标准。CLEOPATRA的主要研究终点PFS结果显示,双靶和单靶相比,中位PFS从12.4个月延长到了18.7个月,中位OS从40.8个月延长到了57.1个月。PUFFIN研究和CLEOPATRA研究设计非常相似,显示出在中国人群,赫帕双靶联合化疗仍然使晚期一线患者疾病进展风险降低31%,PFS显著获益,验证了双靶方案在中国人群中同样具有优效性。由于赫帕双靶疗效显著,同时安全性保持良好,国内外权威指南一致推荐赫帕双靶作为HER2阳性晚期乳腺癌一线首选方案。
异源二聚体是曲妥珠单抗疗效的逃避机制,在未使用过帕妥珠单抗的晚期患者中,需要考虑使用或再次使用赫帕双靶。
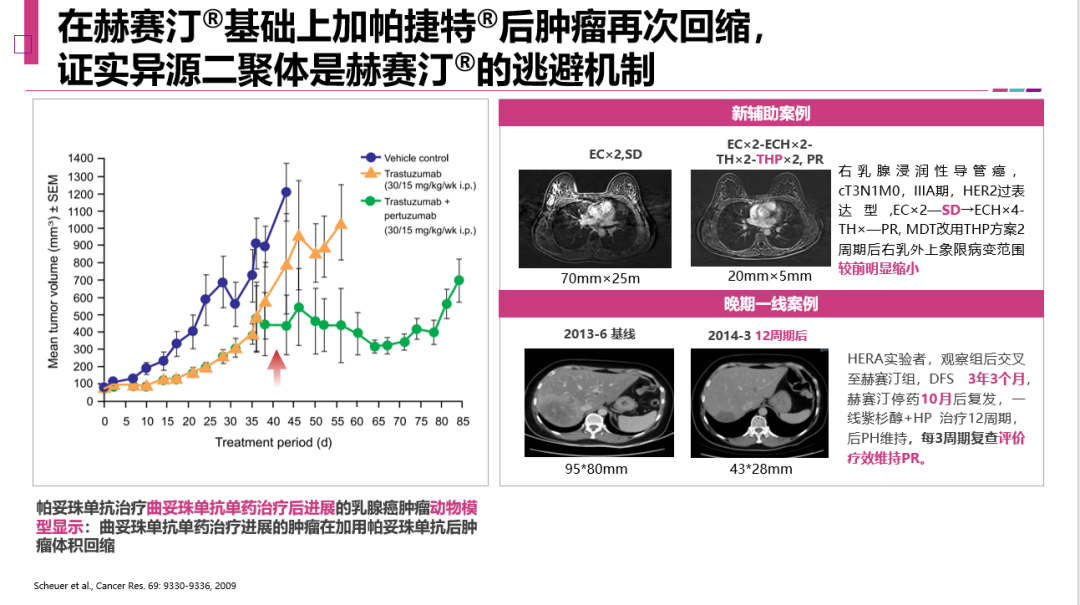
HER2分子活化有两种途径:一种是形成同源二聚体,即HER2和HER2非配体依赖性的结合;另一种是形成异源二聚体,也就是HER2和家族其他成员(包括HER1、HER3和HER4)形成的异源二聚体,同样能引起HER2信号向下传导。
既往曲妥珠单抗主要是阻断同源二聚体结合,即阻断了HER2胞外段的IV结构区域,阻滞了非配体依赖性的HER2激活模式,而无法阻断异源二聚体结合。帕妥珠单抗可作用在HER2胞外段的II结构区,阻断异源二聚体结合,即配体依赖性的HER2激活模式。通过曲妥珠单抗和帕妥珠单抗的结合,可以从源头上将整个HER2信号传导阻断。上述模式图反映在动物模型上的结果显示,与曲妥珠单抗和帕妥珠单抗单药治疗相比,赫帕双靶的疗效稳定而长效,从源头阻断机制的研究到临床研究的结果,形成证据链的闭环。
曲妥珠单抗作为既往抗HER2治疗标准方案,2018年进入医保极大改变了国内晚期治疗的患者类型分布。
2018年起,曲妥珠单抗进入中国国家医保正式执行阶段。但在此之前,70%的HER2阳性早期乳腺癌患者因各种原因未在术后进行规范抗HER2治疗。相对于接受曲妥珠单抗辅助治疗的患者,未进行曲妥珠单抗辅助治疗的患者将更早、更多复发。那么当这些患者再次出现复发,会在我们实际解救晚期一线患者的临床工作中,占比多少呢?
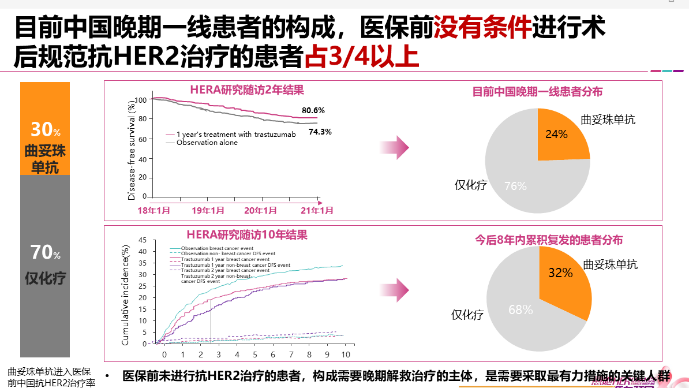
依据HERA研究2年随访数据,曲妥珠单抗组2年复发率为19.4%,非曲妥珠单抗组为25.7%。以2018年中国医保执行为界,考虑中国医保正式执行前70%为非曲妥珠单抗治疗患者,即目前中国复发的晚期一线的患者中,当时仅化疗的患者占比75%。
依据HERA研究10年随访数据,曲妥珠单抗组10年累积复发率为30.7%,非曲妥珠单抗组10年累积复发率为37.5%。以2018年中国医保执行为界,考虑中国医保正式执行前70%为非曲妥珠单抗治疗,今后8年内中国复发的晚期一线患者中,当时仅化疗的患者占比68%。
通过以上分析可以看出,对于中国医保正式执行前未进行曲妥珠单抗规范辅助治疗的患者,将构成现在和今后多年复发的晚期一线主体,帮助这类患者获得更长的无疾病进展和更长的生存,也将提高整个中国HER2阳性晚期乳腺癌的生存期。
原研药曲妥珠单抗、帕妥珠单抗和T-DM1的效果如此之好,会不会有生物类似药来分一杯羹呢,这些药物能发挥原研药的效果吗?接下来,王涛教授跟大家分享原研药和生物类似药在临床应用的思考。
生物制剂临床应用的思考
近年来,随着生物制剂的专利逐渐到期,生物类似药研发火热。王涛教授提出,应理性看待生物类似药。生物制剂分子量较大,具有复杂的多级结构,异质性大,理化性质与内部结构高度相关,细微差异可能导致疗效安全性的变化。且生物制剂的生产工艺十分复杂,任何微小的改变均可能影响生物制剂的疗效和安全性。因此,生物类似药和原研药相比,相似却不相同。
原研创新药基于大量临床研究数据,对疗效和安全性均做出了全面评估。生物类似药和原研药在患者人群、研究设计、研究终点、安全性、免疫原性、适应证外推等方面都存在很大的不同。

王涛教授还提到目前生物类似药在做等效研究前需设立等效界值,但现在已上市的曲妥珠单抗类似药等效界值设定从±12.5到±15不等,本身之间就差异很大。
在提到对于生物类似药的关注点时,王涛教授提到了长期获益的问题。对于原研药的研究终点,在晚期乳腺癌中要看到PFS获益,在早期乳腺癌中要看到DFS获益。对于曲妥珠单抗的生物类似药来说,晚期乳腺癌的研究终点是ORR,但现在新药研发不会用ORR作为晚期乳腺癌研究终点。ORR或pCR是否意味着生物类似药长期获益,目前尚不清楚,需要在真实世界中的使用来进一步观察。
在长期安全性方面,原研曲妥珠单抗上市时间长,安全性数据积累丰富,但生物类似药使用时间不长,需要对安全性数据做更多积累。生物类似药的应用,医生必须谨慎考虑其安全性、疗效、耐受性等问题,同时紧密监测患者用药安全,临床实践中应加强真实世界的研究,包括外推适应证的疗效、长期安全性。最后王涛教授希望更多创新药可以被研发应用至临床,切实惠及更多患者。
HPK携手开启抗HER2治疗新时代,原研药物因其卓越的疗效和良好的安全性,成为临床治疗的优先选择方案。如今赫帕双靶已纳入国家医保目录,曲妥珠单抗更是二次降价,年治疗费用低于生物类似药,打破原研价高偏见,HPK将继续践行先患者之需的使命,让每一个中国HER2阳性患者都能用上质高价廉的原研药,获得更多治愈的机会。