程颖教授 N2期NSCLC患者的全程管理

01 N2 NSCLC的定义
N2:同侧纵隔和或隆突下淋巴结转移,根据T分期的不同分为IIIA期(T1、T2)和IIIB期(T3、T4)。
同时,左肺和右肺N2淋巴结的定义略有不同,右肺癌N2:2R,3aR,3p,4R,7,8R,9R;左肺癌N2:2L,3aL,4L,5,6,7,8L,9L。
02 N2期NSCLC具有高度异质性
可分为三类:可手术切除N2期NSCLC:部分单站纵隔淋巴结转移且淋巴结短径<2cm的N2;潜在可切除的III期NSCLC:包括单站N2纵隔淋巴结短径<3cm的III期NSCLC;不可切除的N2期NSCLC:单站N2纵隔淋巴结短径≥3cm、多站以及淋巴结融合成团(CT上淋巴结短径≥2cm)的N2。
N2期NSCLC是异质性很强、高度复杂的一组疾病,具有临床复杂性和挑战性,介于可明确切除和不可切除疾病之间,在临床诊疗方案的选择方面具有复杂性,应该根据每个患者的特点制定个体化治疗方案。
03 N2期NSCLC的精准诊断
程颖教授从三个方面探讨了N2期患者的精准诊断:影像诊断——PET-CT的应用、有创诊断、分子诊断。
PET-CT应用
2020 CSCO非小细胞肺癌诊疗指南显示:高分辨率增强CT(I级推荐)是III期NSCLC分期的基础,纵隔淋巴结短径≥1cm为淋巴结阳性的标准。而PET-CT(因为价格昂贵,故作为II级推荐)可协助诊断纵隔淋巴结的性质,灵敏度为58%-94%(范围较大),特异性为76%-96%(范围较大)。肉芽肿性感染(结核)和炎性病变(结节病)均可导致PET检查假阳性。
最重要的手段之一——有创诊断:E-BUS vs纵隔镜
2020 CSCO指南中,获取组织或细胞学技术的I级推荐为纤维支气管镜、E-BUS/EUS、经皮穿刺、淋巴结或浅表肿物活检、体腔积液细胞学检查;II级推荐为电磁导航支气管镜、胸腔镜、纵隔镜。
由于CT和PET-CT会出现淋巴结假阳性和假阴性,所以当纵隔淋巴结是否转移影响治疗决策时,应通过E-BUS、纵隔镜或胸腔镜来明确淋巴结状态,建议直接行有创检查以明确淋巴结性质:若CT提示孤立性纵隔淋巴结肿大且无远处转移,或预计可进行手术的患者。
对于体积较大的N2期NSCLC(例如,CT显示短径>2-3cm、包膜外淋巴结受累、超过两站淋巴结受累)患者,不推荐常规应用微创技术。
E-BUS和纵隔镜的区别
E-BUS主要用于气管周围隆突下级双肺门淋巴结的活检。优势:定位准确、创伤小、安全性高、操作方便。局限性:只能用于大气道周围病变的探查活检、对于主动脉周围及下纵隔淋巴结(第5、6、8、9组)穿刺有困难;活检标本量少,假阴性率相对较高。
纵隔镜被认为是标准检查方法,优势:对淋巴结的诊断率高,取材量充足,能够满足诊断和基因检测需求。局限性:侵入性检查,创伤级风险组相对较大,恢复时间长;操作技术要求高,基层地区普及性差;增加纵隔再分期的技术难度和风险。
对于初始纵隔分期,与纵隔镜相比,E-BUS是首选。在目前临床实践中,E-BUS应用较广泛。
有创诊断:经皮纵隔淋巴结穿刺活检
经皮纵隔淋巴结穿刺活检目前已成为一种临床上较常用的方法,适用于支气管镜活检失败或阴性的肺门肿块、未确诊的纵隔肿块、怀疑恶性的纵隔淋巴结。在E-BUS和纵隔镜不可用的情况下,经皮纵隔淋巴结穿刺活检也是一种可选方案。
吉林省肿瘤医院于2015年开展CT引导下肺穿刺活检,累计穿刺7400多例,穿刺成功率达99%,病理诊断率达95%。
N2期NSCLC的分子诊断
2020 CSCO指南指出,在可手术I-III期NSCLC患者中,对于术后N1和/或N2阳性的非鳞癌患者进行EGFR突变检测,指导辅助靶向治疗(II级推荐,1B类证据)。

04 N2期NSCLC的治疗
可切除N2期NSCLC的治疗
2020 CSCO指南推荐首选手术(1类证据),也推荐根治性同步放化疗(1类证据)。
最佳手术方式为:肺叶切除术(包括解剖性肺叶或联合肺叶切除)+系统性纵隔淋巴结清扫。
淋巴结清扫:AJCC、UICC、IASLC建议,至少应当摘除或取样6个淋巴结/站:其中3个淋巴结应位于纵隔,包括隆突下淋巴结,3个为肺门-肺内淋巴结,以便正确的病理淋巴结分期。
今年新发表的一项回顾性研究显示,手术对比根治性同步放化疗可改善局部疾病控制,并可能提高精心选择的IIIA(N2期)患者的生存率。
辅助治疗
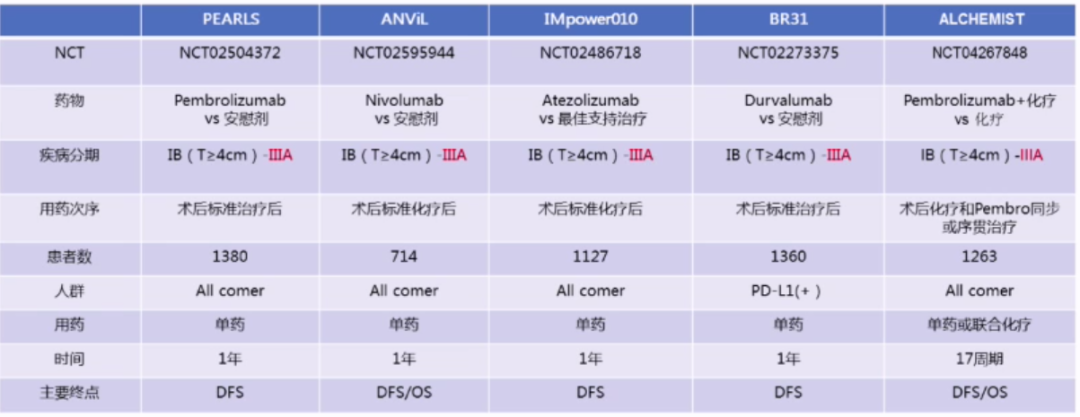
EGFR敏感突变N2期患者的辅助治疗模式可分为ADD模式(完成术后化疗后+靶向治疗,对照组为安慰剂)和OR模式(术后靶向药物辅助治疗,对照组为化疗)。
ADAURA是一项随机双盲、全球性、安慰剂对照的III期临床研究,旨在评估IB-IIIA EGFR敏感突变NSCLC患者完全切除后±辅助化疗后,分别接受奥希替尼和安慰剂辅助治疗的疗效和安全性。今年ASCO大会上,ADAURA研究提前公布结果,研究纳入682例患者,N2患者占34.4%,奥希替尼和安慰剂组分别为339例和343例患者,II-IIIA期患者的无病生存期(DFS)HR为0.17(P<0.0001),总人群的DFS HR为0.21(P<0.0001)。
今年ASCO大会上,ADJUVANT研究公布最终结果,完全切除的II-IIIA期(N1-N2)EGFR敏感突变NSCLC分别接受吉非替尼和化疗辅助治疗,主要终点为DFS。结果显示,研究纳入220例患者,N2患者占64.4%,ITT人群中,吉非替尼组和化疗组的中位DFS分别为30.8个月和19.8个月(HR=0.56,P=0.001)。
EVAN研究是一项前瞻性、开放标签、随机多中心Ⅱ期临床研究,旨在评估厄洛替尼对比化疗辅助治疗用于IIIA期NSCLC完全切除患者的疗效和安全性。主要终点为2年DFS率。结果显示,研究纳入102例患者,N2患者占94%,ITT人群中,厄洛替尼组和化疗组的2年DFS率显著提高,分别为81.4%和44.6%(P <0.001),中位DFS分别为42.4个月和20.9个月(HR=0.268,P <0.001)。
无基因突变N2免疫或靶向辅助治疗有多项研究正在进行中
潜在可切除N2期NSCLC的治疗
2020 CSCO指南:对于这部分患者,根治性同步放化疗作为主要治疗方案仍未动摇,对于可手术患者新辅助治疗联合手术可作为治疗选择之一。
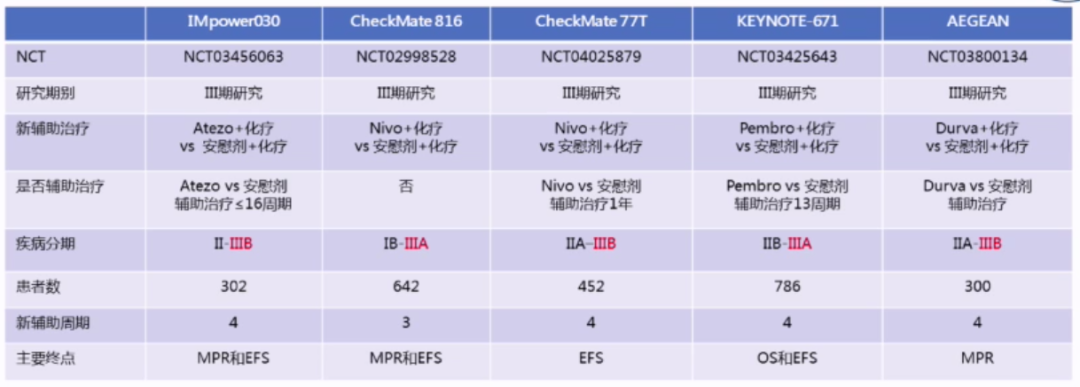
新辅助治疗
新辅助治疗模式(单纯化疗、序贯放化疗、同步放化疗、化疗后同步放化疗、靶向和免疫治疗无基础的治疗)需要进一步探讨和研究。
在潜在可切除N2期患者中,新辅助免疫治疗是研究热点:从研究数据中我们发现,IO+化疗新辅助治疗的疗效更好,IO+放化疗需要更大样本量的研究。此外,新辅助免疫治疗不会延迟手术,3级以上不良事件发生率低。
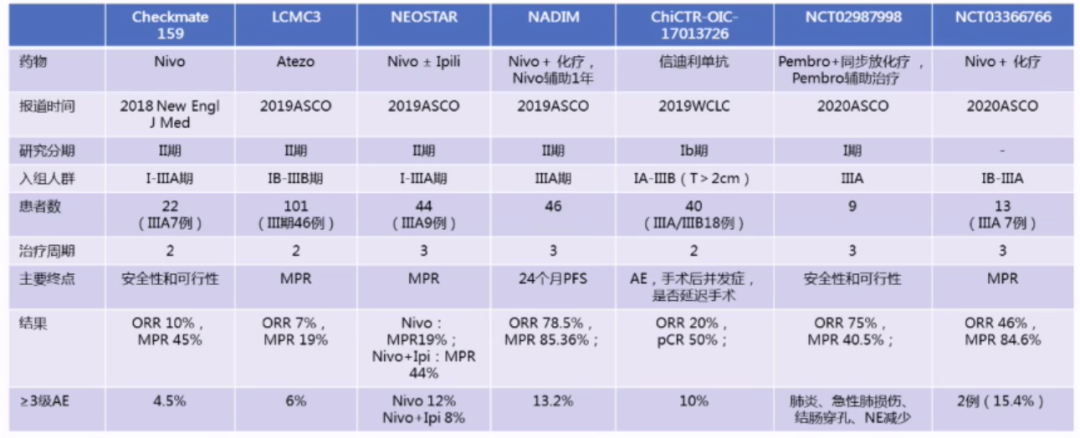
SAKK16/14研究是一项仅针对N2期NSCLC患者(T1-3N2-M0)单臂II期研究,旨在评估度伐利尤单抗+化疗新辅助治疗用于N2期患者的疗效和安全性,今年ASCO大会上公布了结果,研究纳入68例患者,新辅助方案为顺铂+多西他赛(3个周期,q3w),序贯度伐利尤单抗治疗(2个周期),术后继续给予度伐利尤单抗(q2w)治疗1年。主要终点为1年无事件生存率(EFS)结果显示,67例可评估患者的1年EFS为73.3%。
对于潜在可切除N2期患者,新辅助免疫治疗研究正在进行中,可以发现,新辅助免疫治疗后给予免疫辅助治疗是未来发展趋势,辅助治疗时间一般为1年左右。
不可切除N2期NSCLC的治疗
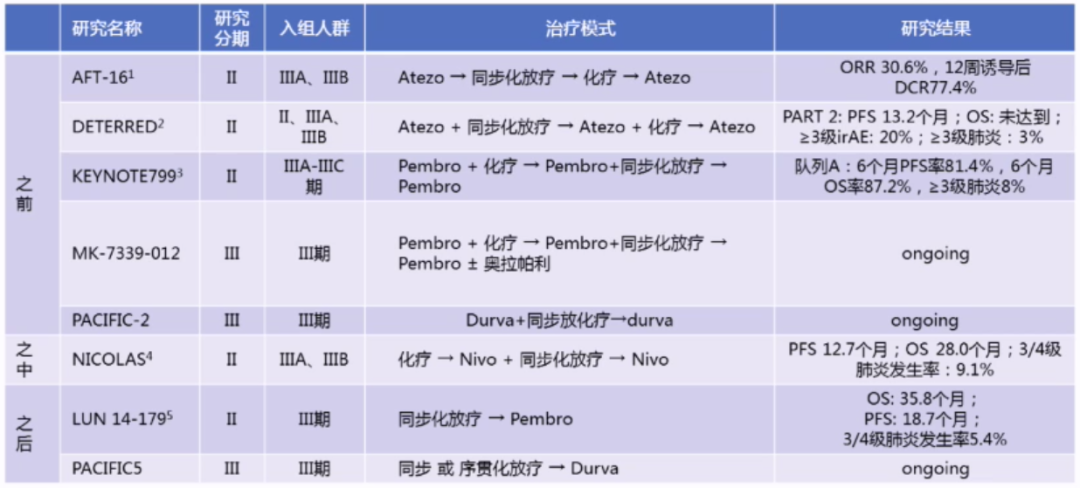
PACIFIC研究改变了不可切除N2期NSCLC患者的治疗格局,度伐利尤单抗可用于不可切除III期NSCLC患者同步放化疗后的巩固治疗,今年CSCO指南将此适应证由II级推荐上升为I级推荐。
新PACIFIC研究模式(免疫治疗用于同步放化疗之前、之中和之后)——目前正在开展多项研究:
05 N2期NSCLC患者的全称管理
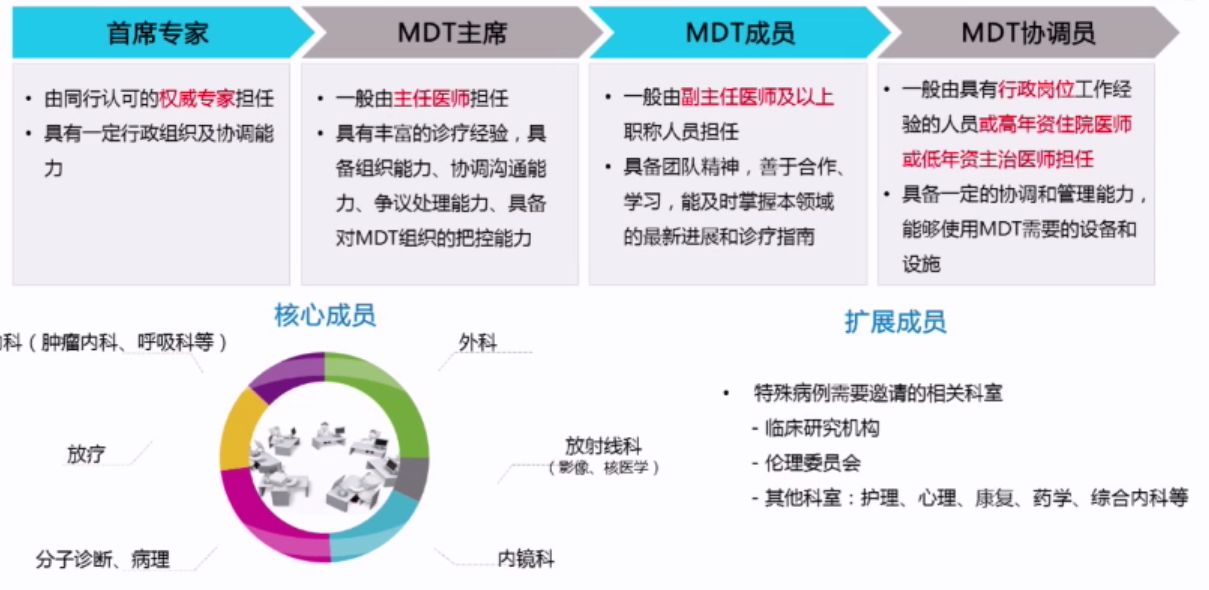
MDT在N2期NSCLC的诊治中发挥着重要作用,N2期患者均应进行MDT会诊,由MDT委员会讨论合适的治疗方案,以便为每个患者提供最佳的治疗选择,并取得最佳的结果。