没有最好, 只有更好: “闲不住”的科学家在研发新型PD-1抗体
人类与癌症的抗争,已经持续了近百年。
直到21世纪,一支奇兵杀入,将癌症治疗带入“免疫治疗”新时代:
2002年
科学家通过小鼠实验,第一次发现“阻断PD-1可有效抑制肿瘤生长”;
2012年
PD-1抗体用于癌症患者的临床数据公布,黑色素瘤、肺癌、肾癌都有效;
2016年
美国FDA批准PD-1抗体用于晚期恶性黑素瘤患者;
2018年
首个PD-1抗体O药登陆中国,惠及国内患者;
2020年
国内已经批准8种PD-1/PD-L1抗体药物,适应症包括肺癌、胃癌、食管癌、黑色素瘤、霍奇金淋巴瘤等,众多癌症患者获益。
然而,科学无止境,没有最好,只有更好。
“不满足于现状”的科学家们还在努力探索,设计新的PD-1药物,也在寻找类似PD-1的抗癌新靶点,给全世界的癌症患者带来新希望。
今天,我们的主题就是科学家们针对“新型PD-1”进行的探索。
1
狡兔三窟:M7824同时阻断
PD-1和TGF,疗效更好?
今天我们介绍的第一款新型PD-1,也是我们的老朋友了,过去的文章中我们曾经介绍过它的名字:M7824。
虽然只是一个药物代号,但M7824实实在在的开辟了全新的免疫治疗路线:多线路抑制免疫检查点,也就是把癌细胞逃避免疫追杀的线路完全堵死。
简单说来,PD-1实际上就是癌细胞的一条“逃生通道”,而PD-1抗体的作用,就是堵死这个通道,进而杀死癌细胞。
然而和我们斗了上千年的癌细胞并不简单,截止目前,我们已经发现了癌细胞的数条“逃生通道”:例如LAG-3、TIM-3、TGF-&β;等。所以,单独阻断PD-1这一条逃生通道,效果肯定不理想(癌细胞又不傻,PD-1这条路不通,可以走其它路,狡兔还有三窟呢,何况癌细胞是个“大魔王”)。
基于此,科学家们设计了一种新型的PD-1抗体药物M7824:同时阻断PD-L1和TGF-b这两条“逃生通道”,具体如下图:
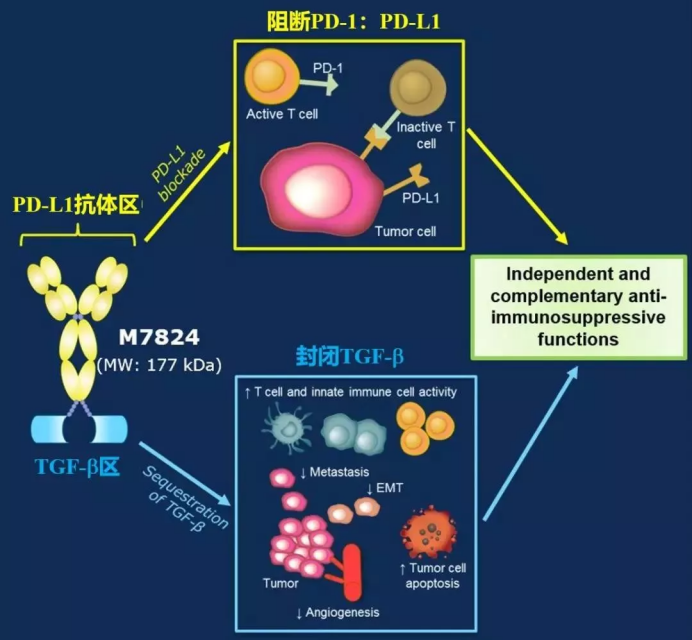
这个药物,不少咚友都比较熟悉,坊间一直称之为“二代PD-1”。目前,M7824已经公布了多项早期临床试验数据,效果都还不错,初步“优于”PD-1单药的临床数据。
2020年2月,M7824公布了针对晚期非小细胞肺癌患者的一期临床数据:
针对PD-L1高表达患者:1200mg的高剂组,客观缓解率85.7%,比单用PD-1抗体的40-50%要高很多。
针对80名入组的全部患者来说:总体有效率只有21.3%,跟PD-1单药的数据差不多。
所以,这个“二代PD-1”能否真能战胜PD-1,还需要更多数据支撑。或许,将来通过筛选PD-L1和TGF-&β;高表达人群,可以展现其天然设计优势。
关于M7824的详细数据,参考咚咚之前的文章:
2
PD-1共价蛋白药物
通透性更好,成本更低
目前,市场上的PD-1/PD-L1药物都是抗体类药物。有科学家突发奇想,人为的设计了一个“非抗体类”的药物。
具体来说,是在PD-1蛋白中定点引入了一个非天然的氨基酸残基FSY,这个残基能够在PD-1与PD-L1发生特异性结合的时候与PD-L1发生不可逆的共价交联,从而阻断PD-L1与T细胞表面的PD-1相互作用。
通俗的说,PD-1抑制剂的作用是在PD-1这把钥匙与PD-L1这把锁相互结合的时候把PD-1这把钥匙直接砸了;而这种“非抗体”钥匙,是找到另一把钥匙提前和PD-L1结合,占据位置。
为了验证疗效,这位科学家在人源化小鼠中进行实验,发现这种新型共价蛋白药物的抗肿瘤效果与传统PD-L1单抗相当,甚至更高(图2)。
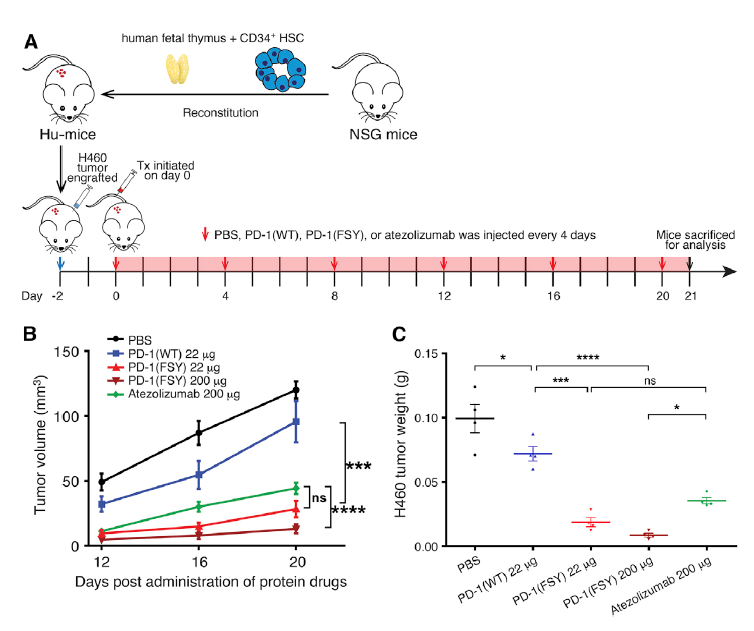
更重要的是,这种新型共价蛋白药物分子大小仅约为单抗药物的1/10,并且仅通过大肠杆菌就可以大量生产,制备成本远低于传统单抗。
3
CTLA-4抗体
改造后,副作用更低
CTLA-4单抗可以说是免疫治疗药物的鼻祖,是FDA最早批准的免疫治疗药物,也就是是PD-1单抗的 “大哥”。
然而,由于疗效有限+副作用较大,大哥并不如PD-1这个小弟这样风光无限。但另一方面,大家发现CTLA-4单抗与PD-1单抗联用能够显著提升的肿瘤治疗效果,这让科学家们也不甘轻易放弃CTLA-4这个靶点。
经过不断研究,大家发现CTLA-4单抗的免疫治疗效果并非通过阻断CTLA-4与配体的结合,而是通过抗体介导的细胞杀伤(ADCC)来清除肿瘤中的调节型T细胞(Treg)。也就是说,它的效果并不像PD-1抑制剂这般彻底。
因此,科研人员在已有的CTLA-4单抗的基础上进行改造,通过一系列复杂的改造,新型的CTLA-4抑制剂诞生了。
新型的CTLA-4抑制剂能让外周的Treg不会因为CTLA-4的降解而无法抑制自身免疫,从而减少免疫治疗的副作用;肿瘤中高表达CTLA-4的Treg在CTLA-4抗体结合情况下发生ADCC被清除从而增强肿瘤免疫。
简单说来,也就是新型的CTLA-4抑制剂明显降低了副作用,同时增强了它的疗效,成了免疫治疗中的一支“潜力股”。
小鼠模型中,原本具有严重副作用的CTLA-4抗体经过改造后显著减少了免疫治疗相关副作用,同时抗肿瘤效果也有显著提高(图3)。
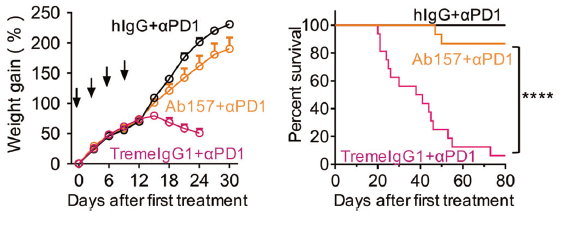
4
“益生菌”转移免疫检查点阻断纳体
除了改造药物,科学家们也在优化给药方式,以达到增强疗效或者降低副作用的目的。
在近期的一项研究中,科学家使用了一个大家都想不到的给药系统:“细菌”,结果也是出人意料的不错。
具体的操作步骤也非常“黑科技”。
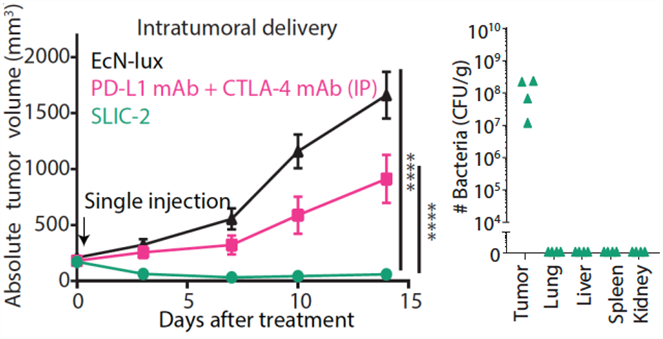
科学家通过基因工程的手段改造了一种对人体无害的大肠杆菌菌株Nissle1917,给它添加了一种“超能力”:它可以自行合成PD-1抗体和CTLA-4抗体。
试想一下,如果在人体内尝试了这种黑科技,就有一群辛勤的细菌们在不断生产PD-1抑制剂和CTLA-4抑制剂,成了一个“免疫药物工厂”,源源不断的免疫治疗药物在患者体内不断产生,这将带来多大的疗效!
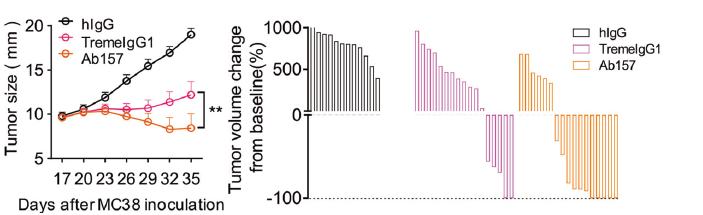
科研人员在小鼠中验证了这种“益生菌”的抗肿瘤能力,在经过单次肿瘤局部注射后,这种菌能够在小鼠肿瘤内至少持续两周发挥功能。并且这种“益生菌”主要在肿瘤部位富集,而不会影响正常组织。与传统抗体治疗相比,“益生菌”疗法的疗效也明显更好(图4)。
“疯狂”的科学家们还在不断探索新的免疫治疗道路,也正是有了他们,我们的肿瘤治疗道路才会如此的一帆风顺,向他们致敬!
同时,我们也坚信,正是基于这些不断更新的前沿医学技术,我们离真正攻克癌症的时间,已经不远了!
参考文献:
[1]. Li,Q. et al. Developing Covalent Protein Drugs via Proximity-Enabled ReactiveTherapeutics. Cell 182, 85-97 e16, doi:10.1016/j.cell.2020.05.028(2020).
[2]. Zhang,Y. et al. Hijacking antibody-induced CTLA-4 lysosomal degradation for safer andmore effective cancer immunotherapy. Cell Res 29, 609-627,doi:10.1038/s41422-019-0184-1(2019).
[3]. Gurbatri,C. R. et al. Engineered probiotics for local tumor delivery of checkpointblockade nanobodies. Sci Transl Med 12, doi:10.1126/scitranslmed.aax0876(2020).