安罗替尼通过阻断VEGFR2/PI3K/AKT信号通路抗肝内胆管癌的机制研究
复旦大学附属中山医院肝肿瘤外科杨欣荣教授团队和南通大学附属医院陈钟教授团队携手发起一项探索安罗替尼在肝内胆管癌(ICC)的应用潜力和作用机制的基础研究,在ICC细胞和肿瘤异种移植的小鼠模型中评估安罗替尼在ICC的抗肿瘤作用,并发现该作用是通过阻断VEGFR2/PI3K/AKT信号通路来实现的。该研究结果发表在近期的Cell Death and Disease杂志中。
Fei Song, Bo Hu, Xin-Rong Yang, et al. Cell Death and Disease(2020) 11:573
摘要
肝内胆管癌(ICC)是源自胆管上皮的恶性肿瘤,其特点是手术后易复发或转移。常用的化疗和分子靶向药物治疗ICC的疗效亟待提高。安罗替尼是一种新型的多靶点酪氨酸激酶抑制剂,在多种实体瘤中展示出良好的抗肿瘤作用,但安罗替尼在ICC中的应用及其相关机制的研究甚少。通过体外实验,我们发现安罗替尼能显著抑制肿瘤细胞增殖、迁移、侵袭,并且阻滞细胞周期;另外,安罗替尼能诱导细胞凋亡,并促进间质-上皮转化。在ICC患者来源肿瘤异种移植的小鼠模型中,安罗替尼也能显著抑制肿瘤生长。进一步探索安罗替尼的作用机制发现,安罗替尼治疗后VEGF/PI3K/AKT通路相关激酶的磷酸化水平明显降低,安罗替尼可能主要通过阻断VEGF/PI3K/AKT信号通路抑制肿瘤细胞增殖、侵袭以及阻滞细胞周期引起凋亡,抑制血管内皮生长因子受体2(VEGFR2)磷酸化从而抑制下游PI3K/AKT信号传导,来发挥其抗肿瘤效应。我们还进一步明确了VEGFR2是安罗替尼的主要靶点,VEGFR2高表达有可能成为安罗替尼疗效预测指标。本研究结果表明,安罗替尼在ICC中具有优异的抗肿瘤活性,主要是通过抑制VEGFR2的磷酸化进而使PI3K/AKT信号传导失活来进行的。该研究为安罗替尼用于ICC的临床治疗提供了初步证据和理论支持。
背景
肝内胆管癌(ICC)是发病率仅次于肝细胞癌的肝脏原发恶性肿瘤,全球ICC的发病率和死亡率在迅速增加[1-3]。手术切除是ICC患者主要的治疗方法,但术后较高的复发率或转移率(约70%)导致患者总生存期较短(5年OS率<30%)[4-6]。大多数ICC患者在初诊时已失去手术机会或出现远处转移,标准治疗方案是铂类联合吉西他滨,但患者的生存获益并不明显[7]。因此,迫切需要寻找更好的治疗方法。
安罗替尼是一种多靶点酪氨酸激酶抑制剂(TKI),在多种实体瘤中具有抗肿瘤作用[8]。安罗替尼抑制肿瘤生长通过抑制血管生成和细胞增殖[9,10]。II期和III期的临床试验发现,安罗替尼对非小细胞肺癌,肝癌,肾癌,胃癌,和软组织肉瘤都有效[8,11,12]。抗血管生成药物(例如,瑞戈非尼,仑伐替尼和阿帕替尼)在胆管癌动物模型和胆管癌患者中均有抗肿瘤作用[13-15]。对于无法切除的ICC患者在疾病进展后,安罗替尼可能是一个新的治疗手段,可能会延长患者PFS和OS。该研究是首次对安罗替尼在ICC的疗效及其可能的分子机制进行研究,为安罗替尼的临床应用提供证据。
主要方法
体外实验是在ICC细胞系HCC9810和RBE中进行,检测安罗替尼处理后肿瘤细胞集落形成(细胞克隆实验)及细胞的增殖能力(使用细胞计数试剂框CCK8检测法)、迁移能力(使用划痕实验)、侵袭能力(使用Transwell实验),使用流式细胞术检测安罗替尼对细胞周期和凋亡的调控。敲低VEGFR的表达使用siRNA,siNC为阴性对照。
体内试验是在患者来源肿瘤异种移植小鼠(PDX)模型中进行。将6组不同患者来源的ICC肿瘤组织植入到非肥胖型糖尿病/严重合并免疫缺陷小鼠的皮肤下,经过两代小鼠传代扩增后,待肿瘤体积达到100–200mm³后,将每种患者来源的PDX小鼠随机分为两组:(1)PBS对照组(2)安罗替尼组。第18天后,收集肿瘤组织,测量重量和体积。
结果
安罗替尼抑制ICC细胞生长并促进细胞凋亡
人源ICC细胞系(HCCC9810和RBE)分别用浓度为0、5、10和20μM的安罗替尼孵育24、48或72小时,发现安罗替尼以剂量或时间依赖性的方式显著抑制肿瘤细胞的生长(图1A和1B),显著抑制HCCC9810和RBE肿瘤集落的形成(图1C)。安罗替尼也可以显著提高两种ICC细胞系的凋亡率(图1D),可以诱导这两种细胞系出现G2 / M期阻滞,G1期细胞数量减少(图1E)。
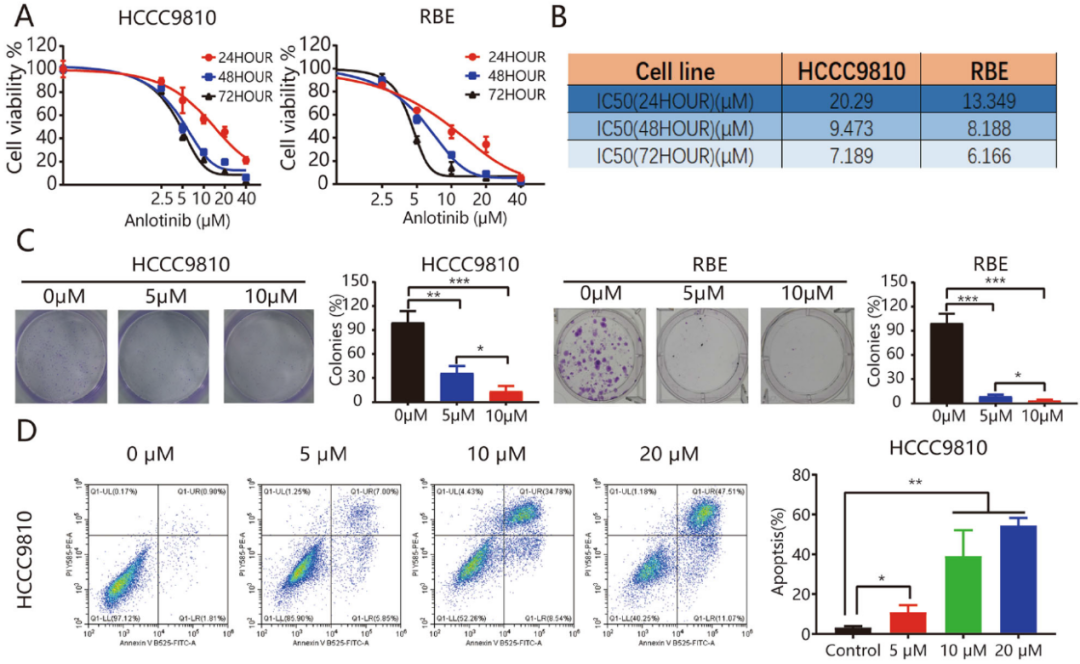
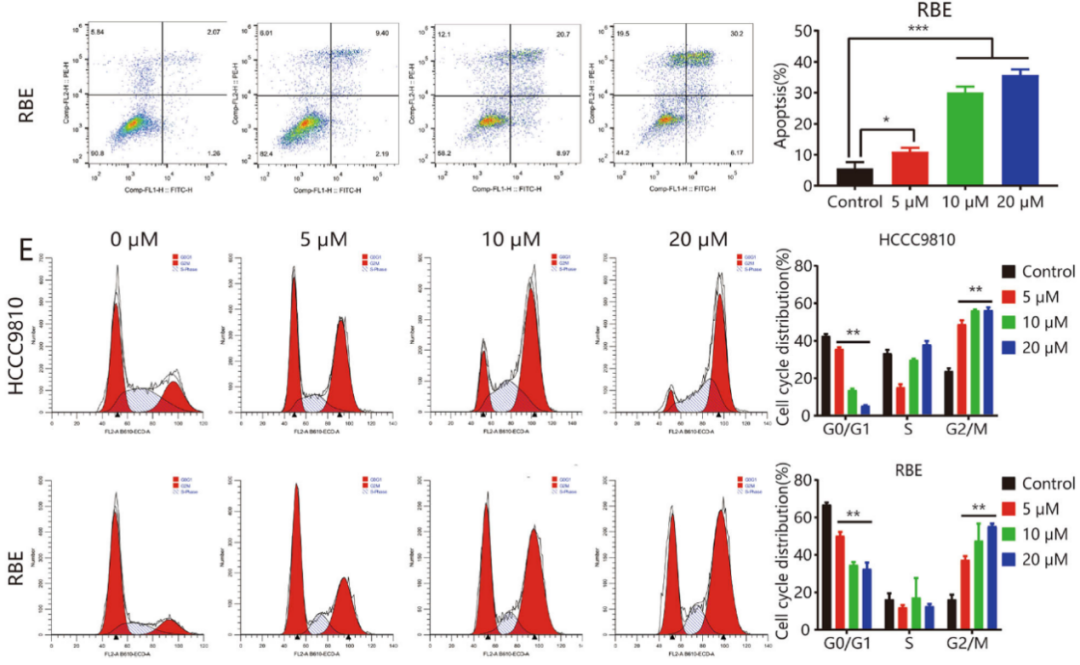
图1:安罗替尼抑制ICC细胞系的生长和侵袭,促进细胞凋亡。A和B. HCCC9810和RBE细胞用所示浓度的安罗替尼处理24、48或72h。使用CCK8测量细胞存活,并计算IC 50值;C. 集落试验的代表性图像;D. 在安罗替尼处理48小时后,测量RBE和HCCC9810细胞中凋亡的比例。E. 特定浓度的安罗替尼处理24小时,用流式细胞仪进行分析。每个实验重复三次。*P<0.05;**P<0.01。
安罗替尼通过抑制上皮-间质转化(EMT)抑制ICC细胞的迁移和侵袭
划痕实验和Transwell实验结果表明,安罗替尼可以显著抑制HCCC9810和RBE细胞的迁移,减少迁移/侵袭细胞的数量(图2A-C)。检测EMT标记物的mRNA和蛋白水平的表达,HCCC9810和RBE细胞用安罗替尼处理后出现N-钙粘蛋白、波形蛋白、&α;SMA、CK19表达下调,E-钙粘蛋白(上皮细胞标记物)表达上调(图2D,2E和补充图1)。以上结果表明,安罗替尼通过抑制EMT抑制了ICC细胞的迁移和侵袭。
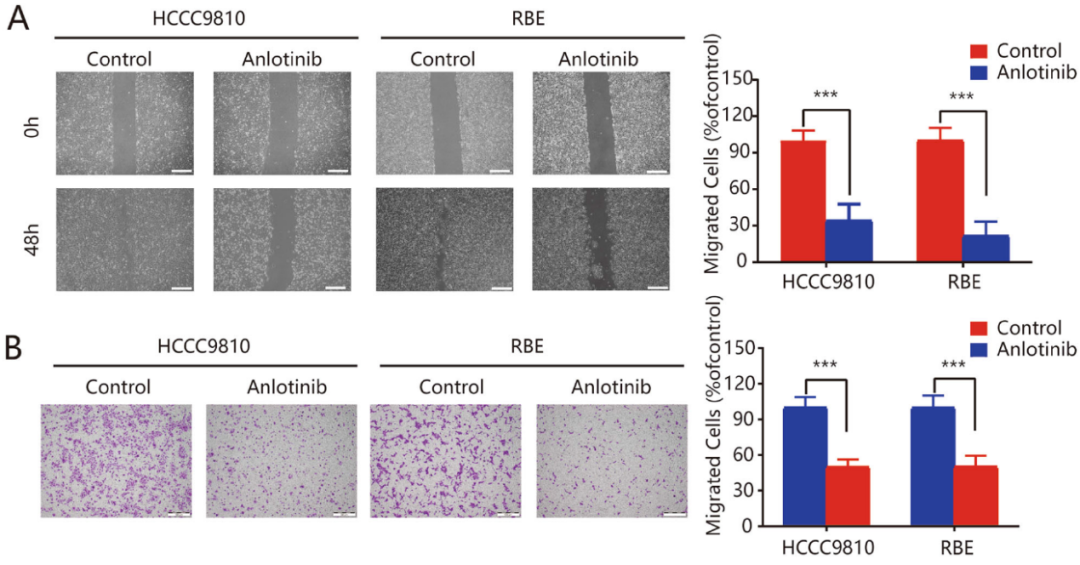
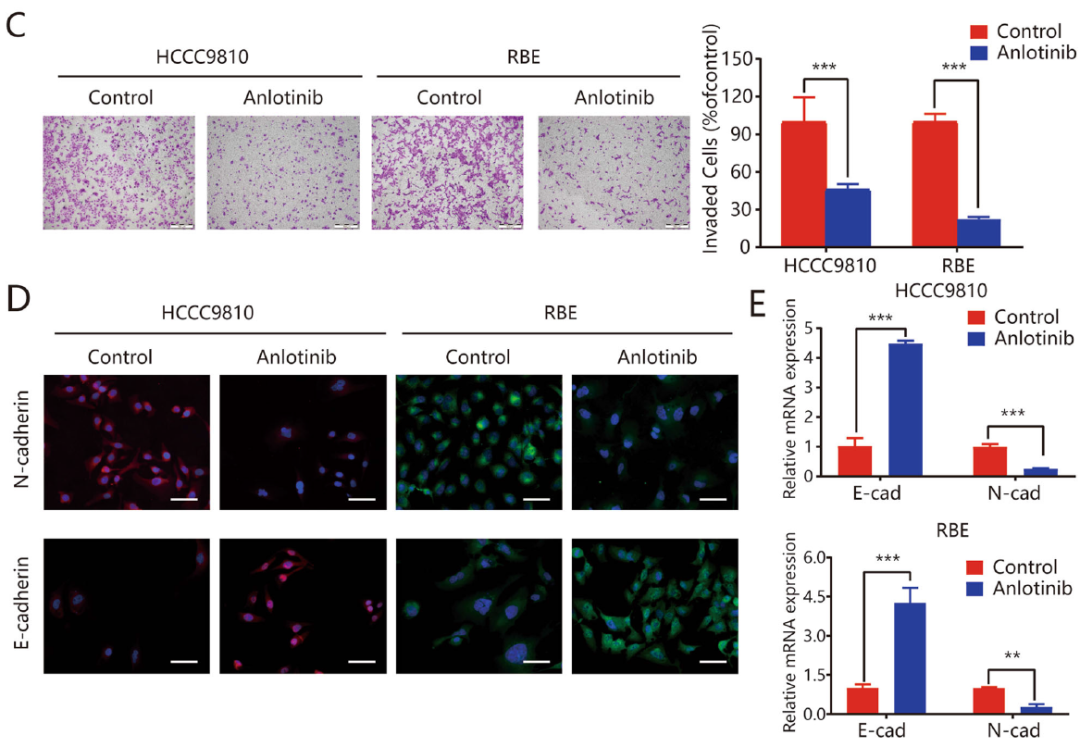
图2:安罗替尼通过抑制EMT来抑制ICC细胞的迁移和侵袭。在不使用基底胶(B)和使用基底胶(C)的情况下,用划痕(A)和Transwell实验测量安罗替尼对细胞侵袭和迁移的影响;D. 经安罗替尼处理后,采用免疫荧光染色法分析HCCC9810和RBE细胞中E-钙粘蛋白和N-钙粘蛋白标记的表达和定位。E. 使用qRT-PCR检测ICC细胞系EMT标志物(E-钙粘蛋白和N-钙粘蛋白)。*P<0.05;**P<0.01;***P<0.001。比例尺=100μm。
在ICC肿瘤异种移植(PDX)模型中,安罗替尼显示出有效的抗肿瘤活性和较低的药物毒性
构建六个ICC PDX模型,进一步探索安罗替尼的抗肿瘤活性(图3A)。六个PDX模型的平均肿瘤抑制率(TGI)分别为118.20%、106.30%、99.20%、87.40%、87.10%和73.00%(总平均值为95.20%;图3B)。在6个PDX模型中,对比对照组,安罗替尼组小鼠的肿瘤重量显著减少(图3C),肿瘤体积显著缩小(图3D),肿瘤组织中坏死灶增多(图3E)。同时,安罗替尼的治疗对小鼠体重没有显著影响,对小鼠食欲、泻腹或精神状态也没有显著改变。综上所述,安罗替尼在体内具有有效的抗肿瘤活性和较低药物毒性。
检测六个PDX模型中肿瘤细胞增殖、凋亡指数和EMT的生物标志物(图3F),安罗替尼组的肿瘤细胞增殖率显著下降,凋亡指数增加,并能导致N-钙粘蛋白表达显著下调、E-钙粘蛋白表达上调。这些结果与体外实验结果均一致。
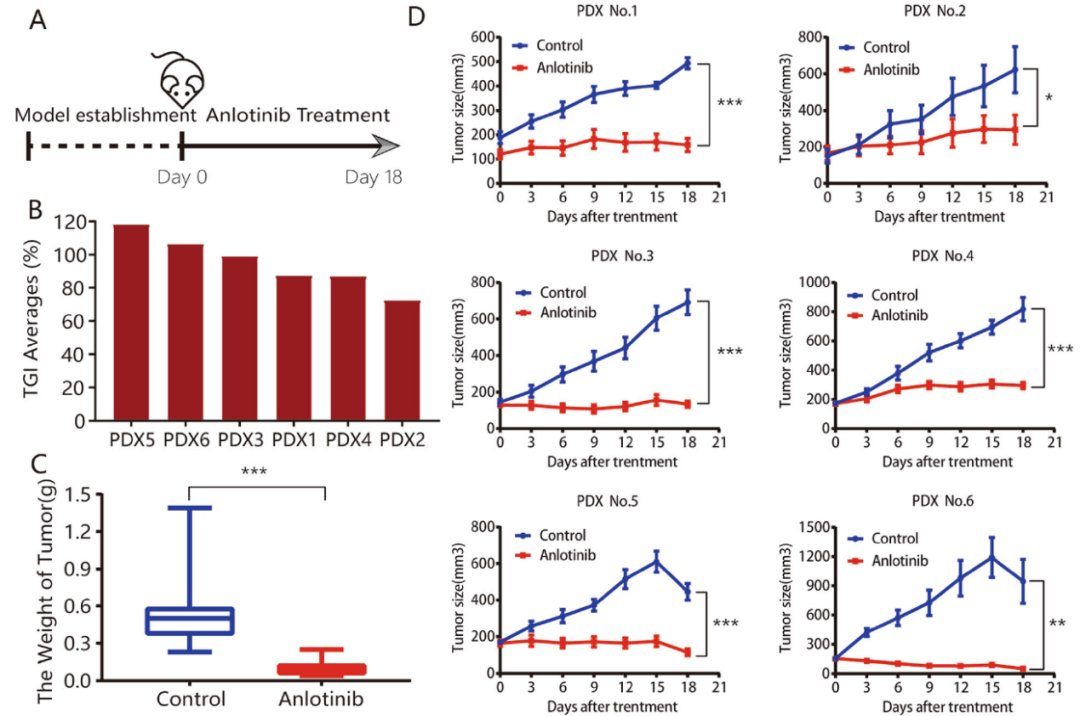
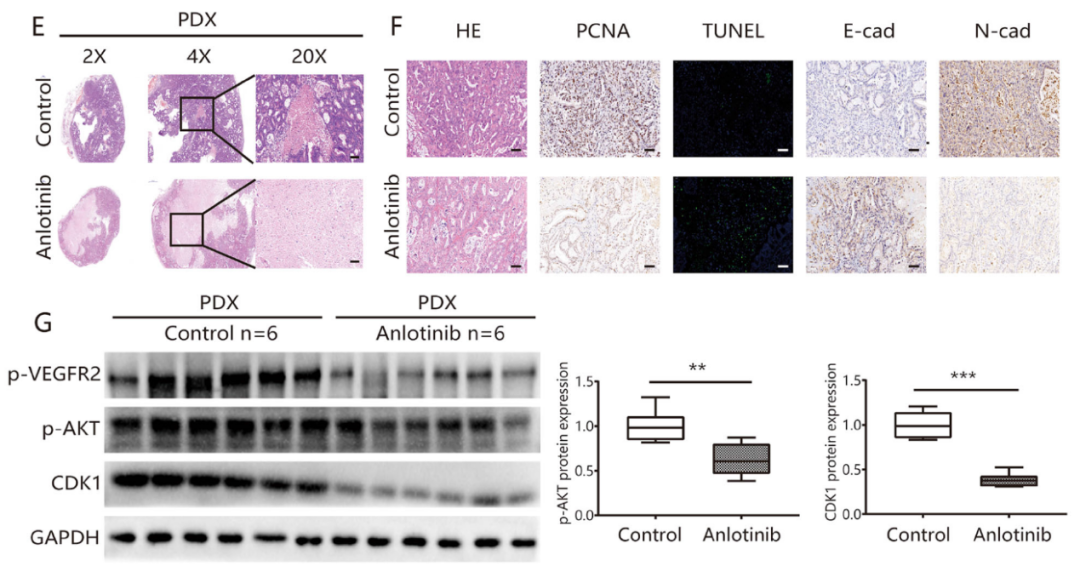
图3:在PDX模型中,安罗替尼显示出有效的抗肿瘤活性,且药物毒性低。A. 小鼠体内实验过程;B. 在六个PDX模型中安罗替尼治疗反应的瀑布图;C. 安罗替尼组与对照组之间的肿瘤重量存在显著差异(分别为0.58±0.08和0.10±0.01);D. PDX模型的肿瘤生长曲线;E. PDX模型中的肿瘤组织的HE染色; F. 与对照组相比,安罗替尼组的增殖(PCNA)速率显着降低,而凋亡(TUNEL)指数则升高,安罗替尼组E-钙粘蛋白的表达显著下调,而N-钙粘蛋白的表达上调;G. Western Blot检测PDX模型中VEGFR2、P-AKT、CDK1的蛋白表达。*P<0.05;**P<0.01;***P<0.001。比例尺= 100μm。
转录组分析表明,安罗替尼调控ICC细胞的VEGF/PI3K/AKT信号通路
HCCC9810和RBE细胞用5μM 浓度的安罗替尼处理24小时后,对其总RNA进行深度测序和富集分析,安罗替尼组的维恩图显示有上调或下调的基因(调整后的P值<0.05,倍数变化=2.0)(图4A)。根据这些改变的基因进行KEGG富集分析,结果显示富集最显著的是细胞周期信号途径(图4B)。进行基因集富集分析发现安罗替尼组中细胞周期信号通路和VEGF信号通路都发生了富集改变(图4C)。
为了进一步识别安罗替尼组中基因共表达的模式,使用加权基因共表达网络分析算法构建基因共表达网络[16,17]。结果显示,与安罗替尼组表型高度相关的红色和黑色模块中(图4D),基因富集在与细胞周期密切相关的VEGF和PI3K/AKT信号通路中(黑色模块中24/66,红色模块中20/87)。结合本研究的结果和历史研究结果[18,19],说明安罗替尼参与阻断VEGF/PI3K/AKT信号通路。
本研究还检测了安罗替尼主要靶点的磷酸化水平[20]。与对照组相比,安罗替尼组VEGFR2和AKT的磷酸化水平显著降低(图5A),FGFR1和PDGFR-&β;的磷酸化水平无显著差异。在影响细胞周期相关蛋白表达的方面,安罗替尼组中CDK1(cyclin-dependent kinases)、cyclin A、cyclin B1、Bcl-2和Survivin的表达显著降低,而p21 Waf1/Cip1和Bax的表达显著升高(所有P<0.05;图5B)。以上结果表明,安罗替尼通过阻断VEGF/PI3K/AKT信号通路,阻滞细胞周期,抑制肿瘤细胞的增殖和侵袭,并促进细胞凋亡。
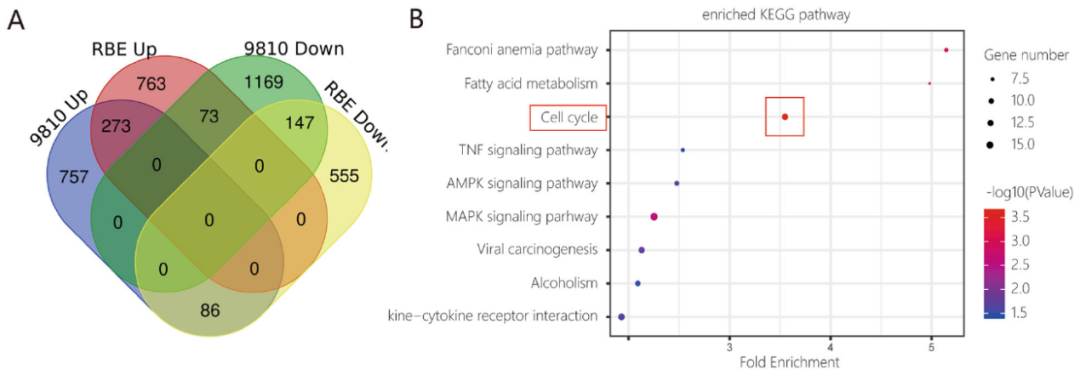
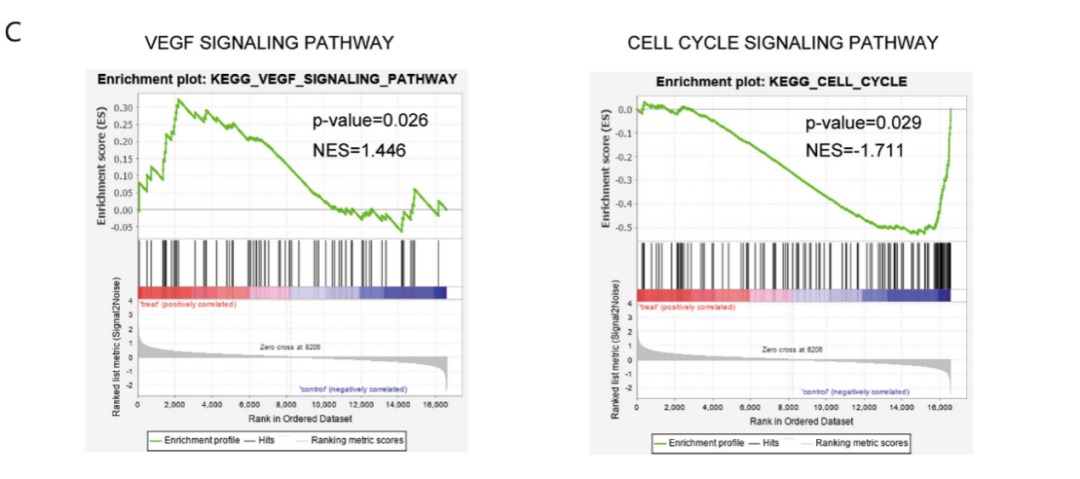
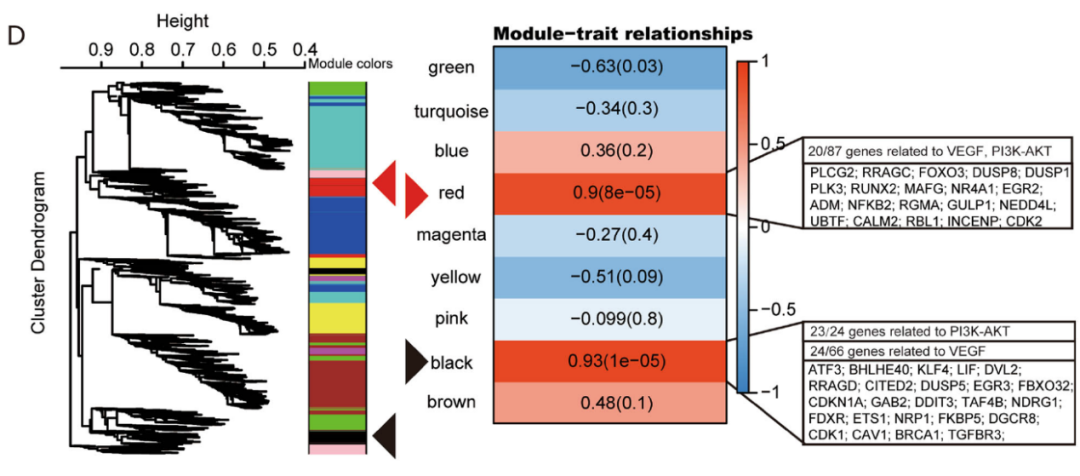
图4: 转录组分析表明,安罗替尼调控ICC细胞是通过VEGF/PI3K/AKT信号通路。A. 维恩图显示了上调/下调的常见基因(调整P值<0.05,倍数变化=2),安罗替尼组HCCC9810和RBE细胞细胞系共有420个基因(上调273个基因,下调147个基因)。B. 基于差异表达基因的KEGG富集分析;C. 对这两种细胞系的mRNA表达谱的基因集富集结果表明,安罗替尼组ICC的细胞周期和VEGF信号通路显著改变。D. 运用加权基因共表达网络分析算法构建基因共表达网络,结果显示了安罗替尼组表型高度相关的两个模块:黑色模块(相关性:0.93,P<0.01)和红色模块(相关性:0.90,P<0.01)。这两个关键模块中的基因主要富集于VEGF和PI3K/AKT信号通路。
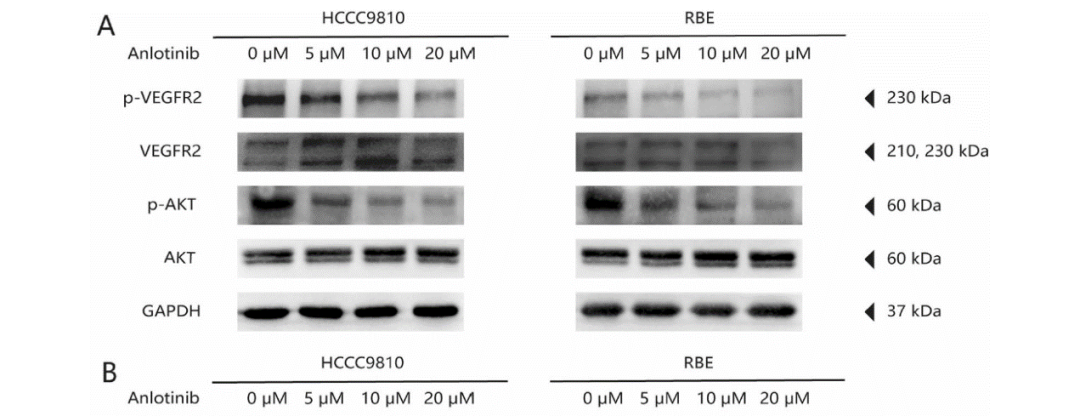
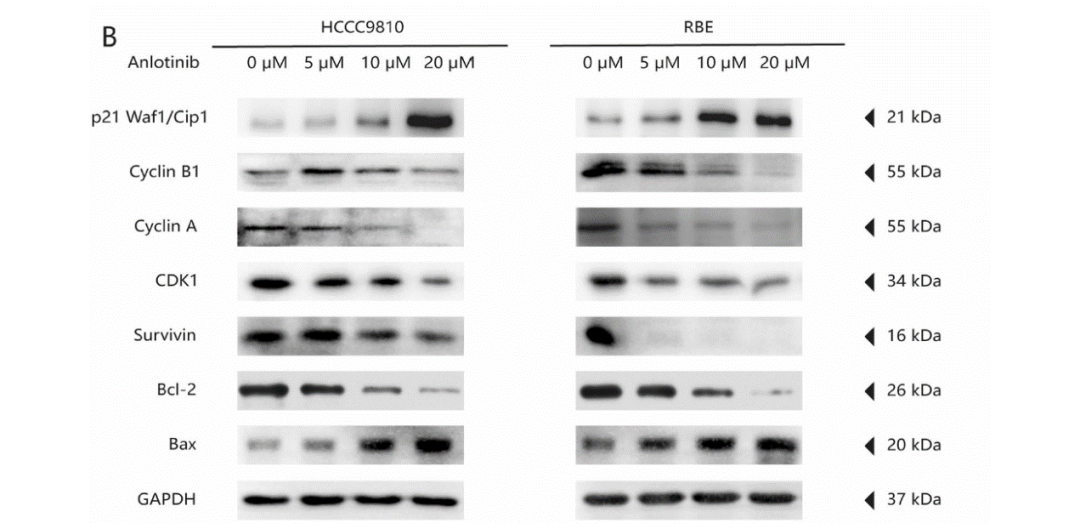
图5: 安罗替尼影响VEGF/PI3k/AKT信号通路。A. 使用western blot检测不同浓度的安罗替尼处理后ICC细胞系中VEGFR2和AKT的蛋白表达和磷酸化水平;B. 不同浓度的安罗替尼处理24小时后,使用western blot检测ICC细胞系中细胞周期相关蛋白和凋亡相关蛋白的表达。
安罗替尼通过抑制ICC细胞中VEGFR2磷酸化水平抑制PI3K/AKT信号通路
基于转录差异表达基因的分析结果,验证VEGFR2在安罗替尼抗肿瘤过程中的作用。研究发现安罗替尼可以逆转rhVEGF(重组人源化VEGF)介导的ICC细胞增殖、迁移和侵袭;敲低VEGFR2表达能阻断安罗替尼对ICC细胞的作用(图6A–C)。研究发现在两种ICC细胞中,安罗替尼逆转VEGF诱导的VEGFR2和AKT的磷酸化,进而调节下游信号通路中相关蛋白的表达,如E-钙粘蛋白和Bax表达上调,N-钙粘蛋白、Bcl-2、Survivin和CDK1表达下调(图7A)。另外,敲低VEGFR2表达可以逆转安罗替尼的作用(图7A)。这些结果表明,安罗替尼主要通过VEGFR2/PI3K/AKT信号通路抑制ICC细胞的增殖、迁移和侵袭。
PDX肿瘤模型的结果表明,与对照组相比,安罗替尼组中VEGFR2和AKT的磷酸化水平以及CDK1的蛋白表达水平显著降低(图3G)。安罗替尼治疗前VEGFR2的表达与安罗替尼治疗后的TGI显著正相关(r=0.671,P=0.046)。
本研究证明安罗替尼主要是通过抑制VEGFR2磷酸化和AKT磷酸化,诱发下游信号通路中蛋白表达的改变,进而抑制肿瘤细胞增殖、侵袭,并且促进凋亡(图7B)。
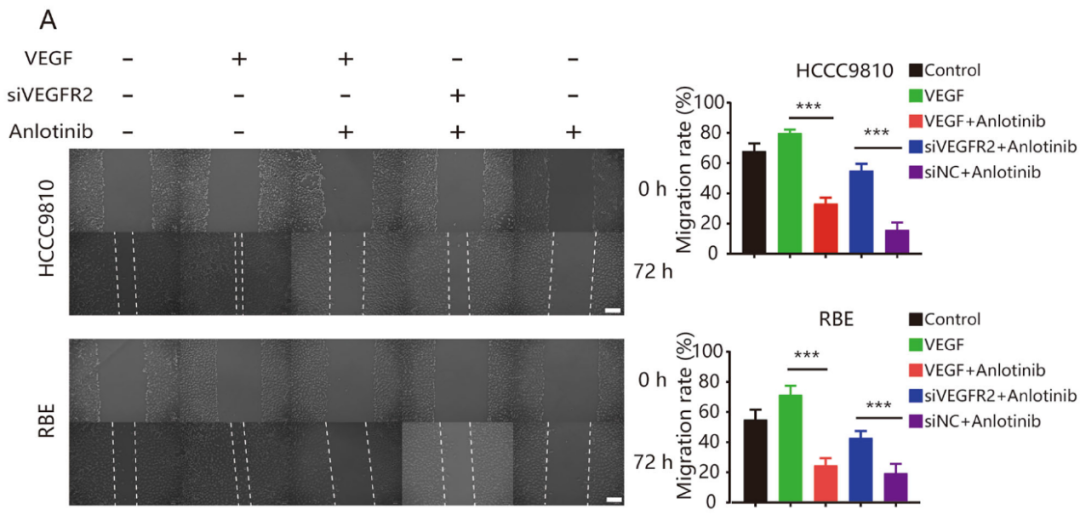
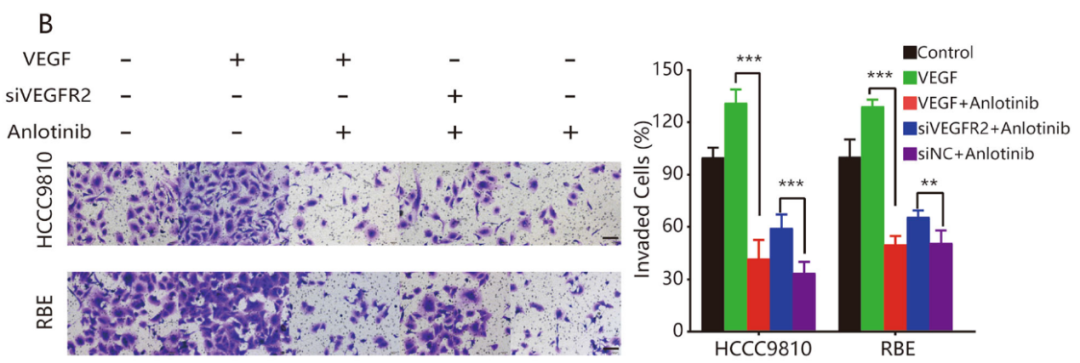
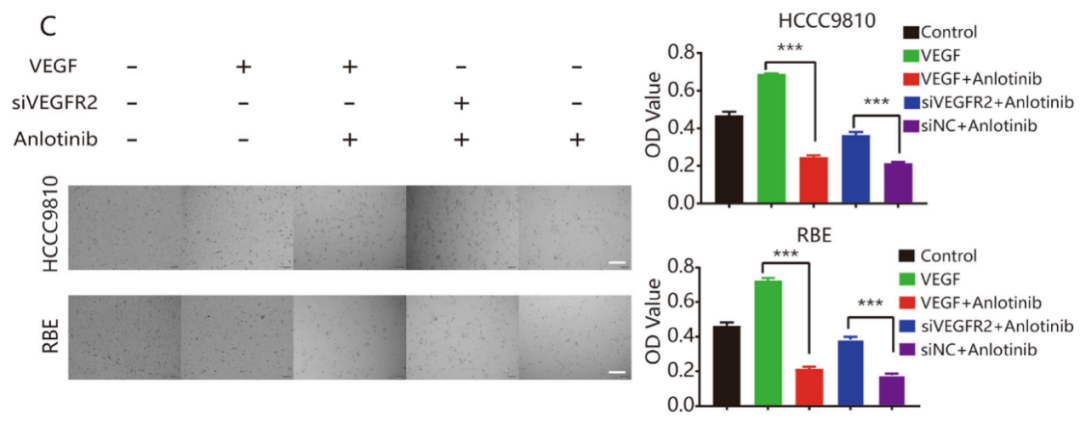
图6:安罗替尼的抗肿瘤活性主要取决于VEGFR2。A. 划痕试验显示VEGFR2表达在安罗替尼抗细胞迁移作用,在HCCC9810和REB ICC细胞系中使用siVEGFR2时,安罗替尼对细胞迁移的抑制作用显著降低。B. Transwell分析显示了VEGFR2表达在安罗替尼抗细胞侵袭的作用,当VEGFR2表达被敲低时,安罗替尼的抑制作用显著降低。C. CCK8实验证实VEGFR2在安罗替尼抑制细胞增殖的作用,当VEGFR2表达被敲低时,安罗替尼的抗增殖作用显著降低。*P<0.05;**P<0.01;***P<0.001。比例尺=100μm。
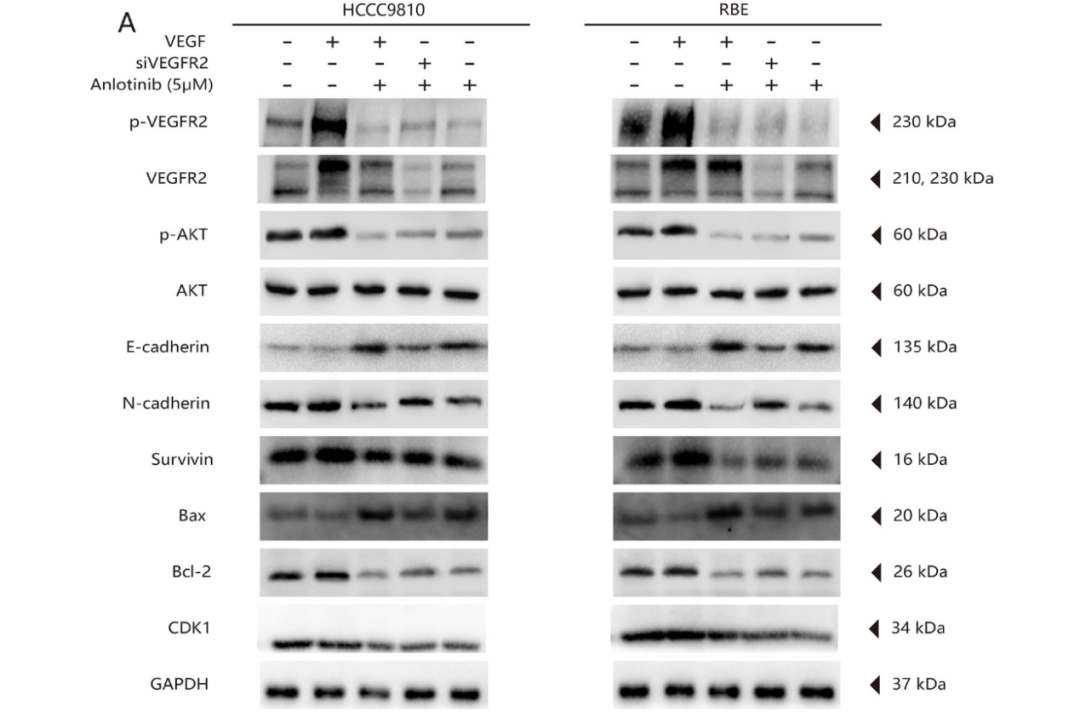
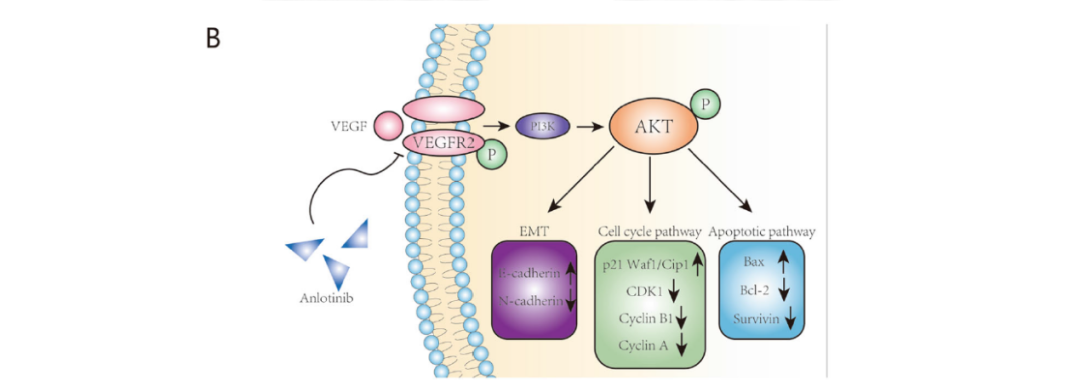
图7:Anlotinib通过抑制ICC细胞中的VEGFR2磷酸化水平抑制PI3K/AKT信号通路。A. Western blot法检测细胞周期和细胞凋亡相关蛋白的表达,ICC细胞中VEGFR2和AKT在不同组磷酸化的表达。B. 安罗替尼通过抑制VEGFR2/PI3K/AKT信号通路抑制肿瘤活性的潜在机制示意图。
讨论
ICC占所有原发性肝癌病例的10–15%,缺乏有效的治疗药物。通过这项研究,我们发现安罗替尼在ICC细胞系和ICC PDX模型中具有良好的抗肿瘤作用。在ICC细胞系中,安罗替尼的IC50远低于其他已报道的TKI药物的IC50[21],提示安罗替尼抗癌活性更佳。ICC PDX小鼠模型的结果也支持了安罗替尼具有出色的抗肿瘤作用(图3B,C),安罗替尼治疗3周对小鼠体重没有影响,说明安罗替尼的耐受性好。基于转录组分析,细胞周期和VEGF信号通路显著富集(图4)并且VEGFR2磷酸化水平显著降低,推测安罗替尼主要通过抑制VEGF/PI3K/AKT信号通路阻滞细胞周期,抑制肿瘤细胞增殖、侵袭和促进凋亡(图6)。此外,抑制AKT通路可能可以增强TKI(包括索拉非尼或仑伐替尼)的抗肿瘤作用[22,23],我们推测联用安罗替尼可能会增强此作用。安罗替尼对PDX模型肿瘤组织有很好疗效(总平均TGI 95.2%),并且六个PDX模型肿瘤组织的VEGFR2都高表达。该结果可能解释了安罗替尼效果好的原因(图3B和S5B)。另外,安罗替尼治疗前肿瘤组织中VEGFR2表达的结果与安罗替尼治疗后TGI之间的一致性表明,VEGFR2可能是预测安罗替尼在ICC中疗效的生物标记物(P=0.046,r=0.671)。以上这些结果表明VEGFR2可能是ICC患者使用安罗替尼治疗的靶点和疗效标记物。
基于以上研究,我们更加明确VEGFR2是安罗替尼的重要靶点。作为多靶点药物,安罗替尼可能通过其他通路或蛋白发挥作用。安罗替尼在ICC肿瘤PDX模型中的疗效为其在ICC中的应用提供了有价值的临床前研究结果。但是,还需在ICC患者中开展I期或II期前瞻性临床研究,评估安罗替尼治疗ICC患者的疗效,更多的收集其抗肿瘤活性、副作用和不良事件的数据,才能有效、安全、广泛地使用安罗替尼。
结论
该研究通过体外和PDX模型,发现安罗替尼对ICC细胞具有出色的抗肿瘤活性。研究结果显示,安罗替尼的抗肿瘤作用主要是通过抑制VEGFR2磷酸化水平以及阻断下游PIK3/AKT信号的激活,从而抑制肿瘤细胞的增殖和侵袭,促进细胞凋亡。
参考文献
1. Siegel, R. L., Miller, K. D. & Jemal, A. Cancer statistics, 2020. CA Cancer J. Clin. 70, 7–30(2020).
2. Rizvi, S., Khan, S. A., Hallemeier, C. L.,Kelley, R. K. & Gores,G.J.Cholangio-carcinoma—evolving concepts and therapeutic strategies. Nat. Rev. Clin. Oncol. 15,95–111(2018).
3. Gupta, A. & Dixon, E. Epidemiology and risk factors: intrahepatic cholangio-carcinoma. Hepatobiliary Surg. Nutr. 6,101–104(2017).
4. Rizvi, S. & Gores, G. J. Pathogenesis, diagnosis, and management of cho-langiocarcinoma. Gastroenterology 145,1215–1229(2013).
5. Bridgewater J. et al. Guidelines for the diagnosis and management of intra-hepatic cholangiocarcinoma. J. Hepatol. 60,1268–1289(2014).
6. Ribero D. et al. Surgical approach for long-term survival of patients with intrahepatic cholangiocarcinoma: a multi-institutional analysis of 434 patients. Arch. Surg. 147,1107–1113(2012).
7. Mansour J. C. et al. Hilar cholangiocarcinoma: expert consensus statement. HPB 17,691–699(2015).
8. Shen G. et al. Anlotinib: a novel multi-targeting tyrosine kinase inhibitor in clinical development. J. Hematol. Oncol. 11, 120(2018).
9. Wang G. et al. Anlotinib, a novel small molecular tyrosine kinase inhibitor, suppresses growth and metastasis via dual blockade of VEGFR2 and MET in osteosarcoma. Int J. Cancer 145, 979–993(2019).
10. He, C., Wu, T. & Hao, Y. Anlotinib induces hepatocellular carcinoma apoptosis and inhibits proliferation via Erk and Akt pathway. Biochem Biophys. Res Commun. 503, 3093–3099(2018).
11. Han B. et al. Effect of Anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: the ALTER 0303 Phase 3 Randomized Clinical Trial. JAMA Oncol. 4,1569–1575(2018).
12. Sun Y. et al. Safety, pharmacokinetics, and antitumor properties of anlotinib, an oral multi-target tyrosine kinase inhibitor, in patients with advanced refractory solid tumors. J. Hematol. Oncol. 9, 105(2016).
13.Huang, M., Huang, B., Li, G. & Zeng, S. Apatinib affect VEGF-mediated cell proliferation, migration, invasion via blocking VEGFR2/RAF/MEK/ERK and PI3K/ AKT pathways in cholangiocarcinoma cell. BMC Gastroenterol. 18, 169(2018).
14. Sun W. et al. A phase 2 trial of regorafenib as a single agent in patients with chemotherapy-refractory, advanced, and metastatic biliary tract adenocarci-noma. Cancer 125,902–909(2019).
15. Ogasawara S. et al. Antiproliferative effect of lenvatinib on human liver cancer cell lines in vitro and in vivo. Anticancer Res. 39,5973–5982(2019).
16. Niemira, M. et al. Molecular signature of subtypes of non-small-cell lung cancer by large-scale transcriptional profiling: identification of key modules and genes by weighted gene co-expression network analysis(WGCNA). Cancers 12,12–37(2019).
17. Rosen E. Y. et al. Functional genomic analyses identify pathways dysregulated by progranulin deficiency, implicating Wnt signaling. Neuron 71, 1030–1042(2011).
18. WangX.Q.et al. CDK1-PDK1-PI3K/Akt signaling pathway regulates embryonic and induced pluripotency. Cell Death Differ. 24,38–48(2017).
19. Karar, J. & Maity, A. PI3K/AKT/mTOR pathway in angiogenesis. Front Mol. Neurosci. 4,51(2011).
20. Lin B. et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1. Gene 654,77–86(2018).
21. Fraveto A. et al. Sensitivity of human intrahepatic cholangiocarcinoma sub-types to chemotherapeutics and molecular targeted agents: a study on pri-mary cell cultures. PLoS ONE 10, e0142124(2015).
22. Fu R. et al. Activation of the HGF/c-MET axis promotes lenvatinib resistance in hepatocellular carcinoma cells with high c-MET expression. Med. Oncol. 37,24(2020).
23. Hu B. et al. KPNA3 confers sorafenib resistance to advanced hepatocellular carcinoma via TWIST regulated epithelial-mesenchymal transition. J. Cancer 10, 3914–3925(2019).