透过现象看本质 樊旼教授谈PD-L1抑制剂全新抗肿瘤机制和SCLC免疫治疗
小细胞肺癌(SCLC)已进入免疫治疗时代,有趣的是,目前只有PD-L1抑制剂在SCLC一线治疗中取得突破。是什么独特机制造就了PD-L1抑制剂在SCLC中的成功一大步?如何解读CASPIAN研究结果?【肿瘤资讯】诚邀复旦大学附属肿瘤医院樊旼教授,深入浅出的介绍近期研究发现的PD-L1抑制剂全新抗肿瘤机制,并畅谈SCLC免疫治疗研究进展,以及传统放疗在免疫治疗新时代的新机遇。

SCLC的治疗进展相对缓慢,主要是因为难以研究透彻基因型、疾病进展迅速、侵袭性强。
樊旼教授:相比于非小细胞肺癌(NSCLC),小细胞肺癌(SCLC)的治疗研究进展相对缓慢。为什么会出现这样的现象?对于恶性肿瘤,我们一般从以下两个方面开展治疗或研究,一个是基因检测,一个是临床表型。首先,基因检测方面,如果能明确哪种驱动基因,比如EGFR突变阳性NSCLC,那么采取靶向治疗的疗效普遍较好。但是SCLC属于聪明的肿瘤,凭借目前的基因检测技术很难完全分析清楚SCLC的整体基因型,当然近几年我们尝试研究SCLC的分子亚型,但整体而言SCLC的难治性体现在基因型不明确。
其次,临床表型方面,如果肿瘤进展的不快,比如乳腺癌、甲状腺肿瘤、前列腺肿瘤,患者有接受根治性手术的机会,那么肿瘤治疗的效果也会不错。而SCLC进展迅速,确诊时大部分已是广泛期,出现了区域转移甚至远处转移。在所有针对肺癌筛查的前瞻性研究中,没有一项研究能够及时筛查出早期SCLC;另一项意大利的研究中,筛查出的所有SCLC患者在两年后全部死亡。这就告诉我们,SCLC的病程时间短,容易发生远处转移,这样的临床表型也导致了SCLC的难治性。
所以,结合以上两个因素来看,SCLC的不良预后不可避免。近30年来,SCLC治疗领域一直未有突破性治疗进展,直到近期PD-L1单抗的免疫治疗的出现,才使SCLC患者的生存得到了一定程度的延长,为患者带来了更长生存的希望。
揭示PD-L1抑制剂全新抗肿瘤机制,DC细胞或为关键
樊旼教授:PD-L1抑制剂联合化疗的作用机制,既往认为是由于化疗对SCLC细胞产生了明显的杀伤作用,肿瘤分解,更多的抗原释放,同时造成抗原递呈细胞增加,而后PD-L1抑制剂通过对肿瘤细胞上PD-L1表达的抑制,激活T细胞,重启免疫作用,从而杀伤SCLC细胞。这种作用机制理论上不应局限于PD-L1抑制剂,PD-1抑制剂按理也能起到很好的作用。但是目前获批SCLC一线免疫治疗的均为PD-L1抑制剂,PD-1抑制剂却在该领域纷纷折戟。
近期,《科学》(Science)杂志子刊发表了一篇文献揭示了PD-L1抑制剂的全新抗肿瘤机制,可能有助于解释上述现象(Sci Transl Med. 2020; 12(534). pii: eaav7431. doi: 10.1126/scitranslmed.aav7431.)。这篇文献重点关注了树突状细胞(Dendritic cells,也称DC细胞),DC细胞是功能最强的抗原提呈细胞。在DC细胞表面,PD-L1与B7.1均表达。而B7.1是PD-L1可以结合的另一个配体。然而要想增强T淋巴细胞的免疫作用,B7.1就必须与T细胞的CD28受体结合,而不是PD-L1。在SCLC的肿瘤微环境中,我们发现DC细胞上PD-L1的表达量增多了,为B7.1的20倍,并且PD-L1与B7.1的结合能力非常强,因此B7.1与PD-L1结合后就没有机会与CD28结合,免疫作用被抑制。
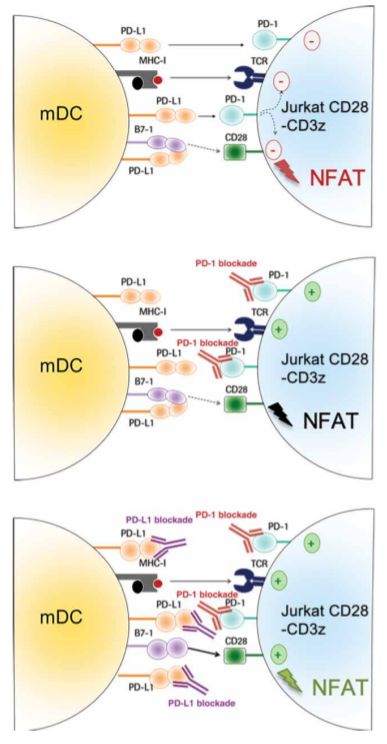
图1. DC细胞可能是PD-L1抑制剂治疗的关键
使用PD-L1抑制剂联合化疗治疗SCLC,不仅可以杀伤肿瘤细胞,对抗原递呈这条经典通路产生作用,对于DC细胞而言,抑制PD-L1还能够为B7.1与CD28受体结合提供机会,助攻了SCLC的免疫治疗,达到较好的疗效。这篇文献启示了我们今后治疗SCLC的思路和临床治疗的优化策略,同时也部分回答了为什么目前只有PD-L1抑制剂结合化疗方案在SCLC一线治疗中可以获得成功。
CASPIAN研究的史上最长OS结果兼具统计学和临床意义,亚裔人群和脑转移患者同样可获益
樊旼教授:CASPIAN研究是目前唯二获得成功的广泛期SCLC一线免疫治疗的研究。该研究对于入组患者的化疗方案不限于卡铂,还可以选择临床治疗中也非常常用的顺铂。同时,对照组可以最多使用6个周期的标准化疗,即依托泊苷+卡铂/顺铂(EP/EC)方案,而试验组最多只能使用4个周期的标准化疗。对照组这样的研究设计更接近于临床实际情况,即使如此,CASPIAN研究依然获得了具有统计学显著性差异的总生存(OS)结果。
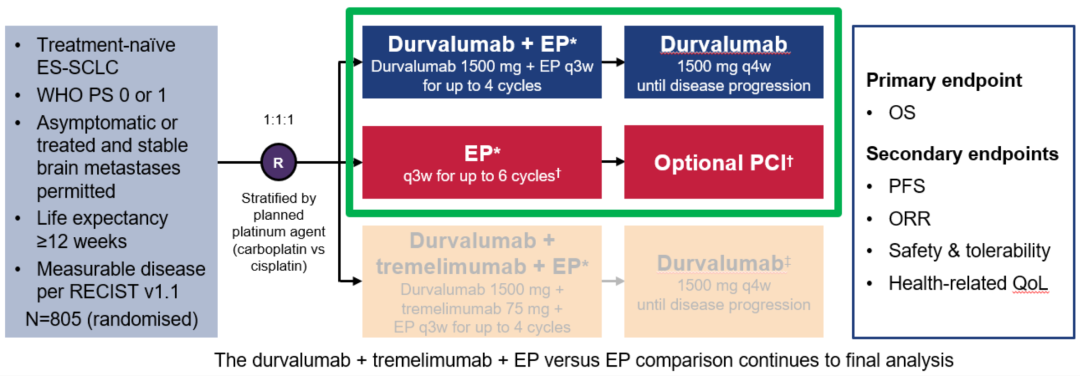
图2. CASPIAN研究设计
OS方面,度伐利尤单抗+化疗组(D+EP)相比化疗组(EP)延长近3个月,达到12.9个月,这一结果相当不错,并且高于IMpower133研究结果。
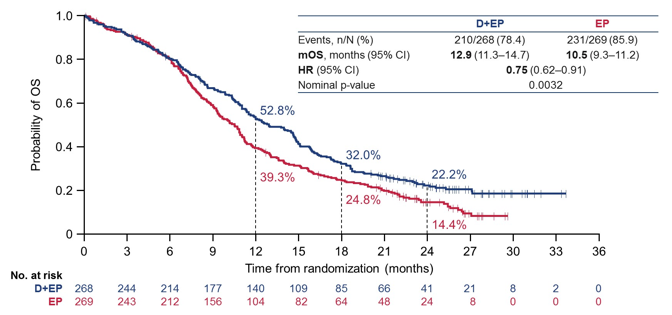
图3. D+EP vs EP的OS
我们还比较关心的是亚组分析情况。有没有一些亚组不能从治疗中获益?合并肝转移/脑转移的患者,或者某些族群比如亚裔患者的疗效如何?CASPIAN研究给出了非常鼓舞人心的临床证据。亚裔患者使用D+EP的OS达到14.8个月,超过了对照组的的11.9个月;合并脑转移的患者使用D+EP的风险比(HR)值为0.79,显著降低了死亡风险,获益趋势和全组人群是一致的,这也是目前唯一在脑转移中有阳性获益的研究结果,提升了我们治疗这类患者的信心。
整体而言,CASPIAN研究设计接近临床实际应用情况,无论是亚裔患者还是合并脑转移的患者,临床获益趋势与整体人群一致,同时也启示我们,使用D+EP一线治疗广泛期SCLC是优选的策略,是最有可能获得成功的模式。
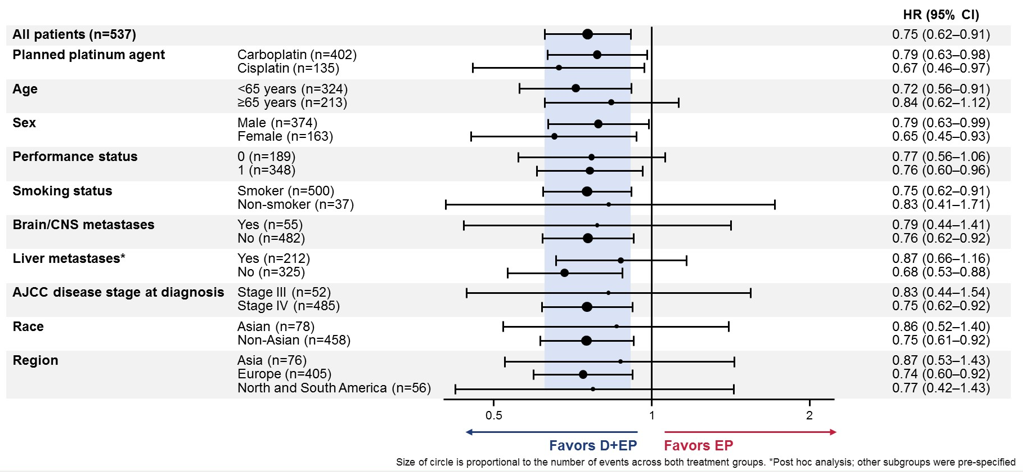
图4. D+EP vs EP的亚组分析结果
SCLC领域放疗地位举足轻重,免疫治疗新时代遇见无限新机遇
樊旼教授:作为放疗科医生,我认为放疗、化疗、免疫治疗都是SCLC重要的治疗手段,放疗的地位更是举足轻重。在局限期SCLC中,放疗联合化疗构成了这些患者获得治愈的两个必要因素,而且对前期经过根治性化疗和胸部放疗获得完全缓解/部分缓解(CR/PR)的局限期SCLC患者,进行预防性脑放疗(PCI)可以预防颅内转移并且提高生存获益,非常难能可贵。
如今广泛期SCLC已进入免疫治疗时代,放疗的地位应该如何考虑?怎么优化放疗的流程?通过免疫治疗的优化、迭代,广泛期SCLC的疗效可能进一步提高;患者如果接受前期治疗有疗效但未达CR,可以对局部残存的肿瘤进行放疗;放疗同步免疫治疗是否可以进一步提高疗效,也是值得探索的方向。同时,对于一些特殊亚群比如合并肝转移的患者,放疗是否能够介入使其获益,是值得探索的另一方面。此外,寡转移患者是否可能从免疫治疗和放疗中获得更多的生存获益?这方面的研究空间似乎也相当大。
对于局限期SCLC,一般认为如果五年生存率达到30%,基本就达到了国际先进水平。如果将免疫治疗药物应用到局限期SCLC,应参考Ⅲ期NSCLC的治疗和研究思路,放疗应考虑如何与免疫治疗配合,是采用PACIFIC研究那样的巩固模式还是同期模式,又或是其他方式?SCLC在未来将迎来一个研究蓬勃开展、数据层出不穷、挑战接连不断的阶段,希望今后有更多的机会与大家进行交流。