照亮小细胞肺癌患者生命之光 浅谈阿替利珠单抗的临床实践之路
小细胞肺癌恶性程度高,疾病进展迅速,患者生存预后差,治疗手段和药物更新缓慢,成为临床治疗的一大难点。2018年IMpower133研究结果的公布和2020年阿替利珠单抗获得国家药品监督管理局(NMPA)的审批通过,让这一领域迎来历史性的突破,也为中国的小细胞肺癌患者带来临床治疗新的曙光。
【肿瘤资讯】近期特别采访到山东省肿瘤医院呼吸内科二病区主任刘杰教授,畅谈小细胞肺癌免疫治疗的发展,解读相关研究数据,分享临床实践经验,以期为小细胞肺癌患者带来更好的治疗获益和治疗体验。

刘杰
肿瘤学博士 主任医师
《国际肿瘤学杂志》编委
中国医促会胸部肿瘤分会委员
中国医师协会肿瘤分会青委会委员
山东省抗癌协会化疗分会常委兼青委会主任委员
山东老年医学学会肿瘤靶向与维持治疗专委会副主任委员
山东免疫学会肿瘤分子标记物与靶向治疗专委会副主任委员
一、小细胞肺癌的临床治疗,曾历经漫长黑夜
刘杰教授:肺癌是目前是世界上发病率和死亡率最高的恶性肿瘤,尽管小细胞肺癌仅占整个肺癌的15%~20%,但是由于小细胞肺癌具有恶性程度高、异质性、侵袭性强等特点,因此患者极易出现远处转移。根据美国退伍军人肺癌协会分期(VALG),绝大部分患者在确诊时已属于广泛期,因此小细胞肺癌预后差、进展快,平均中位OS约在10个月左右,即使是局限期,中位OS也不超过20个月。作为一名临床医生,面对以上结果,有些惋惜。在过去的三十年,肿瘤疾病的大多数领域都经历了蓬勃地发展,例如晚期非小细胞肺癌取得巨大突破,靶向治疗彻底改变驱动基因阳性患者的预后:EGFR突变患者的中位OS已经突破50个月,ALK阳性患者中位OS已经接近100个月。免疫治疗同样改变了驱动基因阴性晚期非小细胞肺癌患者的生存预后,5年生存率达到20%以上。相比于非小细胞肺癌近年来在免疫、靶向和抗血管生成治疗方面的迅速发展,小细胞肺癌面对的是四十个研究、六十个新药的探索失败,医生手中急需更好的武器,去改变诊疗的结局。
二、阿替利珠单抗,照亮小细胞肺癌临床治疗的一道曙光
刘杰教授:最初对小细胞肺癌的免疫治疗发展看到希望,可以追溯到1999年The Lancet揭示免疫与小细胞肺癌患者生存之间的关系,对于小细胞肺癌合并肌无力综合征的患者,其生存时间为17.3月,一般的小细胞肺癌患者为10个月左右。
另外,TP53相关疫苗治疗后,免疫反应阳性的小细胞肺癌患者相对于阴性患者,其后续化疗的缓解率分别为75%和30%,中位OS分别为12.1月和9.6月。上述研究提示自身免疫或者获得性免疫可能在一定程度上能够抑制肿瘤的生长。
2013年阿替利珠单抗开展了其Ⅰ期临床研究(PCD4989g):针对难治性广泛期小细胞肺癌,共入组17例患者接受了阿替利珠单抗的单药治疗。2017年数据截止时,部分患者持续反应继续接受治疗,此时距首次给药2.6年,显示了肿瘤免疫治疗的效果和“拖尾效应”。
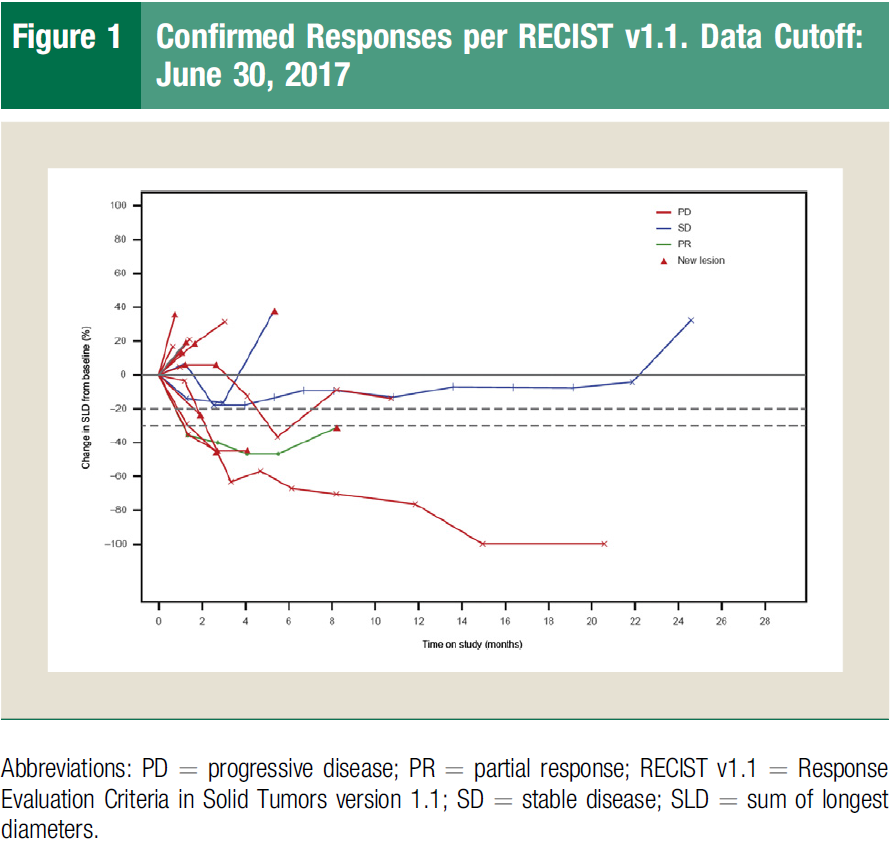
阿替利珠单抗后续继续开展了其Ⅰ/Ⅲ期临床研究(IMpower133研究):这是三十年首个达到双终点(OS和PFS)阳性的广泛期小细胞肺癌免疫+化疗一线治疗方案。在2018年世界肺癌大会(WCLC)公布了其研究结果:阿替利珠单抗+依托泊苷+卡铂(EP)方案突破了化疗无法超越广泛期小细胞肺癌中位OS 1年的魔咒,具有划时代的意义,从此开启了为小细胞肺癌患者争取长期生存的探索之路。
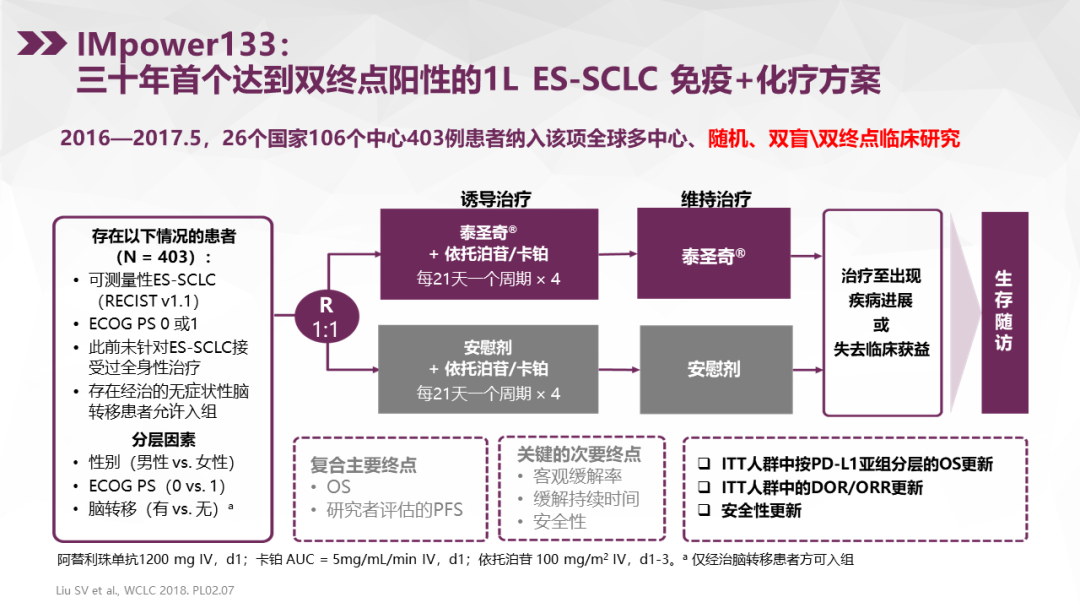
三、阿替利珠单抗+依托泊苷+卡铂成为广泛期小细胞肺癌一线治疗的新标准
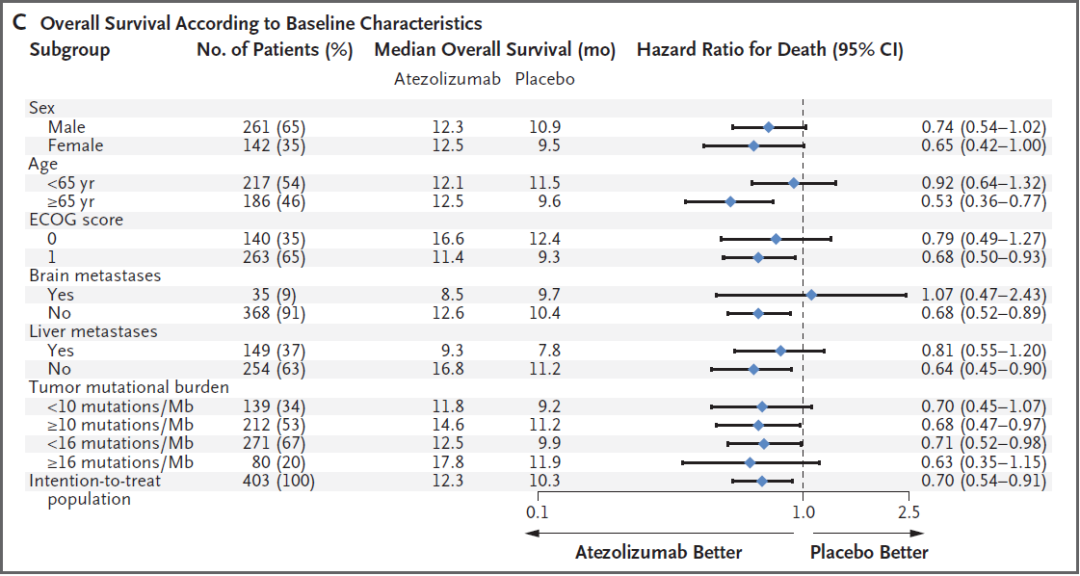
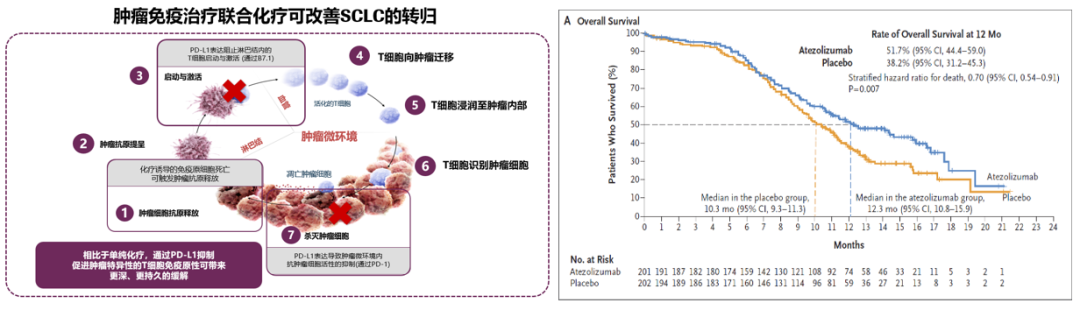
刘杰教授:IMpower133是阿替利珠单抗+依托泊苷+卡铂对比安慰剂+依托泊苷+卡铂一线治疗广泛期小细胞肺癌的随机对照双盲的Ⅰ/Ⅲ期临床研究,获得OS和PFS的双阳性结果。与安慰剂联合化疗相比,阿替利珠单抗联合化疗将中位OS从10.3个月延长到12.3个月,降低了30%的死亡风险(HR=0.70,P=0.007),可以说是历史性的突破。
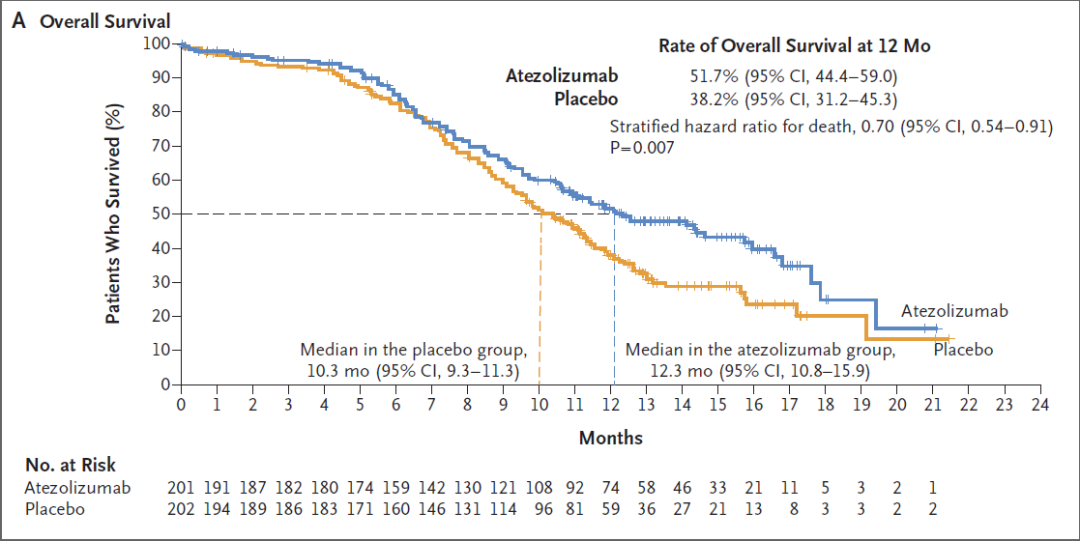
IMpower133研究OS数据[1]
IMpower133研究也获得了PFS的阳性结果,阿替利珠单抗联合化疗组的中位PFS达到5.2个月,化疗组为4.3个月,降低23%的疾病进展或死亡风险(HR=0.77,P=0.02),其1年时PFS率翻倍(12.6% vs 5.4%)。
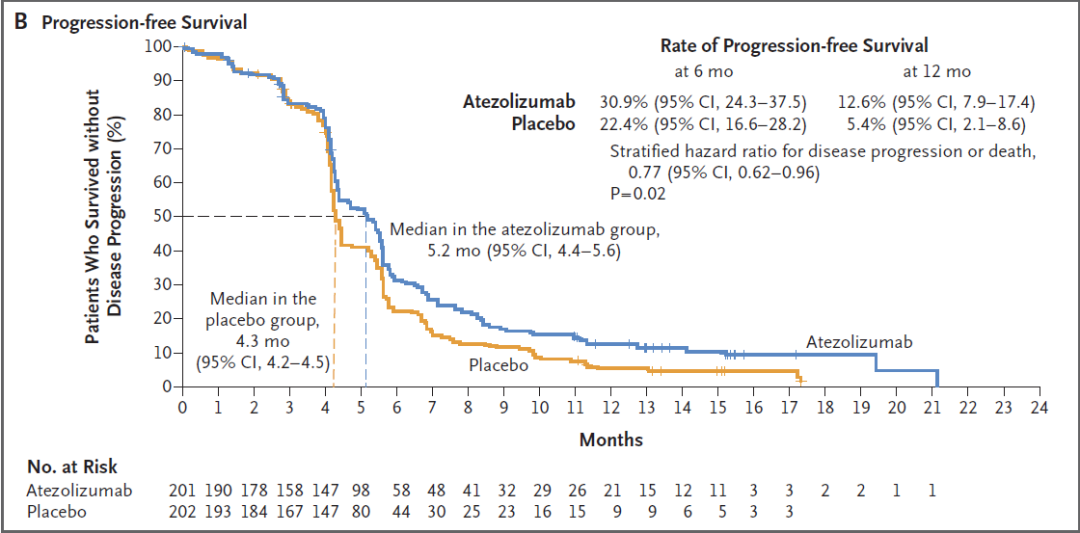
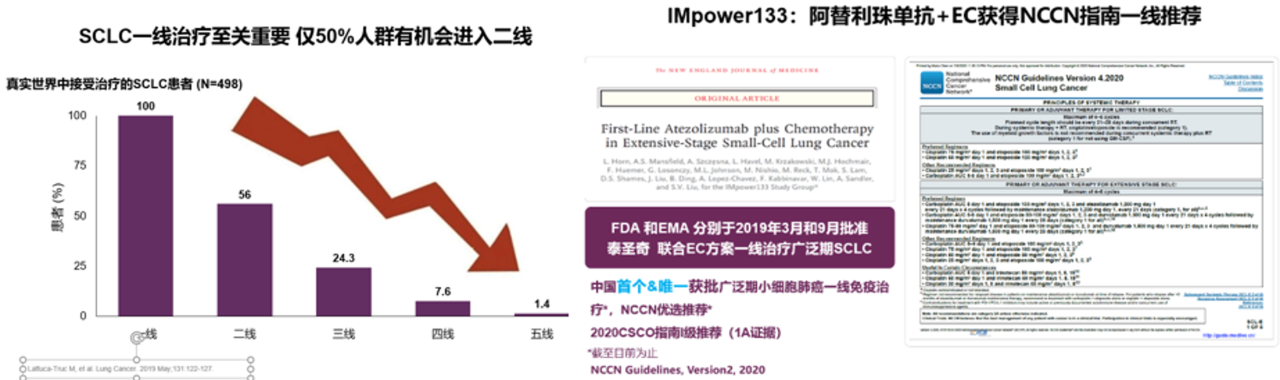
IMpower133是一个非常成功的研究,给患者带来了OS和PFS的双重获益,也提供了非常好的循证医学证据,阿替利珠单抗+依托泊苷+卡铂方案因此获得美国NCCN指南、中国临床肿瘤学会(CSCO)小细胞肺癌诊疗指南一线优选推荐(1A证据),成为广泛期小细胞肺癌一线治疗的新标准。
对于小细胞肺癌的免疫治疗,在细分人群上,IMpower133数据显示,阿替利珠单抗联合化疗在各亚组皆有OS的获益,非肝转移患者从阿替利珠单抗联合化疗中获益更多,中位OS达16.8个月,较对照组延长5.6个月[1]。
四、从数据中来,到实践中去,免疫治疗给患者带来实实在在的治疗获益
刘杰教授:从当初看到上述研究数据,我们还是比较期待阿替利珠单抗在临床实践中的表现。以山东省肿瘤医院为例,目前各亚专业非常细化,像我们呼吸内科二病区,主要开展肺癌的专科治疗。在我们中心就诊的肺癌患者,接近20%确诊为小细胞肺癌,这里面有70%~80%为广泛期。针对小细胞肺癌的临床诊疗路径,同步放化疗是绝大部分局限期患者的主要治疗方案,对于不适合同步放化疗的患者,常选择序贯放化疗,此外还有少部分不能耐受序贯放化疗的患者,则可考虑单纯化疗。对于广泛期小细胞肺癌患者,治疗上一直是以化疗为主。总体而言,小细胞肺癌的临床治疗,一直缺乏突破性的治疗药物和治疗手段。
阿替利珠单抗在今年2月得到NMPA的批准上市,在4月获得我们医院准入,进入临床实践。目前已有多例广泛期小细胞肺癌患者接受了阿替利珠单抗联合依托泊苷和卡铂的一线标准治疗。尽管治疗时间还比较短,不能观察远期疗效,但近期疗效非常理想。
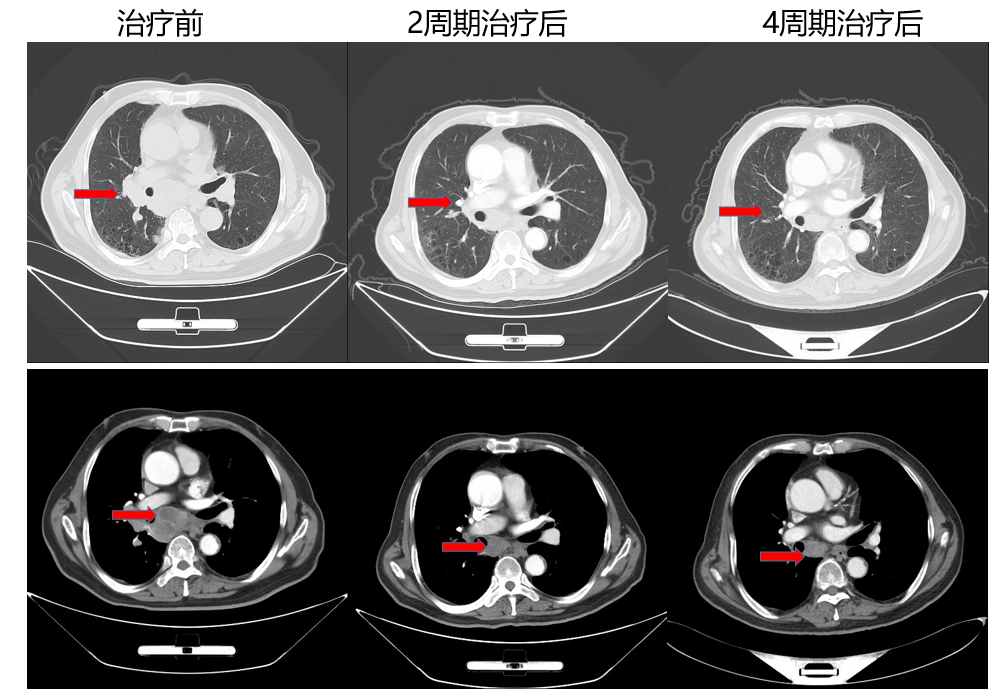
以下面这一例获得治疗的患者为例,患者72,男性,CT检查:1.右肺占位,考虑肺癌并肺内、双肺门及纵隔淋巴结转移;双侧胸膜增厚;双肺气肿;双侧肾上腺区结节,考虑转移;胰腺多发占位,考虑转移瘤;2.胆系梗阻性扩张;脾大,副脾;左肾囊肿;3.考虑脑萎缩;4.双肺气肿。5.细胞室检查 EBUS,考虑小细胞癌,6.NM ECT,全身诸骨未见明显异常。7.颅脑MR未见明显异常。患者诊断为小细胞癌 cTxN3M1c,Ⅳb期,入我科后行阿替利珠单抗 1200 mg+依托泊苷 100mg/m2 +卡铂(AUC=5)方案,经过4周期治疗后,可以明显看到肿瘤的缩小。随着治疗时间的延长,我们期待能够积累到足够多的真实世界数据,验证IMpower133的长生存结果。
为了发挥小细胞肺癌免疫治疗的最大效果,其应用时机该如何选择?
首先,回顾一下小细胞肺癌的特点,其恶性程度高、异质性和侵袭性强、易出现远处转移,广泛期患者平均中位生存期约在10个月左右,因此小细胞肺癌一线治疗至关重要,仅有50%的人群有机会进入二线。越早治疗,患者得到生存获益的概率越大。NCCN指南,CSCO指南也都把阿替利珠单抗联合EC方案用于广泛期小细胞肺癌的一线治疗。
其次是确诊后免疫治疗和化疗的联合应用。化疗干扰细胞的核酸代谢和蛋白质代谢,提供更多的肿瘤抗原,PD-L1抑制剂激活T淋巴细胞,促使其分化成具有特异性的细胞毒T细胞,识别和杀灭肿瘤,二者相辅相成,共同促进。从右图IMpower133的数据可以看到,并不是一开始两组的OS数据就开始分离,此时相当于体内正在蓄积肿瘤免疫的“力量”,至第六个月时,二者的OS曲线开始明显分离,显示出免疫联合化疗在抗击肿瘤上的能力。这种能力随着体内开始拥有识别小细胞肺癌肿瘤细胞的记忆T淋巴细胞, 呈现出明显的“拖尾”效应。所以,对于广泛期小细胞肺癌,一线、早期、免疫联合化疗的应用对患者获得长生存和无病进展是非常必要的。
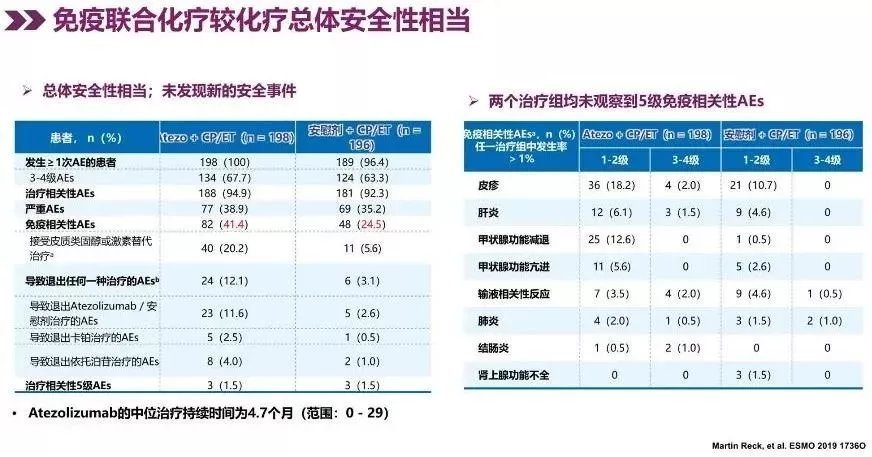
另外,我们观察到,阿替利珠单抗联合化疗的毒副反应发生率与经典化疗方案相比没有显著增加,未观察到 5 级免疫相关性的严重不良事件。患者耐受性良好,这一点和IMpower133的研究数据基本一致。患者偶尔会出现自身免疫相关性肝损伤、甲状腺的损伤、肺间质性病变等,就我们病区所有使用免疫治疗的病例来看,可以用激素等措施及时治疗并恢复,治疗前后详细的观察和问诊也能降低不良反应的发生率。
在使用方面,阿替利珠单抗基于I/III期临床研究选择了1200 mg q3w 固定剂量方案,临床实践上使用方便,1次输注1瓶,剂量精准,输注时注意与其他药物分开输注,首次至少持续60分钟,耐受良好可适当缩短(不少于30分钟),为更好地观察免疫药物可能带来的不良反应,应在其他联用药品前先行给药。
在脑转移方面,IMpower133研究显示对于既往接受过治疗的无症状性脑转移患者,可以纳入阿替利珠单抗的治疗,并可在维持治疗阶段行预防性脑照射(PCI)。在我们病区的临床实践中,到目前为止大概遇到有7-8例合并脑转移的广泛期小细胞肺癌患者,经过阿替利珠单抗联合化疗获得了良好的疾病控制。因IMpower133中纳入的脑转移患者数量相对较少,对其疗效的准确评估,还需要进一步累积数据。
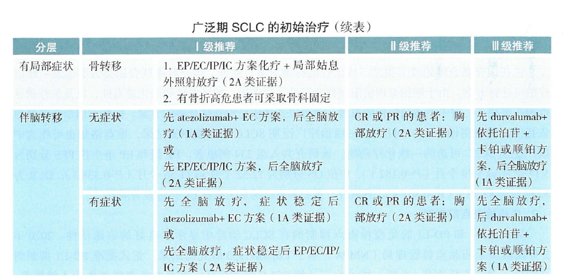
目前对于小细胞肺癌伴随脑转移的患者,其临床治疗的最佳途径是放射治疗,对于无症状的脑转移患者,2020CSCO小细胞肺癌诊疗指南建议可以先使用阿特利珠单抗+EC方案,后行全脑放疗(1A类证据),对于有症状的脑转移患者,先进行全脑放疗,待症状稳定后,再进行阿特利珠单抗+EC方案治疗(1A类证据)。
备注:肺癌脑转移的特点是头痛,主要是因为颅内压增高或者脑水肿所致,疼痛较为剧烈,常在清晨发作,其他还有呕吐、视力障碍、精神异常、单侧肢体感觉异常或者无力、幻嗅、偏瘫或者踉跄步态、耳鸣、耳聋等症状,遇到以上情况,诊断时需要特别关注。
2020CSCO小细胞肺癌诊疗指南伴脑转患者的治疗建议
NCCN指南推荐广泛期小细胞肺癌对一线治疗应答较好,PS评分好的患者接受PCI治疗,降低脑转移风险。
五、从小细胞肺癌到非小细胞肺癌,免疫治疗的发展可期
刘杰教授:肿瘤的免疫治疗(特别是联合治疗)是当前临床研究的热点,近年来IMpower150、KEYNOTE-189、KEYNOTE-407、CheckMate-227等研究的成功,使得免疫联合治疗取得了非常显著的成绩。除了小细胞肺癌,阿替利珠单抗也在非小细胞肺癌中开展IMpower150研究,它将免疫联合抗血管生成和化疗的治疗模式从理论带到实践。
当前已公布的结果显示,阿替利珠单抗联合贝伐珠单抗+紫杉醇+卡铂(ABCP),与贝伐珠单抗+紫杉醇+卡铂相比(BCP),能够显著延长患者的OS和PFS。中位PFS从6.8个月延长到8.3个月(HR=0.62,P<0.001),中位OS从14.7个月延长到19.5个月(HR=0.80,P=0.01)[2],开创了这一领域四药联合的治疗模式,为晚期非鳞非小细胞肺癌患者带来了非常大的生存获益, NCCN指南目前将该方案作为晚期非鳞非小细胞肺癌患者的一线治疗选择。
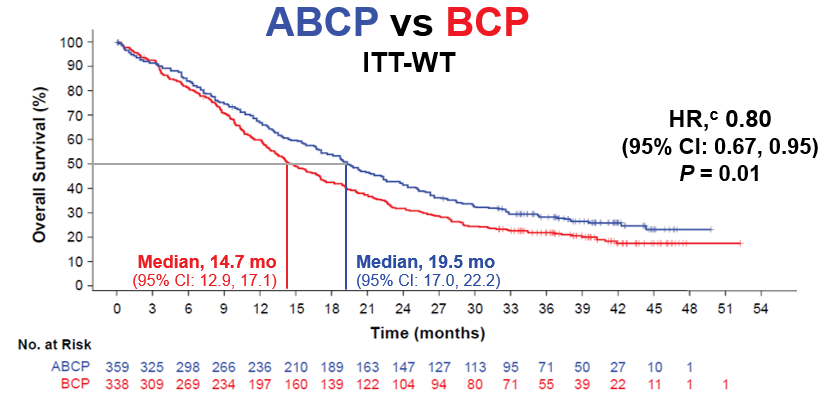
IMpower150研究最终分析OS数据[2]
IMpower150研究中四药联合方案ORR达到64%。同时对于肝转移等高肿瘤负荷人群,获得了更长的PFS和OS。对于肿瘤负荷比较大的非鳞非小细胞肺癌患者,如果一般状况比较好,能够耐受,那么四药联合方案有可能是患者更好的治疗选择。此外,IMpower150研究还带给我们一些提示,对于EGFR/ALK阳性患者,早期的研究提示不能从免疫治疗中获益,但IMpower150研究结果显示对于经EGFR TKI治疗失败的患者,接受四药联合方案能够取得OS和PFS的获益。
对比其他治疗方案,山东省肿瘤医院于金明院士团队于今年在《肿瘤免疫学》(OncoImmunology)杂志发表的系统评价和网络Meta分析结果表明[3],阿替利珠单抗联合抗血管生成和化疗的方案在ORR和PFS方面的优势明确,优于其他单药或联合治疗方案,且不论PD-L1表达水平。
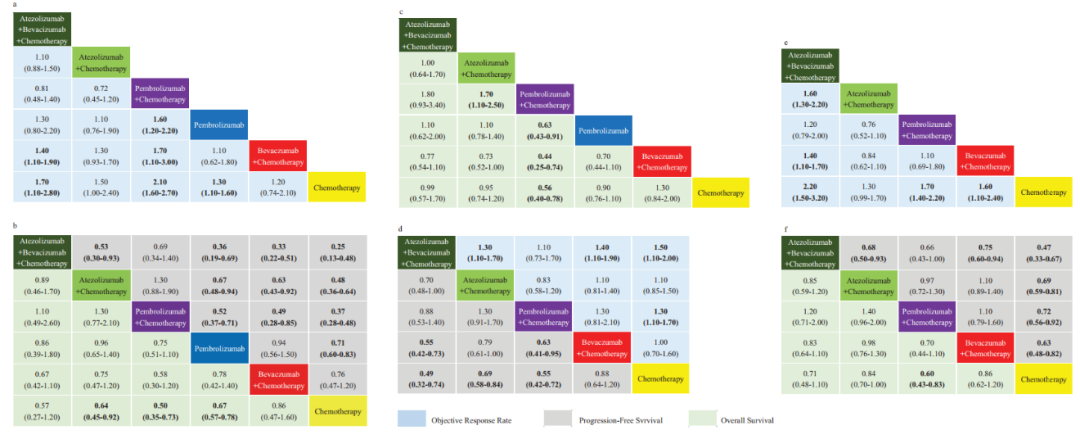
根据PD-L1表达水平进行的ORR、PFS和OS分析(a&b:PD-L1≥50%;c&d:1%≤PD-L1<50%;e&f:PD-L1<1%)[3]
IMpower150研究开启了晚期肺癌多药联合模式的新时代。随后在今年ASCO年会报道的CheckMate-9LA研究,双免联合的基础上再联合两周期短程化疗的模式同样获得了成功。吉林省肿瘤医院程颖教授在国内牵头多家临床研究中心开展了广泛期小细胞肺癌免疫联合安罗替尼再联合化疗方案的探索,山东省肿瘤医院也在积极探索晚期肺癌一线治疗中去铂类化疗的三联治疗模式,期待上述研究成果都能尽早发表,给晚期肺癌患者带来更多的治疗选择。
六、未来期望免疫治疗能够帮助到更多患者
刘杰教授:免疫治疗为广泛期小细胞肺癌患者带来了比较好的治疗效果,期待阿替利珠单抗能够早日进入医保,惠及到更多患者,点亮生命之光。
参考文献
1.Horn L,Mansfield AS,Szczęsna A,et al.First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 379:2220-2229.
2.Socinski MA,Mok TSK,Nishio M,et al.IMpower150 final analysis:Efficacy of atezolizumab(atezo)+ bevacizumab(bev) and chemotherapy in first-line(1L) metastatic nonsquamous(nsq) non-small cell lung cancer(NSCLC) across key subgroups[EB/OL]. 2020 AACR, abstract CT216.
3.Liu J,Li CM,Seery S,et al.Identifying Optimal First-Line Interventions for Advanced Non-Small Cell Lung Carcinoma According to PD-L1 Expression: A Systematic Review and Network Meta-Analysis[J].Oncoimmunology,2020, 9(1):1746112.