免疫联合治疗可获CR,开启晚期HCC治疗新格局
肿瘤免疫治疗的特点在于激发特异性免疫反应,增强机体对肿瘤的免疫排斥能力,抑制和杀伤肿瘤细胞,从而降低肿瘤复发和转移能力。近年来,免疫治疗在肝癌领域不断取得进展,晚期肝癌的免疫治疗前景愈加明朗,中晚期肝癌的免疫联合治疗手段初现成效。本期将分享一例PD-1单抗联合靶向药物治疗晚期肝细胞癌术后肝内复发转移伴破裂的病例。

陆文洁
浙江大学医学院附属第二医院普外科副主任医师
医学博士,2006年毕业于中国协和医科大学,从事普外科工作十余年,擅长腹部外科常见及疑难疾病的外科诊治。长期专注胰腺外科临床工作与转化研究。主持和参与多项国家及省部级胰腺疾病相关自然基金项目。以第一作者、通讯作者发表胰腺肿瘤、胃癌相关SCI论文多篇。
基本情况
一般资料:患者男性,79岁。
主诉:发现肝癌近2年,反复TACE后复发残留。
现病史:
患者于2年前(2018年5月16日)因确诊为“肝癌”于外院行TACE治疗,后定期随访。第一次TACE治疗后1年(2019年5月)于当地医院复查,发现AFP升高,遂于我院就诊。
既往史:糖尿病10年余;有前列腺增生病史;否认乙肝病史;否认其他慢性病史。
个人史及家族史:否认特殊个人史及家族史。
查体:ECOG PS评分 2分,KPS评分60分,无黄疸,腹软,无压痛及反跳痛,肝脾肋下未及,双下肢无明显水肿。余查体未见明显异常。
实验室检查:乙肝病毒DNA(-);AFP 277.1 ng/ml,余未见明显异常。
腹部CT:肝IV段(8.8×6.6 cm)和肝V-VIII段(4.5×3.7 cm)肿块,考虑HCC,其中肝IV段肿块伴出血、破裂,余肝内多枚强化结节。
诊断:肝癌TACE术后肝内复发转移伴破裂,BCLC C期,Child-Pugh A级。

图1:2019年5月21日,给予替雷利珠单抗前腹部CT横断位(A、B、C)和冠状位(D)
治疗经过
1第一阶段:介入治疗
患者于2019年5月22日予以TACE治疗,于2019年5月27日行放射性粒子植入。
腹部CT:病灶部分存活,其余子灶基本同前。
AFP:266.7 ng/ml。

图2:2019年7月3日,第一次介入治疗后腹部CT
患者于2019年7月26日予以第二次TACE治疗,分别于7月30日、9月11日予以放射性粒子植入术。12月12日(第三次介入治疗3个月后)腹部CT提示:存活病灶范围明显增大,肝内新发多发子灶,于2020年1月15日再次予以TACE治疗。
腹部CT:存活病灶范围明显增大,肝内新发多发子灶。
AFP:409.1 ng/ml。
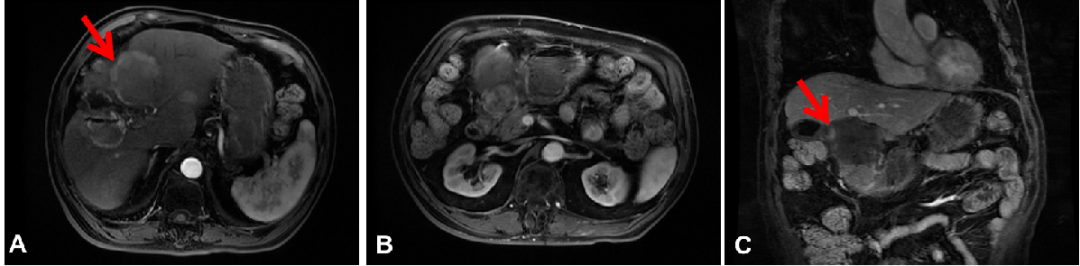
图3:2020年3月13日,第四次介入治疗后腹部CT横断位(A、B)和冠状位(C)
2第二阶段:免疫治疗
患者经过四次介入治疗后,复查提示存活病灶范围明显增大、肝内新发多发病灶、AFP明显升高,考虑病情未得到有效控制,遂来我科就诊。经患者充分知情同意并签署知情同意书后,分别于2020年4月2日、2020年4月28日、2020年5月19日、2020年6月16日、2020年7月7日予以免疫联合治疗方案:替雷利珠单抗200 mg q3w ivgtt + 仑伐替尼8 mg qd po。
腹部CT(2020-06-12):肝IV段病灶较前(2020-03-13)进一步缩小、坏死。
AFP:已降低至正常(8.5 ng/ml)。
疗效评价:CR(mRESIST)。
无进展生存期(PFS):超过4.4个月。
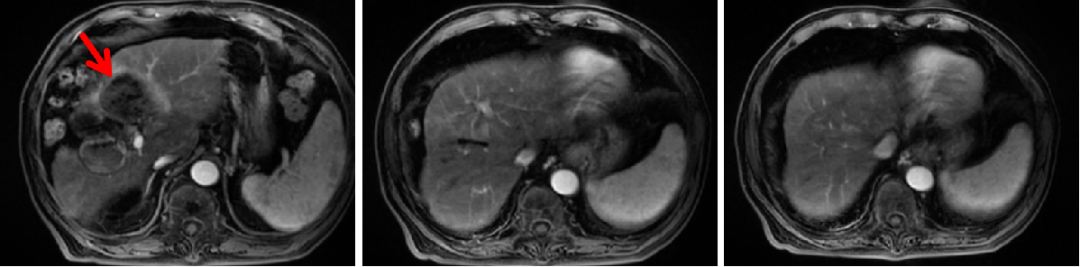
图4:2020年6月12日,免疫联合治疗3周期后腹部CT
病例总结
本例患者为原发性肝细胞癌切除术后1年,发生肝内复查转移伴破裂,予以4次介入治疗后,靶病灶明显增大,肝内发现新发病灶,且AFP明显升高,病情有所进展。经患者知情同意并签署知情同意书后,予以患者替雷利珠单抗联合靶向治疗,用药至今靶病灶明显缩小,AFP降低至正常,疗效达到CR。截至最近一次随访,患者的PFS已超过4.4个月。用药期间,患者用药耐受良好,除轻度的口腔粘膜溃疡之外,无明显主观不良反应和辅助检查异常。

图5:患者治疗期间AFP变化
病例讨论
原发性肝癌为全球第6位常见肿瘤,居癌症相关死亡原因的第4位,其中肝细胞肝癌(HCC)约占75~85%[1]。我国是HCC高发国家,超过60%的初诊患者为中晚期[2],但大部分早期HCC患者术后也可能面临肿瘤复发转移[3]。目前肝动脉栓塞化疗(TACE)是不能手术的中晚期肝癌最常用的治疗手段之一,但其在改善患者预后方面尚不能令人满意。患者在经过4次介入治疗后,靶病灶明显增大,肝内发现新发病灶,且AFP明显升高,病情有所进展,亟需更换能够改善患者病情、延长预后生存的治疗方案。
通过搜索近年来的多项研究资料,我们发现已有多个靶向治疗药物在晚期HCC的Ⅲ期研究中取得成功[4-7],免疫检查点抑制剂程序性死亡受体-1(PD-1)/程序性死亡受体-1配体(PD-L1)单抗在晚期HCC治疗中也取得突破性进展。但PD-1/PD-L1 单抗单药治疗HCC的ORR为10%~20%左右[8-15],PD-1/PD-L1单抗和靶向治疗单药治疗HCC的疗效仍然有限,因此免疫联合治疗成为提高疗效的主要策略。
在2020美国临床肿瘤学会年会(ASCO)上报道了一项PD-1单抗联合靶向小分子抑制剂一线治疗HCC的Ⅰb期研究数据[16],结果显示ORR为36%,mPFS和mOS分别为8.6个月和22个月。此外,PD-1单抗联合靶向治疗在HCC二线治疗中也显示出较好的前景。在Ⅰ期研究[17]中,经过标准一线治疗失败的HCC患者,接受PD-1单抗联合靶向治疗,ORR为50%,DCR 93.8%,mPFS为5.8个月,与PD-1单抗单药比较疗效明显提高。
在诸多在研的药物中,替雷利珠单抗是目前唯一一个对Fc段进行了结构优化的PD-1单抗,使其无Fc&γ;R结合能力,从而有效避免了抗体依赖细胞介导的细胞吞噬作用(ADCP),减少T细胞损耗,抗肿瘤活性更强,在作用机理上更具优势。替雷利珠单抗作为中国自主研发的创新药物,表现出与PD-1结合力强、亲和力高、出现脱靶效应几率低等诸多优点,独特的结构优势也决定了其独特的抗肿瘤疗效及安全性特点[18,19]。
此外,研究显示,替雷利珠单抗单药治疗经治晚期肝癌患者的ORR达到12%,DOR达到15.7个月[20],在2019 CSCO的一项口头报告中还显示[21],替雷利珠单抗治疗中国不可手术的晚期HCC患者ORR达17%,DCR为56%,疗效比肩国外同类药物,且安全性良好,≥3级不良反应发生率低。鉴于替雷利珠单抗的良好数据,一项旨在验证替雷利珠单抗联合仑伐替尼在一线治疗不可切除晚期HCC患者中的有效性和安全性的II期研究正在进行中[22],期待替雷利珠单抗能够获得更好的数据,惠及更多晚期HCC患者。
经过临床综合考虑,予以本例患者替雷利珠单抗治疗。患者用药至今总体疗效平稳,应答持久,无明显不良反应,至今PFS已超过4个月,获益持久。替雷利珠单抗未来或将成为晚期HCC治疗优选之一,为患者赢得更多生命延长的机会。希望替雷利珠单抗进入临床后发挥其疗效和安全性优势,为患者带来更多生存获益。也期待替雷利珠单抗在进一步的肝癌研究中获得更好的数据,早日应用于肝癌临床,使肝癌患者生存更久。
参考文献
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424.
[2] Park JW, Chen M, Colombo M, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death: the BRIDGE Study[J]. Liver Int, 2015, 35(9):2155-2166.
[3] Yu SJ. A concise review of updated guidelines regarding the management of hepatocellular carcinoma around the world: 2010-2016[J]. Clin Mol Hepatol, 2016, 22(1):7-17.
[4] Kudo M, Finn RS, Qin S, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial[J]. Lancet, 2018, 391(10126): 1163-1173.
[5] Bruix J, Qin S, Merle P, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment(RESORCE): a randomised, double- blind, placebo- controlled, phase 3 trial[J]. Lancet, 2017, 389(10064):56-66.
[6] Zhu AX, Park JO, Ryoo BY, et al. Ramucirumab versus placebo as secondline treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib(REACH): a randomised, double-blind, multicentre, phase 3 trial[J]. Lancet Oncol, 2015, 16(7): 859-870.
[7] Abou-Alfa GK, Meyer T, Cheng AL, et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma[J]. New Engl J Med, 2018, 379(1):54-63.
[8] El-Khoueiry AB, Sangro B, Yau T, et al. Nivolumab in patients with advanced hepatocellular carcinoma(CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389(10088):2492-2502.
[9] Yau T, Park JW, Finn RS, et al. CheckMate 459: A randomized, multicenter phase III study of nivolumab(NIVO) vs sorafenib(SOR) as firstline(1L) treatment in patients(pts) with advanced hepatocellular carcinoma(aHCC)[J]. Ann Oncol, 2019, 30(5 suppl):LBA38.
[10] Zhu AX, Finn RS, Edeline J, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib(KEYNOTE-224): a non-randomised, open-label phase 2 trial[J]. Lancet Oncol, 2018, 19(7):940-952.
[11] Finn RS, Ryoo BY, Merle P, et al. Pembrolizumab as second-line therapy in patients with advanced hepatocellular carcinoma in KEYNOTE-240: a randomized, double-blind, phase III trial[J]. J Clin Oncol, 2020, 38(3): 193-202.
[12] Qin S, Ren Z, Meng Z, et al. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open-label, parallel-group, randomised, phase 2 trial[J]. Lancet Oncol, 2020,21(4): 571-580.
[13] Mocan T, Sparchez Z, Craciun R, et al. Programmed cell death protein-1(PD-1)/programmed death-ligand-1(PD-L1) axis in hepatocellular carcinoma: prognostic and therapeutic perspectives[J]. Clin Transl Oncol, 2019, 21(6):702-712.
[14] Lee M, Ryoo BY, Hsu CH, et al. Randomised efficacy and safety results for Atezolizumab(Atezo)+ bevacizumab(Bev) in patients(PTS) with previously untreated, unresectable hepatocellular carcinoma(HCC)[J]. Ann Oncol, 2019, 30(5 suppl):LBA39.
[15] Harding JJ. Immune checkpoint blockade in advanced hepatocellular carcinoma: an update and critical review of ongoing clinical trials[J]. Future Oncol, 2018, 14(22):2293-2302.
[16] Andrew X. Zhu, et al. A phase Ib study of lenvatinib(LEN) plus pembrolizumab(PEMBRO) in unresectable hepatocellular carcinoma(uHCC)[J]. J Clin Oncol, 2020, 38(15 suppl): 4519.
[17] Xu J, Zhang Y, Jia R, et al. Anti-PD-1 antibody SHR-1210 combined with apatinib for advanced hepatocellular carcinoma, gastric, or esophagogastric junction cancer: an open- label, dose escalation and expansion study[J]. Clin Cancer Res, 2019, 25(2):515-523.
[18] Dahan R, et al. Fc&γ;Rs Modulate the Anti-tumor Activity of Antibodies Targeting the PD-1/PD-L1 Axis. Cancer Cell. 2015;28(3):285-95.
[19] Zhang T, et al. The binding of an anti-PD-1 antibody to Fc&γ;RΙ has a profound impact on its biological functions. Cancer Immunol Immunother. 2018;67(7):1079-1090.
[20] BGB-A317-001.
[21] 沈琳,2019 CSCO.
[22] Clinical Trial: NCT04401800.