RAS和BRAF V600E双野生、MSS型直肠癌同时性腹膜转移综合治疗:生存获益
病例介绍
病史及初诊情况
患者男,现年57岁。
主诉:间断便血1年、便频伴里急后重1个月,排便困难1周。
现病史:因“间断便暗红色黏液血便1年,便频伴里急后重1月,排便困难约1周”,初诊时间为2016年12月29日 。
既往史:高血压病史2年;家族史:无殊。
患者一般情况:H:172cm,W:72kg,BSA:1.89m2。BMI:25 kg/m2;ECOG:0分。体格检查:腹部稍膨隆,全腹软,腹部无明显压痛,反跳痛,未触及腹部包块,移动性浊音(-),肠鸣音4次/分。
直肠指检:距肛门7cm未及肿块,指套未见染血。
血常规,肝肾功能均正常;肿标:CEA 81.5ng/ml; CA19-9 26.31U/ml。
心电图、肺功能、心脏彩超未发现明显异常。
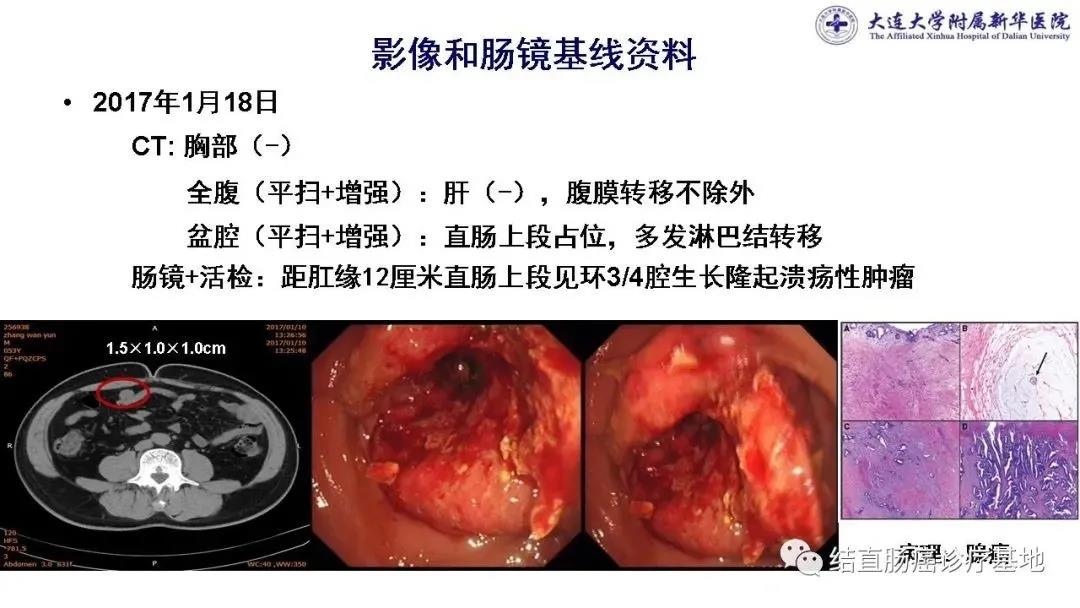
影像基线资料:2017.1.10胸部CT:未见转移。盆腔CT(平扫+增强):直肠上段占位,肠壁不规则增厚,见突向腔内的软组织密度影,肠腔狭窄,邻近系膜多发淋巴结转移。全腹部CT(平扫+增强):肝(-),下腹部见多个椭圆形结节状软组织密度影,腹膜转移不除外。
肠镜(2017.1.8):距肛门12cm直肠上段可见环腔3/4隆起肿物,溃疡糜烂,表面污秽、质韧,触之易出血,肠腔狭窄,肠镜不能通过。活检病理:中-低分化腺癌。
基因检测结果:KRAS/NRAS Wt,BRAF V600E Wt,MSS型,HER2(-),UGT1A1*6、28* 未携带。
初步诊断
1.高位直肠癌同时性腹膜转移,cT4N2M1c,IVc期;2.不全肠梗阻。
第1次MDT讨论局部治疗
1.外科学评估
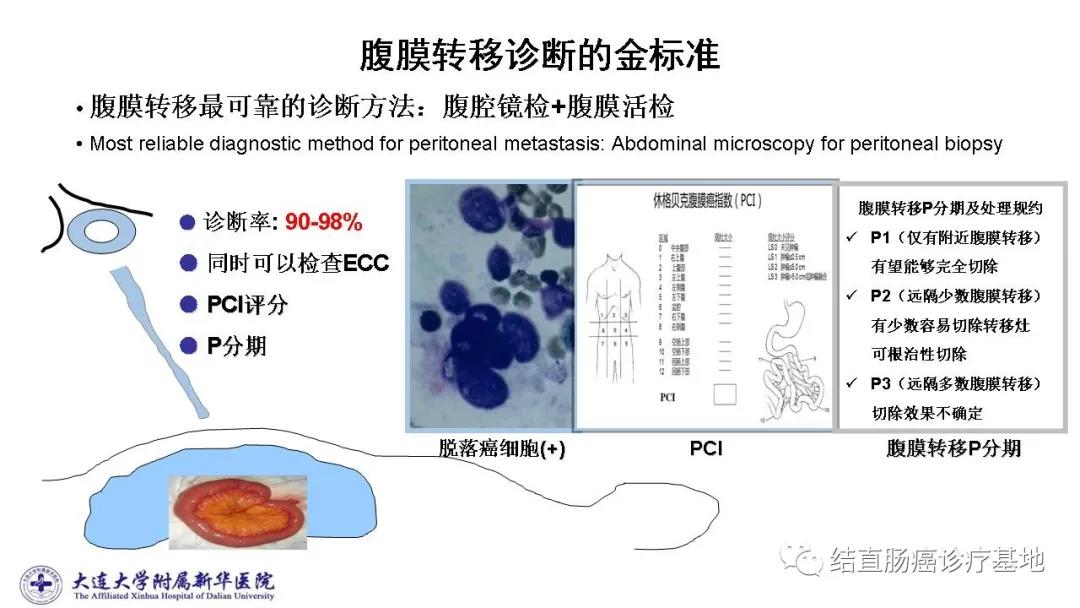
ECOG:0分。治疗前在M1c分期基础上,还要进行腹膜转移P分期+腹膜癌指数(peritonealcancer index,PCI)判定。细胞减灭术(cytoreductive surgery,CRS)适应证为P1、PCI<20,且能够达到完全减瘤。1.依据2012年版日本大肠癌治疗指南腹膜转移P分期及处理规约:该患者为P1(仅有局部/附近腹膜转移)有望能够外科完全切除;2.根据全腹部CT检查提示下腹部腹膜转移可能,初步评定CT腹膜癌指数(CT-PCI)=6。外科评估结果为可切除。腹腔镜探查或开腹探查可准确评价腹膜转移的负荷程度。如果患者经手术探查确定为P1、PCI<20,则可切除。
2.肿瘤学评估
原发灶左半,不存在出血或穿孔,有不全肠梗阻趋势。
原发灶cT4期,N+,局限性腹膜转移可能。
KRAS/NRAS和BRAF V600E野生型具有更好的预后,应积极地进行综合治疗,可能达到无肿瘤残留的状态(No evidence of disease,NED)。
患者经外科学/肿瘤学评估,可能达到NED,可采取开腹探查+CRS+原发灶根切+术中腹腔化疗(intraperitoneal perfusion chemoperfusion,IPC)的治疗策略。如果患者经探查进一步评估为适合手术,建议治疗顺序:(1)首先进行CRS以清除腹腔盆腔腹膜肉眼可见转移灶或转移结节,要求减瘤程度达到CC0-1,同期行原发灶根治性切除;(2)辅以单一药物方案的IPC是可行的。
术中IPC时,患者体内癌细胞负荷小,腹腔内尚未形成粘连,化疗药可以均匀有效到达腹腔各个间隙与潜在的亚临床微小病灶充分接触,且根治性手术和CRS创造了化疗药物杀灭腹腔残留癌细胞的最佳时间窗,可达到较好效果。
局部治疗方式

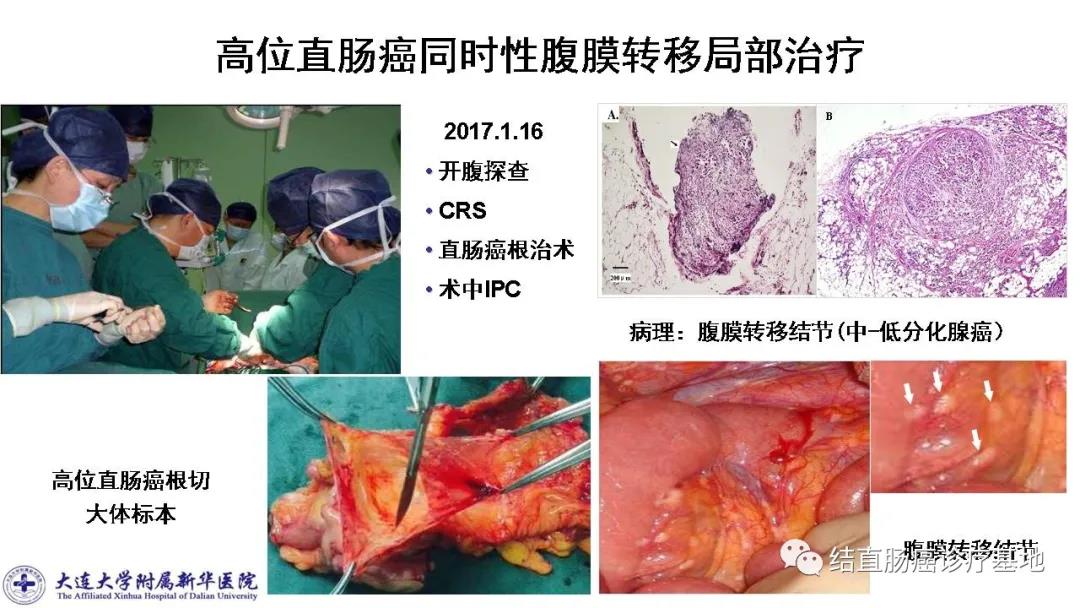
手术探查:全面探查肝脏未见异常,大网膜见散在3枚直径约1.0~1.5cm结节,质硬;在腹膜反折处的腹膜见4枚约0.2~0.3cm结节,均考虑为转移性肿瘤结节。术中评估为P1期,PCI=10。
CRS:切除大网膜,用电刀完全切除腹膜所有肉眼可见的肿瘤结节,细胞减灭满意度(completeness of cytoreduction,CC)评分达到CC- 0。
直肠癌根治术:直肠肿瘤位于腹膜反折上5cm,大小约4×4cm,浸透直肠脏层腹膜。
术中IPC:术毕前,以1000ml温蒸馏水清洗腹腔,并吸尽积液,保护切口。将雷替曲塞(3.0mg/m2)溶解稀释在温生理盐水250ml中,在关腹前将其洒在手术创面及腹腔内,夹闭引流管4小时后开放。雷替曲塞IPC的主要不良反应为可耐受的1~2级消化道反应和2级血小板减少,予以对症处理恢复正常。未发生肠梗阻、切口感染和吻合口漏。
术后病理:直肠溃疡型中-低分化腺癌,癌组织浸透脏层腹膜,并于浆膜外脂肪组织中形成癌结节,侵犯神经,脉管中见癌栓,送检肠周淋巴结见转移癌(10/17),送检肠管(远近端)切缘未见癌。腹膜转移结节均见中-低分化腺癌。
免疫组化结果:Ki67(+60%),S-100(+),CD31(+),CDX2(+),viIIin(+),CK20(+),HER2(-);MSH2(+70%),MSH6(+70%),MLH1(+<5%),PMS2(+30%),符合pMMR。
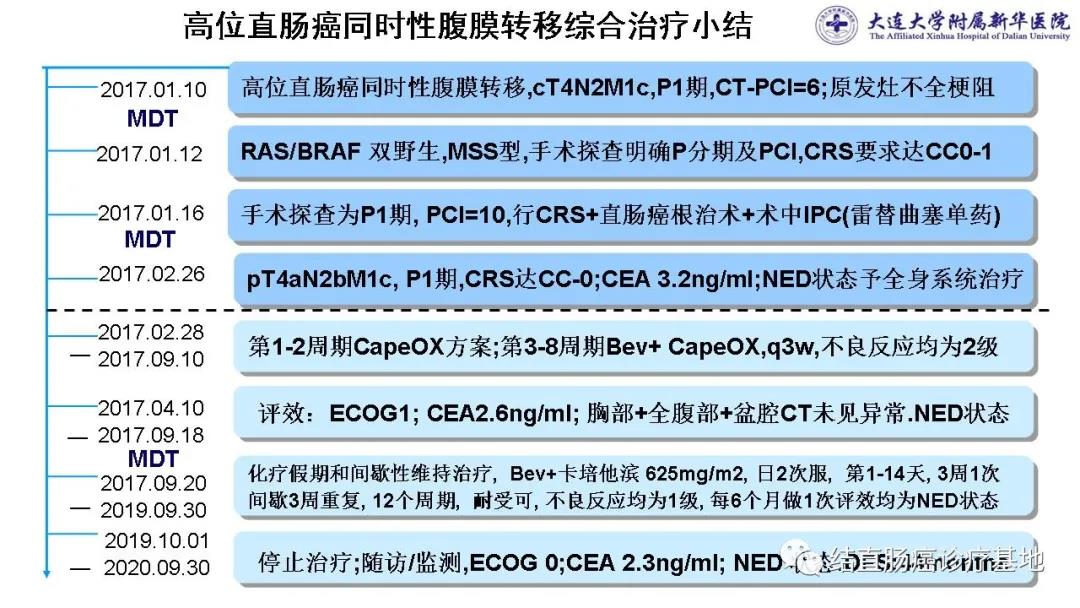
术后诊断与病理分期:高位直肠癌同时性腹膜转移,pT4aN2bM1c,IVc期;腹膜转移P1期(局限性腹膜转移癌);PCI=10(局部治疗小结图片可放大)
局部治疗评效
2017.2.26术后6周,评效:ECOG1,CEA3.2ng/ml;胸部、全腹部+盆腔CT未见明显异常。NED状态。

第2次MDT讨论全身系统治疗

高位直肠癌同时性腹膜转移行CRS+直肠癌根治+术中IPC局部治疗后,给予全身系统治疗是重要的治疗环节,对巩固疗效、预防复发、延长患者生存时间和提高生活质量均有重要意义。患者原发灶为左半、RAS和BRAF V600E双野生型预后较好,术后全身系统治疗以化疗或化疗联合靶向药物为主,治疗目标为NED和无病生存期(Disease-freesurvival,DFS)。
全身系统治疗疗效评价标准:
(1) ECOG评分;
(2)常用相关肿瘤标志物检测;
(3) B超、CT等影像学评价;
(4)WHO肿瘤临床疗效评价标准;
(5)NED和DFS。
术后全身系统治疗
2017年2月28日始,第1~2周期采用XELOX方案,1级消化道反应,患者耐受可。
2017年4月10日评效:患者体能恢复为ECOG 0;CEA1.51ng/mI,CA19-9 9.74U/mI。胸部CT、全腹部+盆腔CT未见明显异常。
2017年4月12日始,在第3~8周期拟采用全身系统化疗+靶向药物。因患者不知真实病情,并顾忌西妥昔单抗的皮疹等不良反应,不接受化疗联合西妥昔单抗单周或两周用药方案,选择了贝伐珠单抗(Bev 7.5mg/kg)+XELOX方案,每3周重复。
在6个周期过程中曾出现1~2级消化道不良反应,白细胞和血小板减少及手足综合症均为2级,经对症处理后恢复正常或明显缓解。
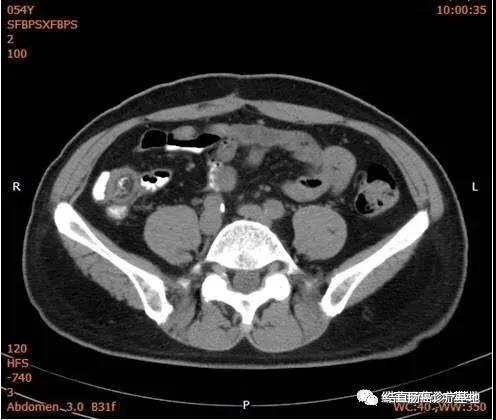
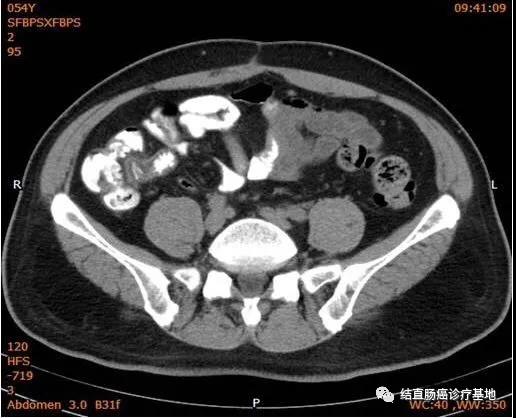
2017年9月18日评效:ECOG1;CEA 2.60ng/mI,CA19-9 9.92U/mI。胸部CT、全腹部+盆腔CT未见明显异常(下腹部CT图片)
第3次MDT讨论维持治疗
目前全身系统治疗时间总长尚无明确的循证医学证据,鉴于腹膜转移复发率高,全身系统治疗6个月后可序贯维持治疗。
维持治疗
2017年9月20日~2019年9月30日,采用化疗假期和间歇维持治疗策略,即“Stop and Go”策略。间歇维持治疗方案:Bev+ Xeloda。Bev 7.5mg/kg , 第1天静点,Xeloda 625mg/m2 ,每日2次口服,第1~14天,3周1次,休3周,重复进行(图片可放大)
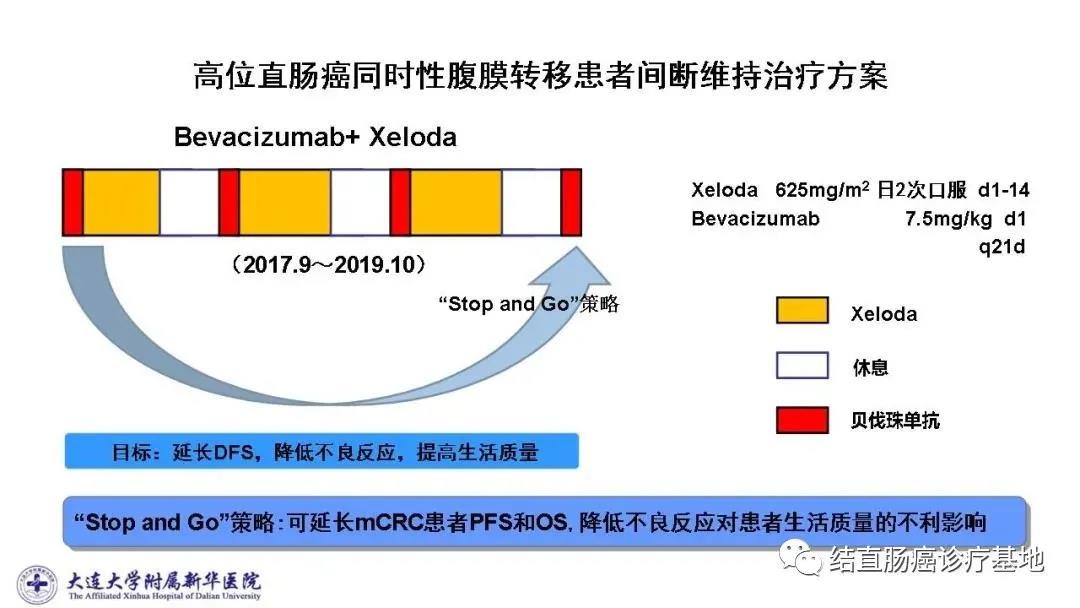
间歇维持治疗预计进行12周期,每6个月做1次评效,治疗期间共进行4次评效。
2018年3月30日评效
ECOG 0;CEA 2.7ng/ml,CA19-9 9.44U/mI。血常规和肝肾功能正常。患者消化道反应、白细胞和血小板减少及手足综合症均为1级,生活质量较好。胸部+全腹部+盆腔CT未见明显异常。
2018年10月9日评效
ECOG 0;CEA 2.4ng/ml,CA19-9 9.07U/mI。血常规和肝肾功能正常。白细胞和血小板减少及手足综合症均为1级,生活质量较好。胸部+全腹部+盆腔CT未见明显异常。
2019年9月28日间歇维持治疗12周期结束后评效:
ECOG 0;CEA 2.1ng/ml,CA19-9 10.62U/mI。血常规和肝肾功能正常。患者消化道反应、白细胞和血小板减少及手足综合症均为1级,生活质量较好。胸部+全腹部+盆腔CT未见明显异常。
2017年1月16日~2019年9月30日,患者接受CRS+直肠癌根治术+术中IPC+全身系统治疗+间歇维持治疗达到了NED目标(CT图片)
2019年10月~2020年8月31日,停止化疗假期和间歇维持治疗,随访/监测,至今存活,生活质量较好,持续保持NED状态,DFS:44个月。
总结与体会
1.综合治疗前尽可能地明确腹膜转移诊断、分期及PCI


2.合理适度的局部治疗和全身系统治疗可生存获益
对于结直肠癌腹膜转移患者,除了在综合治疗前尽可能地明确腹膜转移诊断之外,在M1c分期基础上,还要进行腹膜转移P分期和PCI评估,应积极地采用合理适度的局部治疗和全身系统治疗,力争达到NED目标和DFS。
CRYSTAL研究显示,西妥昔单抗联合FOLFIRI一线治疗RAS野生型mCRC患者可以明显延长患者的PFS及OS。NO16966研究显示,贝伐珠单抗联合化疗一线治疗mCRC患者的OS和PFS均存在获益。CAIRO3 III期研究显示,患者使用一线两药联合化疗方案+靶向药物诱导治疗后疾病稳定或改善,序贯Bev+Xeloda(CAP-B)维持治疗可明显延缓疾病进展,延长患者的PFS,并在已选择的亚组患者中取得了OS的获益。间断维持治疗不但可巩固疗效,还能降低不良反应。
该患者为RAS和BRAF V600E双野生、MSS型高位直肠癌同时性腹膜转移,P1期、PCI=10,经采用CRS达到CC-0,根治性切除原发灶、术中IPC的方式局部治疗后,在患者家属要求保密病情和拒绝用西妥昔单抗的情况下,给予患者全身系统治疗,即全身化疗和化疗联合贝伐珠单抗治疗及间歇维持治疗,至今持续保持NED状态,DFS达44个月,生存获益。
尽管如此,我们仍然担心患者腹腔和盆腔腹膜可能存在影像检查难以发现的微小转移灶,或因患者在随访监测过程中RAS/BRAF V600E发生突变及受MSS/pMMR的影响而导致肿瘤复发及病情进展。据近年文献报道,患者在随访期间动态监测ctDNA水平可在常规影像学和CEA检测之前早期发现疾病复发。因此,下一步的治疗策略应该是监测患者ctDNA水平变化,以早期发现肿瘤复发,早期进行干预。
