奥希替尼一线治疗EGFR突变NSCLC后进展的应对策略,打破耐药窘境
肺癌是恶性肿瘤中的“头号致命物”,严重危害全球人类健康,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%[1]。酪氨酸激酶抑制剂(TKIs)相比含铂双药化疗可更显著地延长无进展生存(PFS),使TKIs成为EGFR+肺癌的标准治疗方案。FLAURA研究中第三代TKI奥希替尼的显著生存获益使其跃然成为一线治疗方案[2],对于如何应对奥希替尼治疗后的获得性耐药也成为了亟待解决的问题,因此对其耐药机制和潜在治疗方案的探讨对后续治疗至关重要。
奥希替尼耐药的评估
奥希替尼与其他肺癌靶向治疗的耐药进展类似,包括缓慢进展、快速进展、脑转移瘤寡进展和全身扩散转移。组织活检以评估常见驱动基因突变位点以及组织学诊断是评估奥希替尼耐药机制的金标准,但仍需综合临床症状以及胸、腹、盆腔以及中枢神经系统的影像学结果判定进展情况。奥希替尼治疗后进展的EGFR+NSCLC的推荐管理办法(图1):
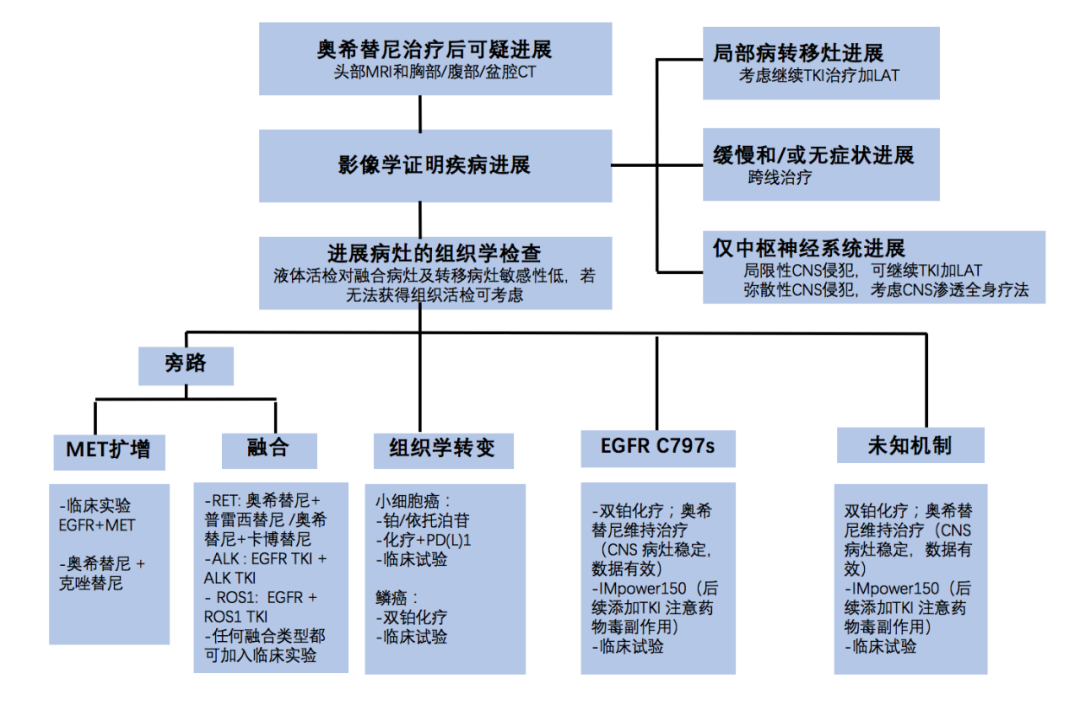
奥希替尼获得性耐药机制及潜在治疗方案
自2013年奥希替尼首次用于临床以来,对其获得性耐药的机制研究一直是研究热点[3],现发布的耐药数据主要集中在≥2线治疗的患者。现有研究结果显示奥希替尼获得性耐药机制主要为间质表皮转化因子(MET)突变、EGFR C797X、组织学类型转化和致癌基因融合四种。
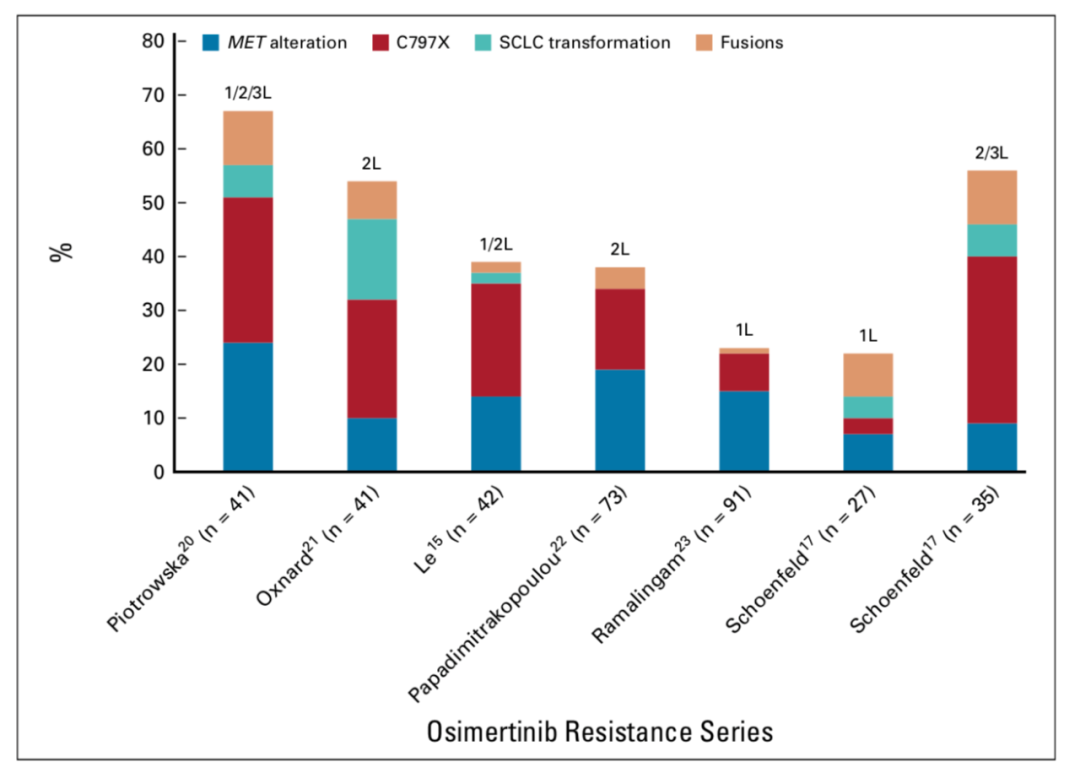
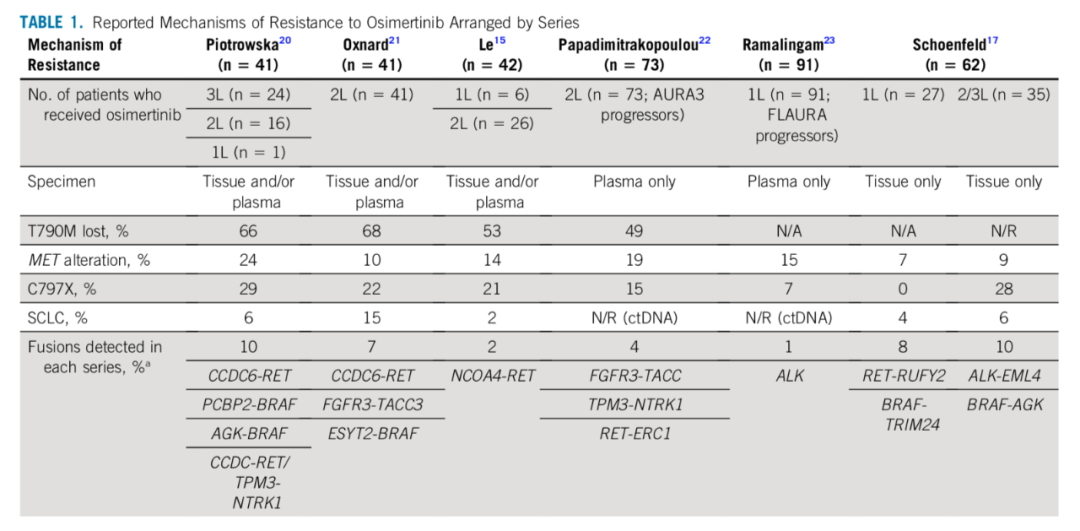
MET突变(7%-24%)
在奥希替尼耐药患者中最常见的旁路途径是MET扩增。在使用奥希替尼治疗的患者中,有10%-24%的患者出MET拷贝数改变[4]。通过二代测序(NGS)或FISH对所有活检组织进行MET扩增评估,可确定哪些患者可能受益于MET和EGFR联合抑制。
TATTON的研究中48例三代TKI治疗后进展患者存在MET扩增,对奥希替尼/沃利替尼的客观缓解率为30%,中位缓解持续时间为7.9个月[5]。SAVANNAH和ORCHARD研究提示,在接受奥希替尼治疗后获得性MET扩增或MET外显子突变的患者中也存在应答病例。因此对于无法参加MET/EGFR-TKI试验的患者,可以考虑超说明书使用这种联合药物治疗。最后,在MET扩增的应答患者中也可以观察到双特异性MET/EGFR抗体JNJ-372[6]。重要的是,对于接受MET/EGFR-TKI联合治疗的MET扩增患者,其治疗效果仍有待观察。
EGFR C797X(0-29%)
EGFR 20号外显子C797S位点突变是最早发现的耐药机制之一。C797S是丝氨酸取代了半胱氨酸的错义突变,位于EGFR的酪氨酸激酶区,使第三代EGFR-TKI无法在ATP结合域内继续形成共价键,导致EGFR-TKI失去了阻断EGFR通路的作用。奥希替尼治疗后的EGFR C797X突变发生率高达28%,但在一线FLAURA试验的血浆样本中却显著降低(7%)[7]。虽然靶向C797S的最佳策略尚未确定,但已经出现了多种潜在的治疗方法。
在一项纳入21例EGFR C797S患者的研究中有7例对EGFR/MET双特异性抗体JNJ-372有反应[8]。在另一项I期试验中,奥希替尼和耐昔妥珠单抗在4例C797S阳性患者中产生2例应答[9]。U3-1402同样在3例C797S患者中出现2例部分缓解[10]。目前正在进行的36项临床试验中,C797S阳性患者在使用上述3种治疗方法。此外,ORCHARD也在研究吉非替尼和奥希替尼联合治疗对一线奥希替尼后出现C797S突变的患者的疗效。
组织学类型转化(2%-15%)
在奥希替尼一线治疗中,约15%的疾病进展患者发生了组织学改变;3%-5%第一代和第二代EGFR-TKIs治疗后癌症进展的患者存在小细胞组织学类型转化[11]。因此对进展病灶的组织活检在后续治疗中至关重要。EGFR+NSCLC中的小细胞肺癌转化与RB1-信号丢失、TP53介导的肿瘤抑制和EGFR信号的丢失密切相关。当发生小细胞肺癌转化时,建议使用铂+依托泊苷化疗。在58例EGFR+小细胞肺癌转化的回顾性研究中,54%的患者对铂+依托泊苷存在临床应答[12]。从发现组织类型转化后观察的中位生存时间是10.9个月(95%CI:8.0-13.7个月)。
值得注意的是,其中17例接受了免疫治疗(纳武利尤单抗单药或Ipilimumab+纳武利尤单抗联合治疗)的患者均无反应,因无一例接受免疫治疗联合化疗,因此尚不清楚化学免疫疗法在EGFR+伴小细胞肺癌转化中的作用。EGFR+小细胞肺癌转化的另一个问题是化疗时或化疗后是否继续使用奥希替尼。尽管转化后的小细胞肺癌克隆可能对EGFR抑制剂不敏感,但亚克隆可能是异质的,腺癌在小细胞肺癌转化后可重新出现,这为在铂+依托泊苷治疗时或治疗后继续使用奥希替尼治疗提供了临床依据。重要的是,当SCLC转化患者的疾病在未来再次进展时,最好(如果可行)重复组织取样,以确定哪个组织学类型的克隆推动进展,并指导后续治疗。
致癌基因融合(1%-10%)
现已确定了奥希替尼治疗后的RET、ALK、BRAF、FGFR3等致癌基因的获得性融合。虽然少见,但融合似乎激活了旁路信号通路并驱动了突变。像MET旁路途径一样,EGFR+改变融合蛋白的抑制剂是一种新的治疗策略,并在一些病例报告中已证明有效性。其中2例患者(1例在二线奥希替尼后获得CCDC6-RET,另1例在阿法替尼治疗后获得NCOA4-RET)随后接受奥希替尼和普拉替尼(BLU-667)治疗均证实有部分应答。第3例患者在阿法替尼治疗后出现CCDC6-RET融合,并证明用奥希替尼和卡博替尼治疗后疾病得到了控制[13]。
Offin等报道了2例经奥希替尼治疗后获得性EML4-ALK融合的病例,这两例均得益于EGFR和ALK-TKIs联合治疗(阿来替尼或克唑替尼)的临床应用[14]。一例接受奥希替尼治疗后获得性AGK-BRAF融合的患者予以奥希替尼+曲美替尼联合用药后因放射检查发现结肠微穿孔而停止治疗,这强调并非所有的TKI组合都是可耐受的,最好在前瞻性临床试验中进行评估[15]。
奥希替尼治疗进展后的化疗
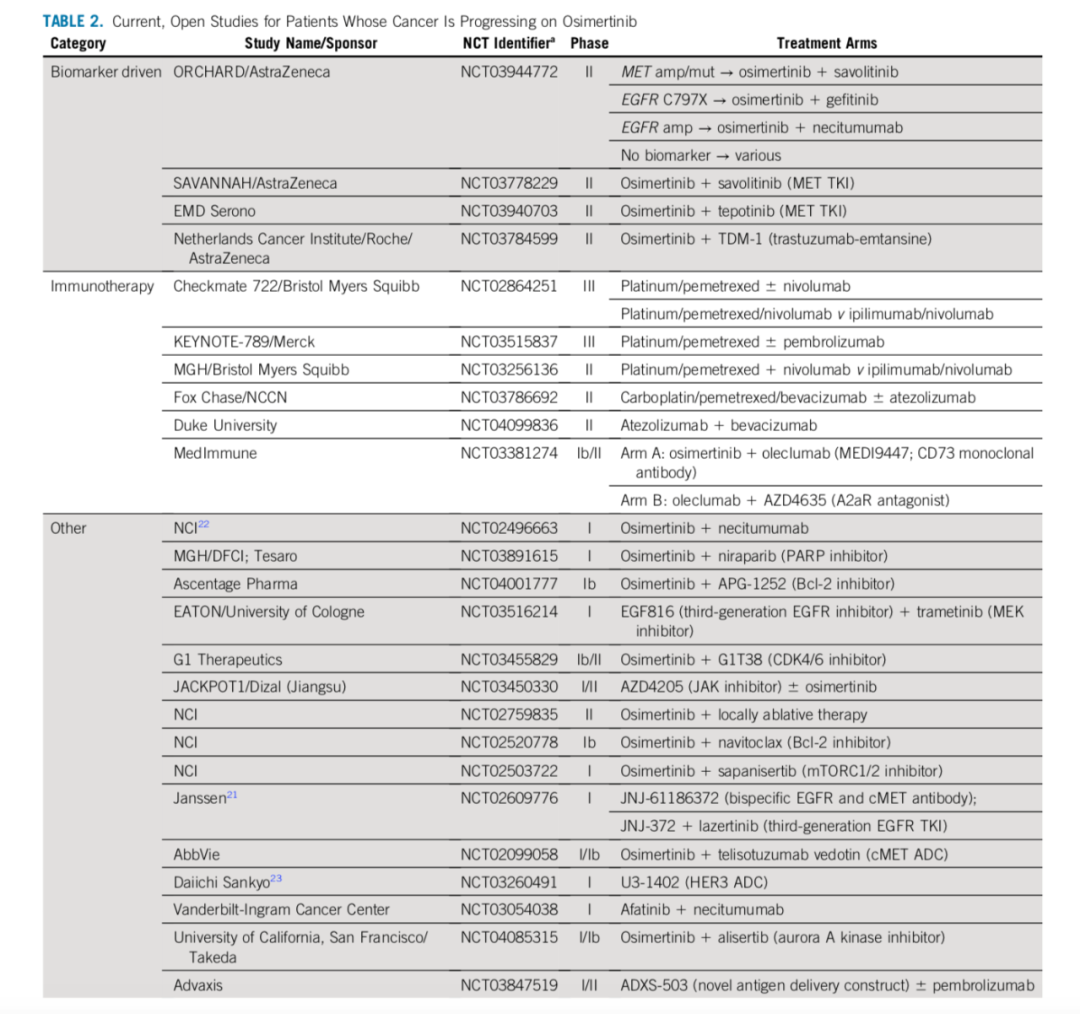
建议对使用奥希替尼治疗癌症进展未确定靶向耐药机制的患者进行临床试验。ORCHARD试验将一线奥希替尼进展后的患者进行了生物标志物匹配和非匹配的治疗对比,并将提供关于最佳二线治疗策略的重要数据。对于那些不能进行临床试验的患者,含铂的化疗仍然是标准治疗方案。IMPRESS III期临床试验研究评估了吉非替尼或安慰剂联合二线铂类化疗的益处,结果显示无PFS或总生存(OS)获益。但是,最近3项III期研究的结果表明,吉非替尼联合化疗在一线治疗中可能有显著的OS获益。同时我们等待来自FLAURA2研究的数据。
免疫治疗
PD-(L)1抑制剂(IO)单药疗法在EGFR突变型NSCLC中几乎没有效果[16]。尽管我们的实验表明,不管PD-L1表达如何,在一线后的治疗使用IO应答率小于10%,中位持续时间小于1个月,但近来IMMUNOTARGET注册的数据显示PD-L1高水平可预测EGFR突变型NSCLC的IO获益[17]。
IMpower150结果显示阿替利珠单抗+贝伐珠单抗+化疗(卡铂/紫杉醇)(ABCP)时,PFS和OS都有获益,并优于化疗联合抗血管生成治疗,也优于免疫治疗。这也是现今唯一体现化学免疫治疗在EGFR+患者中有治疗效果的研究[18]。这些结果增加了PD-L1抑制剂和抗血管生成剂可改善EGFR阳性疾病患者化疗效果的可能性。更多正在进行中的研究将会进一步确定抗血管生成药物、免疫治疗和化疗在EGFR阳性疾病中的作用(表2)。
值得注意的是,新出现的数据表明,病人接受免疫治疗后予以EGFR-TKI治疗,药物毒副作用发生可能更频繁。免疫治疗序贯使用TKI似乎也增加并发肺炎的风险,最近的一系列回顾性研究表明,当患者在接受免疫检查点抑制剂治疗的3个月内开始服用奥希替尼时,严重的免疫相关不良事件,尤其是肺炎的发生率高达24%。因此对于近期接受免疫治疗的患者,应谨慎使用奥希替尼[19]。
脑转移
EGFR+肺癌出现中枢神经系统转移的概率约20%[7],奥希替尼强大的中枢神经系统渗透性可能是该药物成功控制脑部转移病灶的原因之一[20]。在FLAURA中具有神经系统转移的患者,奥希替尼将其PFS提高至15.2个月(95%CI:12.1-21.4)VS 第一代TKIs 9.6个月(95%CI:7.0-12.4)[7]。BLOOM试验表明,奥希替尼对软脑膜疾病(LMD)患者有效,88例LMD患者口服奥希替尼160mg/日,在用药12周后影像学显示,23例病情稳定或改善,神经功能评估中8例患者中有7例症状改善[21]。
总结
奥希替尼常见获得性耐药机制为MET突变、EGFR C797X 、组织学类型转化和致癌基因融合,在获得性耐药后需完善影像学检查,明确组织病理类型,评估常见驱动基因突变位点,根据结果指导下一步治疗。总得来说,一线使用奥希替尼较一线使用一代药物相比有更好的生存期改善,奥希替尼一线治疗出现耐药后也依然可以根据患者不同的突变类型做出个体化的后续治疗决策,并不存在耐药后无药可用的窘境。
审稿专家

常建华教授
中国医学科学院肿瘤医院深圳医院
医学博士、主任医师
中国研究型医院学会分子肿瘤与免疫治疗专委会副主任委员
中国医药教育协会肿瘤化学治疗专委会副主任委员
中国临床肿瘤学会非小细胞肺癌专委会常务委员
中国抗癌协会肿瘤临床化疗专委会常务委员
中国医药教育协会肺部肿瘤专委会常务委员
中国抗癌协会肺癌专业委员会委员
中国抗癌协会肿瘤药物临床研究专委会委员
中国抗癌协会肿瘤精准治疗专委会委员
中国临床肿瘤学会小细胞肺癌专委会委员
中国临床肿瘤学会抗血管生成专委会委员

穆新林教授
北京大学人民医院
呼吸与危重症医学科主任医师 医学博士
北京肿瘤防治研究会内镜分委会主任委员
北京肿瘤学会临床研究专业委员会常委
北京肿瘤防治研究会委员
北京市医学会呼吸病学分会肺癌学组委员
中国肺癌防治联盟-北京肺癌防治联盟委员
《中华结核和呼吸杂志》《国际呼吸杂志》通讯编委
主要从事肺癌早期诊断和治疗、肺部疾病介入治疗等临床工作。
(排名按照拼音,不分先后)
参考文献
[1] Bray, F., et al., Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018.
[2] Ramalingam SS, Vansteenkiste J, Planchard D, et al: Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med 382:41-50, 2020
[3] Piotrowska Z, Niederst MJ, Karlovich CA, et al: Heterogeneity underlies the emergence of EGFRT790 wild-type clones following treatment of T790M-positive cancers with a third-generation EGFR inhibitor. Cancer Discov 5:713-722, 2015
[4] Schoenfeld, A.J., et al., Tumor Analyses Reveal Squamous Transformation and Off-Target Alterations As Early Resistance Mechanisms to First-line Osimertinib in EGFR-Mutant Lung Cancer. Clin Cancer Res, 2020. 26(11): p. 2654-2663.
[5] Oxnard, G.R., et al., TATTON: a multi-arm, phase Ib trial of osimertinib combined with selumetinib, savolitinib, or durvalumab in EGFR-mutant lung cancer. Annals of Oncology, 2020. 31(4): p. 507-516.
[6] Haura EB, Cho BC, Lee JS: JNJ-61186372(JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer(NSCLC). J Clin Oncol 37:9009, 2019(suppl 15)
[7] Le X, Puri S, Negrao MV, et al: Landscape of EGFR-dependent and -independent resistance mechanisms to osimertinib and continuation therapy beyond progression in EGFR-mutant NSCLC. Clin Cancer Res 24:6195-6203, 2018
[8] Haura EB, Cho BC, Lee JS: JNJ-61186372(JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer(NSCLC). J Clin Oncol 37:9009, 2019(suppl 15)
[9] Reiss JW, Grosehn SG, Reckamp KL: Osimertinib(Osi) plus necitumumab(Neci) in EGFR-mutant NSCLC: An ETCTN California cancer consortium phase I study. J Clin Oncol 37:9057, 2019(suppl 15)
[10] Janne PA, Yu HA, Johnson ML: Safety and preliminary antitumor activity of U3-1402: A HER3-targeted antibody drug conjugate in EGFR TKI-resistant, EGFRm NSCLC. J Clin Oncol 37:9010, 2019(suppl 15)
[11] Sequist LV, Waltman BA, Dias-Santagata D, et al: Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 3: 75ra26, 2011
[12] Marcoux N, Gettinger SN, O’Kane G, et al: EGFR-mutant adenocarcinomas that transform to small-cell lung cancer and other neuroendocrine carcinomas: Clinical outcomes. J Clin Oncol 37:278-285, 2019
[13] Piotrowska Z, Isozaki H, Lennerz JK, et al: Landscape of acquired resistance to osimertinib in EGFR-mutant NSCLC and clinical validation of combined EGFR and RET inhibition with osimertinib and BLU-667 for acquired RET fusion. Cancer Discov 8:1529-1539, 2018
[14] Offin M, Somwar R, Rekhtman N, et al: Acquired ALK and RET gene fusions as mechanisms of resistance to osimertinib in EGFR-mutant lung cancers. JCO Precis Oncol 2:1-12, 2018
[15] Dagogo-Jack I, Piotrowska Z, Cobb R, et al: Response to the combination of osimertinib and trametinib in a patient with EGFR-mutant NSCLC harboring an acquired BRAF fusion. J Thorac Oncol 14:e226-e228, 2019
[16] Lee CK, Man J, Lord S, et al: Clinical and molecular characteristics associated with survival among patients treated with checkpoint inhibitors for advanced non- small cell lung carcinoma: A systematic review and meta-analysis. JAMA Oncol 4:210-216, 2018
[17] Mazieres J, Drilon A, Lusque A, et al: Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: Results from the IMMUNOTARGET registry. Ann Oncol 30:1321-1328, 2019
[18] West H, McCleod M, Hussein M, et al: Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130): A multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 20:924-937, 2019
[19] Schoenfeld AJ, Arbour KC, Rizvi H, et al: Severe immune-related adverse events are common with sequential PD-(L)1 blockade and osimertinib. Ann Oncol 30: 839-844, 2019
[20] Ballard P, Yates JW, Yang Z, et al: Pre- clinical comparison of osimertinib with other EGFR-TKIs in EGFR-mutant NSCLC brain metastases models, and early evidence of clinical brain metastases activity. Clin Cancer Res 22:5130-5140, 2016
[21] Yang JCH, Kim S-W, Kim D-W, et al: Osimertinib in patients with epidermal growth factor receptor mutation-positive non-small-cell lung cancer and lep- tomeningeal metastases: The BLOOM study. J Clin Oncol 38:538-547, 2020