肺腺癌发病风险相关新基因——ATM;热门靶点TIGIT抑制剂获批五项临床试验
要点提示:
JTO:ATM是一个中等外显率的肺腺癌发病风险相关基因
JNCI:低风险前列腺癌患者主动监测方案优化:纳入MRI和生物标志物检测
新药:”first-in-class”多发性骨髓瘤创新疗法获优先审评
新药:罗氏TIGIT单抗在中国获批5项临床试验
1、JTO:ATM是一个中等外显率的肺腺癌发病风险相关基因
近日,一项通过罕见有害变异(RDVs)的基因负荷鉴定肺腺癌(LUAD)的遗传风险因素的病例对照关联研究结果发表在Journal of Thoracic Oncology上。研究结果显示:共济失调毛细血管扩张突变(ATM)是一个中等外显率的肺腺癌发病风险相关基因。

这项研究分析了1083名LUAD患者和7650名对照的生殖系全外显子组测序(WES)数据。研究者通过使用ACMG遗传变异分类标准与指南和ClinVar数据库,对所有罕见的致病性变体进行了注释,并通过惩罚Logistic回归方法研究了基因水平的RDV负荷。
结果显示,LUAD患者中生殖系共济失调毛细血管扩张突变(ATM)的RDV负荷显著高于对照组(ORcombined=4.6;p=1.7e-04;95%CI 2.2-9.5;病例:1.21%;对照:0.24%)。在MSK-IMPACT研究中,1594名LUAD患者组成的孤立临床队列也显示出了较高的生殖系ATM RDV负荷(0.63%)。此外,在阿什肯纳兹犹太人群中,病例组中的ATM变异(rs56009889)发生频率也显著高于对照组(p=6.9e-03,95%CI 1.3-5.3)。
研究者表明,ATM是一个中等外显率的LUAD风险基因,并且LUAD可能是ATM相关癌症综合征谱的一部分。拥有ATM RDV个体的LUAD发病风险较高,可以通过从加强随访监测(尤其是CT扫描)、早期发现并采取化学预防措施,就能够改善患者预后。
2、JNCI:低风险前列腺癌患者主动监测方案优化:纳入MRI和生物标志物检测
目前低风险前列腺癌(PC)的主动监测(AS)方案会导致患者不必要的痛苦以及过度诊疗。8月31日,一项评估使用Stockholm3测试和MRI是否能够降低AS方案的活检强度的研究发布在Journal of the National Cancer Institute上。

研究者对280名受邀参加当代筛查研究(STHLM3)的患者进行了一项前瞻性的多中心研究,使用了当前格里森评分(GS)3+3 PC的AS方案。患者进行了前列腺MRI和血液采样,并以Stockholm3测试进行分析,包括蛋白生物标志物、遗传变异和临床变量,以预测GS≥3+4 PC的风险。然后对所有患者进行系统活检和靶向活检(针对PIRADS≥3病变)。主要结果为根据美国国家综合癌症网络(NCCN)指南重新分型为GS≥3+4 PC和临床上显著的PC(csPC),包括不利的中风险或更高风险PC。
结果显示,与单独的系统性活检相比,在系统性活检中加入MRI靶向活检增加了GS≥3+4 PC的诊断灵敏度[相对灵敏度(RS)=1.52;95%CI 1.28~1.85]。仅在MRI阳性的个体中进行活检,增加了GS≥3+4 PC的诊断灵敏度(RS=1.30;95%CI 1.04~1.67),减少了49.3%的活检手术次数,同时遗漏了7.2%GS≥3+4 PC和1.4%csPCa。剔除Stockholm3试验阴性的患者,使随访时MRI调查次数减少22.5%,活检次数减少56.8%,但遗漏了6.9%的GS≥3+4PC和1.3% csPCa。
研究表明,在AS期间,加入MRI和靶向/系统活检增加了PC重新分型的诊断灵敏度。纳入包括生物标志物在内的风险预测模型可能还能够降低低风险PC患者对MRI的使用需求。
3、新药:”first-in-class”多发性骨髓瘤创新疗法获优先审评
日前,Oncopeptides AB公司宣布,美国食品药品监督管理局(FDA)接受其为melflufen递交的新药申请(NDA),并且授予其优先审评资格。适应证为治疗对至少对一种蛋白酶体抑制剂,一种免疫调节剂和一种抗CD38单克隆抗体疗法产生耐药性三重疗法耐药的多发性骨髓瘤(MM)患者。FDA预计将于明年2月28日之前做出回复。Melflufen是一款“first-in-class”肽偶联药物(peptide-drug conjugate,PDC)。

这一申请是基于关键性Ⅱ期临床试验HORIZON的结果。在这项临床试验中,静脉注射melflufen与地塞米松联用,在治疗复发/难治性MM患者时表现出可喜的疗效和安全性特征,在治疗三重耐药的复发/难治性MM患者时,达到26%的总缓解率。
4、新药:罗氏TIGIT单抗在中国获批5项临床试验
8月30日,国家药品监督管理局药品审评中心(CDE)官网显示罗氏TIGIT单抗Tiragolumab注射液在中国已经获批开展5项临床试验。TIGIT是肿瘤免疫治疗中最有前景和潜力的靶点之一。
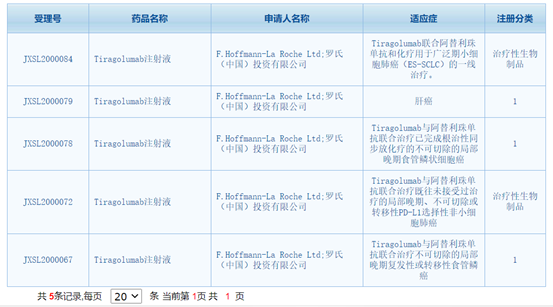
该药适应证涉及广泛期小细胞肺癌(ES-SCLC)、肝癌、局部晚期食管鳞状细胞癌和局部晚期、不可切除或转移性PD-L1选择性非小细胞肺癌。
参考资料:
[1]SMyvizhi Esai Selvan,Marjorie G.Zauderer,Charles M.Rudin,Siân Jones,Semanti Mukherjee,Kenneth Offit,Kenan Onel,Gad Rennert,Victor E.Velculescu,Steven M.Lipkin,Robert J.Klein,Zeynep H.Gümüş,Inherited rare,deleterious variants in ATM increase lung adenocarcinoma risk,Journal of Thoracic Oncology,2020,
[2]Henrik Olsson,MSc,Tobias Nordström,MD,PhD,Fredrik Jäderling,MD PhD,Lars Egevad,MD,PhD,Hari T Vigneswaran,MD,Magnus Annerstedt,MD,Henrik Grönberg,MD,PhD,Martin Eklund,PhD,Anna Lantz,MD,PhD,Incorporating MRI and biomarkers in active surveillance protocols-results from the prospective Stockholm3 Active Surveillance trial(STHLM3AS),JNCI:Journal of the National Cancer Institute,,djaa131,https://doi.org/10.1093/jnci/djaa131
[3]https://news.cision.com/oncopeptides-ab/r/fda-grants-priority-review-of-melflufen-for-patients-with-triple-class-refractory-multiple-myeloma,c3177364
[4]http://www.cde.org.cn/news.do?method=changePage&pageName=service