打开“黑”匣子!白雪博士、Igor Puzanov教授共话晚期黑色素瘤免疫治疗新进展
对于BRAF V600E/K突变型黑色素瘤,免疫检查点抑制剂和靶向治疗使用先后的标准方案尚未建立。来自美国罗斯威尔帕克癌症研究所的Igor Puzanov教授及其研究团队汇总了KEYNOTE-001、KEYNOTE-002以及KEYNOTE-006三项大型临床试验的数据,详细分析了晚期黑色素瘤中BRAF V600E/K突变状态以及既往BRAF抑制剂单药或联合MEK抑制剂治疗对帕博利珠单抗疗效的影响。该研究成果于近期发表于《美国医学会杂志·肿瘤》(JAMA Oncology)杂志上。【肿瘤资讯】有幸邀请到北京大学肿瘤医院郭军教授团队成员白雪博士与Igor Puzanov教授展开对话,基于该研究展开了黑色素瘤免疫治疗的深度探讨。


白雪
主治医师
北京大学肿瘤医院肾癌黑色素瘤内科主治医师
2010年起师从著名黑色素瘤和泌尿系肿瘤专家郭军教授,2015年获肿瘤学临床型博士学位。
2017-2019年作为postdoctoral research fellow在美国哈佛大学医学院/麻省总医院从师黑色素瘤靶向治疗奠基人Keith Flaherty教授进行晚期黑色素瘤的靶向及免疫治疗相关研究。
作为一作/共同一作发表多篇SCI论文,最高影响因子53。2020年ASCO Merit Award黑色素瘤领域亚洲唯一获奖者。

Igor Puzanov
M.D., M.S.C.I., F.A.C.P.
Director, Early Phase Clinical Trials Program
Chief, Melanoma Section
Co-Leader, CCSG Experimental Therapeutics Program
Professor of Oncology, Department of Medicine
Roswell Park Comprehensive Cancer Center
白雪博士:很高兴与您见面。首先恭喜您在JAMA Oncology杂志上发表了您的研究,基于您的研究结果,我们知道,无论患者的BRAF V600E/K突变状态以及既往是否接受过BRAF抑制剂单药或联合MEK抑制剂治疗,PD-1单抗帕博利珠单抗用于晚期黑色素瘤患者都是可行的,这一研究结果为临床上黑色素瘤的管理提供了非常有价值的新认知。那么对于BRAF突变的患者一线治疗,您更倾向于使用PD-1单抗治疗还是BRAF抑制剂联合MEK抑制剂治疗?
Igor Puzanov教授:这是个非常好的问题,我个人会选择免疫治疗。我们知道,CheckMate 067研究评估了纳武利尤单抗联合伊匹木单抗、纳武利尤单抗单药和伊匹木单抗单药治疗黑色素瘤的效果,患者取得了52%的5年生存率。纳武利尤单抗单药组的5年生存率约为44%,与KEYNOTE 001、002、006研究汇总分析的结果非常相似;当采用纳武利尤单抗联合伊匹木单抗治疗,患者的5年生存率达到了52%,有了显著的提高。这项研究也同时探讨了BRAF突变患者,5年生存率甚至更高,达到了60%。这一生存获益主要是得益于纳武利尤单抗与伊匹木单抗联合使用。在我看来,对于Ⅲ到Ⅳ期黑色素瘤患者而言,这一联合治疗方法目前取得了最好的生存。尤其是对于BRAF突变患者,联合使用伊匹木单抗治疗有望获得相当不错的生存期延长,除非患者在治疗期间出现严重的不良反应,无法耐受治疗。因此,纳武利尤单抗联合伊匹木单抗可以被推荐作为这类人群的优选方案。
白雪博士:对于纳武利尤单抗和伊匹木单抗这一联合方案,有一种说法是联合用药在疗效上呈现相加作用,而在毒性上呈现协同作用。对此,您如何看待?
Igor Puzanov教授:其实很多研究都选择了靶向、纳武利尤单抗以及伊匹木单抗等疗法,甚至有研究选择如Encorafenib联合Binimetinib作为导入期优化治疗,随后探索联合免疫治疗的安全性。相关已发表的研究成果显示,CTLA-4单抗伊匹木单抗的有效性依赖肿瘤细胞表面表达的MHC Ⅰ类分子;PD-1单抗与其具有互补作用,不同免疫治疗药物之间是否存在叠加抑或协同作用,是非常值得探索的问题。对于接受不同治疗方案的患者的疗效以及毒性,依匹木单抗和PD-1单抗的剂量是非常值得关注的。意大利的一项研究显示,伊匹木单抗采用10 mg/kg剂量,30%的患者能够达到长期生存;而3 mg/kg剂量下,患者的长期生存率仅有22%。
我认为您说的很对,但是我们同样需要考虑的关键的问题是,能否通过更强效的治疗方案更早为患者带来获益。至于联合方案的毒性,我的一部分工作就是管控药物研发过程中的毒性。在药物开发和使用过程中,毒性管控是不可或缺的,这对于改善患者的预后非常重要,特别是对于一些靶向药物,如VEGFR靶向药和免疫治疗药物。研究显示,PD-1单抗与CTLA-4单抗联合治疗,会一定程度上增加死亡率,但并没有超出太多。在接受帕博利珠单抗单药与纳武利尤单抗单药时,因为不良事件导致的患者死亡率约为0.4%;CTLA-4抗体单药治疗时,死亡率为1%;纳武利尤单抗联合伊匹木单抗时,死亡率为1.2%。虽然死亡率在数值上有提高,但差异值仅有0.8%。如果患者的5年生存率显示,联合方案可以带来比较大的获益,还是值得尝试的。
目前,有很多研究正在探索抗PD-1治疗后,后续使用纳武利尤单抗、伊匹木单抗或帕博利珠单抗的剂量及效果,近期就有一个很不错的案例。芝加哥大学的一项小范围Ⅱ期临床试验,研究者前线使用帕博利珠单抗,后续联合1 mg/kg伊匹木单抗治疗,患者的应答率达到27%,显示了二线联合治疗的有效性。总体而言,黑色素瘤的治疗是一个漫长的过程,我们一直致力于改善患者的生存。过去,黑色素瘤患者的生存期往往只有1~2年,5年生存率不到5%;而如今,美国的数据显示,自2008年以来,免疫治疗的使用已经使黑色素瘤的治疗和研究取得了显著的进步。
白雪博士:在一线治疗选择上,肿瘤生长情况以及肿瘤负荷,对纳武利尤单抗联合伊匹木单抗或是联合使用通路抑制剂的用药选择有影响吗?
Igor Puzanov教授:这个问题非常好,我们在过去几年一直致力于解答这一问题,尤其是对于占比近45%的BRAF突变型黑色素瘤患者。我们的研究将BRAF突变患者分为了两组,接受不同的治疗,一组患者肿瘤负荷较低,分子特征也显示患者的侵袭性不那么强,对于这些患者,无论采取免疫治疗还是靶向治疗,都可以取得不错的长期生存;如Columbus研究就达到了34%的5年生存率。因此,如果患者的肿瘤负荷较低,LDH水平较低,病灶少于三处,PS状态好,治疗效果会更好。另外,免疫系统的响应也值得关注,患者的免疫系统做出反应后,CD8+ T细胞会向肿瘤募集;当出现耐药时,这些免疫效应会大幅减弱。相比而言,对于另一组BRAF表达情况和一般水平都较差的患者,即使用了BRAF+MEK靶向联合治疗,甚至联合PD-1单抗治疗,以期降低患者的肿瘤负荷,但最终这些患者都在14个月内死亡,中位生存期约5个月。这一结果与结直肠癌BRAF突变患者的数据非常相近,在结直肠癌治疗中,我们通常会联合使用EGFR抑制剂。
2012~2013年左右发布在Nature杂志上的结直肠癌相关研究显示,在BRAF与EGFR联合靶向治疗的情况下,BRAF突变型结直肠癌细胞对药物治疗更加敏感,患者的生存也更长。过去,诸多研究都表明,BRAF突变型患者中,有一部分人群治疗获益甚微,无论采取何种疗法,他们大多都在短期内死亡。因此,我们非常关注这类患者的治疗。目前,虽然BRAF突变患者能够对治疗产生响应,但最终结局仍然是难以改变的。未来,我们期望采取更好的靶向措施,现在我倾向于联合治疗。这方面我们仍然需要更多的尝试,我们尝试在纳武利尤单抗联合伊匹木单抗治疗后,经过3周的间歇再加用2周的Binimetinib治疗,但接受三联治疗的患者,只能达到6-8个月的生存。MEK通路抑制剂、PD-1抗体、CTLA-4抗体等方案,联合治疗有可能存在叠加效果,但有待进一步探索。总体而言,对于这类患者,我们需要新的治疗方法。黑色素瘤的治疗,我们还是需要借鉴其他瘤种的治疗和研究经验。
白雪博士:Keith Flaherty、David Fisher教授和我去年在Nature Reviews Clinical Oncology上发表的一篇综述,探讨了细胞层面的黑色素瘤转化研究。研究证实,在耐药株细胞中,可能存在酪氨酸激酶受体等相关通路的激活。是否可以考虑这些相关通路的抑制剂与PD-1抗体联合,治疗黑色素瘤?
Igor Puzanov教授:的确,我们需要做更多的科学实验,可能还需要在细胞层面上展开进一步的筛选和探索。您的想法与我的思路很一致,我也认为这可能是未来靶向治疗的新方向。问题在于,我们可以考虑采用多靶点抑制剂,患者的治疗效果可能更好;也可以研发特异性更强的抑制剂。但也意味着更高的开发难度或更高的药物毒性,尤其是在药物出现脱靶效应时,其毒性对正常器官而言,可能会相当严重,甚至造成视力损伤乃至失明。
此外,我们在制定初步的药物研发方案时,首先是希望药物能够见效,之后才会去检测其毒性。因此,明确药物的靶点非常重要,确保所使用的抑制剂不会产生严重的脱靶效应。我们需要药物是选择性有效,即只对需要的靶向目标有效,不会伤害到其他诸如眼睛等正常器官。此外,药物的选择也与不同的瘤种相关,在某个肿瘤上无法获益,在其他肿瘤或其他分型的患者,却有可能见效。细胞的分型在肿瘤之间存在一定的相似性的,比如前列腺癌细胞的分化、耐药性的产生、表观遗传学的改变,都可以作为黑色素瘤研究中的参考。在未来的几十年,我们或许能够很好地运用靶向治疗以及一些免疫治疗,甚至使用一些注射型的改良病毒疫苗,去改善免疫微环境,治疗特定的肿瘤。
白雪博士:对于刚刚获得批准的三联疗法,即BRAF,MEK以及PD-1/PD-L1抑制剂联合治疗,您有何看法?您如何看待这一联合方案给患者带来的生存获益数据?
Igor Puzanov教授:没错,回顾多年以来各种不同的联合疗法,相比之下,这种疗法确实获得了非常可喜的生存获益。在这之前,我们尝试过三联用药治疗黑色素瘤患者,结果都相当不错;三联疗法的方案,也在一直改进中,加入帕博利珠单抗就是改进之一。你所说的获得批准的三联疗法,在AACR大会发表,最重要的并非总体生存期的提高,而是PFS的改善。统计数据虽然体现出了显著的生存期获益,但也只是几个月的提高而已。值得注意的是,该研究的主要终点是由研究者评估的PFS,观察到显著的生存获益;但孤立评估委员会的数据去没有看到统计学上具有显著差异的PFS获益。当然,基于这项研究结果,治疗方法的获批是没有问题的。
未来,我们仍有很长的一段路要走,会有很多不同的组合方式。就我个人来说,非常高兴看到Cobimetinib加入三联治疗的可行性,已经有不少其他瘤种的研究评估了这一药物,能否在黑色素瘤中发挥作用,非常值得期待。
白雪博士:当患者接受MEK抑制剂联合治疗时出现疾病进展,是否可以联用PD-1抗体治疗?这不是一线使用,而是进展后的治疗。
Igor Puzanov教授:我们之前在临床上有这一方案治疗过,并获得不错的效果,这种实践在美国是允许的。我承认,我们可能还需要收集更多的数据,以证实这种方法是否可行。但在我们的临床试验中,出现疾病进展的患者,接受第三种药物后,确实有不错的获益,相当一部分病情能够取得稳定。但可能涉及到统计分析时,就会面临很多问题,比如患者的选择、试验过程中的事件记录,有些患者参与试验后有效可能会继续这种治疗;而无效的患者可能会退出试验,最终如何去评定这种治疗方法的有效性?
在我的临床实践中,从2016、2017年以来,有5~6个患者是长期参与试验的,一开始是接受单药或双药联合治疗,后来又通过三联治疗抑制疾病进展。其中有一个女性患者已经存活了4年,非常乐意继续参与试验接受治疗,这大概是我试验过程中接触时间最长的病例。另一个男性病例,也依然存活,6年以来我们一直保持联系,现在他已经88岁了,即使我们告知他,可以停用帕博利珠单抗,他也表示不想停用。当然,还是有一小部分患者没能从中获益,对于这类患者,是否应该终止三联治疗,仍有待探索。
我们需要进一步了解这些患者的肿瘤生物学情况,比如说耐药性等,再讨论疾病进展。肿瘤本身的具体情况,对于我们如何选择治疗方法是很重要的。我们知道,传统的化疗,联合靶向治疗也能够起到一定激活肿瘤微环境的作用,原理类似于免疫疗法。这种方法在体外可能并不会杀死细胞,只会让细胞周期减缓,但在患者体内,则能够达到很强的杀伤肿瘤的效果,使CD8+效应T细胞被激活,并募集到肿瘤微环境中。即使采取BRAF抑制剂或靶向治疗,杀伤肿瘤仍然需要免疫系统的参与的。
目前,已经在肺癌患者中证实,化疗联合帕博利珠单抗、伊匹木单抗或是纳武利尤单抗都能够起到这种活化作用,使恶性部位更能够被免疫系统识别。针对黑色素瘤的研究,如果能够改善耐药细胞对化疗的敏感性,将会是治疗黑色素瘤的重大进步,而联合用药的组合选择,也是未来非常值得关注的研究重点。
研究介绍
研究背景
随着靶向药物和免疫检查点抑制剂的出现,转移性黑色素瘤患者的治疗前景有了很大改善。对于BRAF野生型(WT)黑色素瘤患者,目前的指南推荐使用PD-1抑制剂单药治疗或PD-1抑制剂联合CTLA-4抑制剂治疗。约40%的转移性黑色素瘤患者携带BRAF突变,其中90%以上患者携带BRAF V600E/K激活突变。BRAF V600突变型黑色素瘤标准治疗包括BRAF抑制剂和MEK抑制剂的联合应用以及免疫治疗。由于这些方案具有不同的机制和毒副作用,目前尚不清楚BRAF V600突变型黑色素瘤患者获得最佳疗效和耐受性的治疗方案。
研究方法
该研究分析评估了KEYNOTE-001,KEYNOTE-002,KEYNOTE-006三项大型临床试验中BRAF V600突变型黑色素瘤亚组对于接受帕博利珠单抗的数据结果。KEYNOTE-001:该研究是开放标签的Ⅰ期临床试验,证实帕博利珠单抗在晚期转移性黑色素瘤中有效。KEYNOTE-002:该研究是一项随机双盲的Ⅱ期临床试验,对比了化疗方案与帕博利珠单抗在难治性晚期黑色素瘤患者中的疗效。KEYNOTE-006:该研究是一项随机开放标签的Ⅲ期临床试验,入组接受过一线治疗后(既往未使用过伊匹木单抗)的黑色素瘤患者,旨在评估伊匹木单抗联合帕博利珠单抗方案的疗效。对于以上三个临床试验中亚组进行分析评估,其中包括BRAF野生型和突变型,在突变型患者中又分为既往接受或未接受过BRAF抑制剂和MEK抑制剂治疗的患者。
研究结果
研究纳入1558例经帕博利珠单抗治疗后的黑色素瘤患者(其中647例来自KEYNOTE-001,361例来自KEYNOTE-002,550例来自KEYNOTE-006)。BRAF野生型患者为1124例(72.1%);BRAF V600E/K突变型患者为434例(27.9%),其中271例(62.4%)曾接受BRAF抑制剂单药或联合MEK抑制剂治疗,163(37.6%)为初治患者。总人群的客观缓解率(ORR)为38.3%(596/1558),4年无进展生存(PFS)率为22%,4年总生存(OS)率为36.9%。
BRAF野生型vs BRAF V600E/ K突变型黑色素瘤:突变亚组的大多数患者[271/434例(62.4%)]既往接受过BRAF抑制剂单药或联合MEK抑制剂治疗;此外,在BRAF野生型亚组包含更多老年患者(≥65岁)和既往接受过伊匹木单抗治疗的患者。分析结果显示,BRAF野生型和突变型黑色素瘤患者的ORR为39.8%vs 34.3%,4年PFS率分别为22.9% vs 19.8%,中位PFS为7.9个月vs5.6个月(图1A),4年OS率相似,分别为37.5% vs 35.1%,中位OS为23个月 vs 21.8个月。而BRAF野生型与突变型且既往未接受过BRAF抑制剂单药或联合MEK抑制剂治疗亚组分析结果显示,BRAF野生型和突变型黑色素瘤患者的ORR相似,为39.8% vs 44.2%。
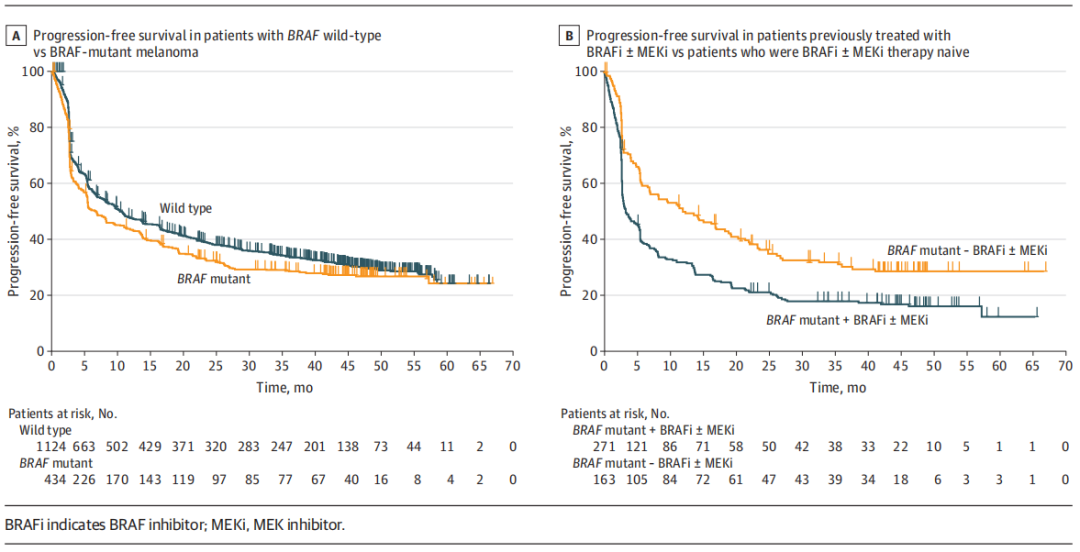
BRAF突变亚组人群中,既往接受或未接受BRAF抑制剂单药或联合MEK抑制剂治疗患者的ORR分别为28.4% vs 44.2%,4年PFS率为15.2%vs 27.8%(图1B),中位PFS为3.4 个月vs 12.0个月,4年OS率为26.9% vs 49.3%,中位OS为13.8个月 vs 45.4个月。
讨 论
来自三项临床试验数据进行亚组汇总分析的结果表明,对于BRAF野生型和BRAF V600E/K突变型晚期黑色素瘤患者以及既往接受或未接受BRAF抑制剂单药或联合MEK抑制剂治疗的患者,帕博利珠单抗均可带来临床获益。在四个亚组中,使用帕博利珠单抗治疗的安全性没有显著差异。由于三项临床试验纳入患者标准不同,对于亚组合并分析有一定差异,在BRAF突变亚组人群中,经治患者与初治患者对比,ORR、4年OS率和PFS均较低。目前,帕博利珠单抗联合达拉非尼和曲美替尼的三药联合方案治疗初治黑色素瘤患者的Ⅱ期临床试验KEYNOTE-022结果显示,三药联合方案与达拉非尼联合曲美替尼的双药联合方案对比有更长PFS和缓解持续时间。Ⅲ期临床试验COMBI-i初步结果显示,纳武利尤单抗联合达拉非尼和曲美替尼的三药联合方案在BRAF突变型黑色素瘤患者中具有初步疗效,安全性可管理。免疫检查点抑制剂和靶向治疗使用先后或联用还需要进一步的验证确定。
结 论
总体而言,该亚组分析结果支持使用帕博利珠单抗治疗晚期黑色素瘤,无论BRAF V600E/K的突变状态或既往是否接受过BRAF抑制剂单药或联合MEK抑制剂治疗。
参考文献
Puzanov I, Ribas A, Robert C, et al. Association of BRAF V600E/K Mutation Status and Prior BRAF/MEK Inhibition With Pembrolizumab Outcomes in Advanced Melanoma: Pooled Analysis of 3 Clinical Trials. JAMA Oncol 2020 Jul 16.