乳腺癌、前列腺癌、淋巴瘤……多癌种喜迎新药,速来围观!
近日,国内外肿瘤治疗迎来了8项新药或新适应证,一起来跟进肿瘤药物这些新资讯。
国内上市新药或新适应证
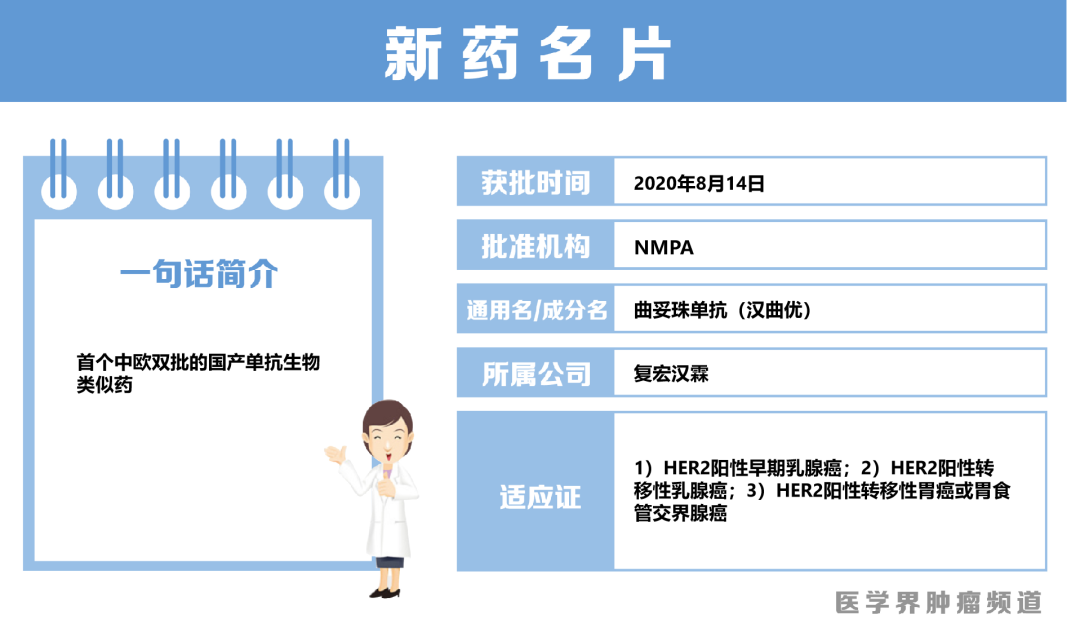
8月14日,国内首个自主开发的曲妥珠单抗获得国家药品监督管理局(NMPA)批准用于HER2阳性早期乳腺癌、转移性乳腺癌和转移性胃癌。
8月27日,氯化镭[223Ra]注射液获批用于治疗伴有症状性骨转移且无已知内脏转移的去势抵抗性前列腺癌(CRPC)患者。
8月28日,普拉曲沙获批用于治疗复发性或难治性外周T细胞淋巴瘤(PTCL)。
美国获批新药或新适应证
7月24日,美国食品药品监督管理局(FDA)加速批准CAR-T细胞疗法Brexucabtagene autoleucel用于治疗复发/难治性套细胞淋巴瘤(MCL)成人患者。
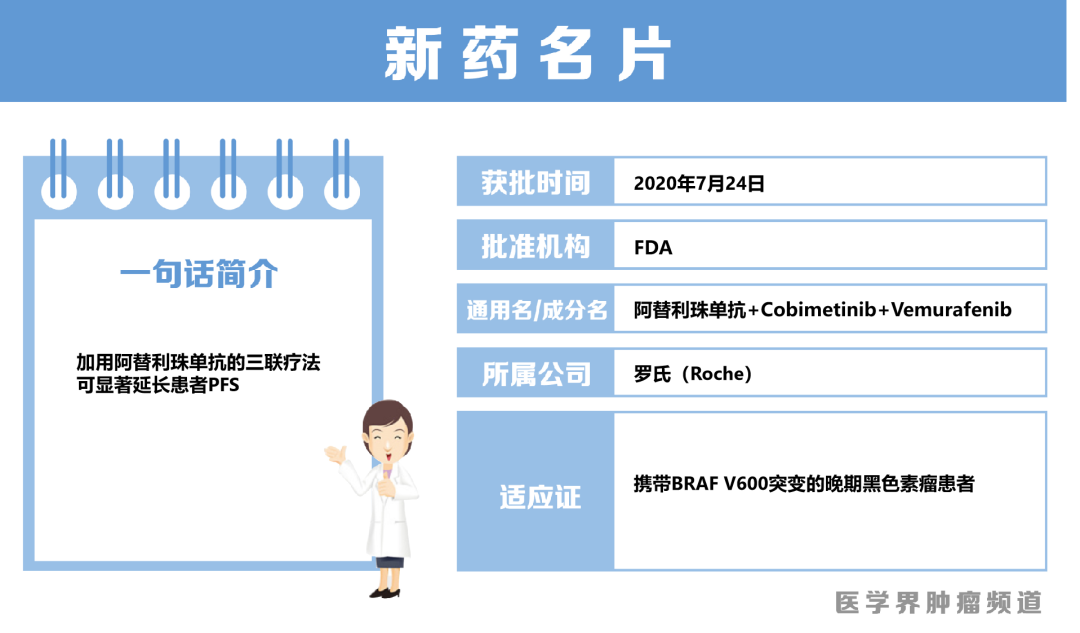
7月30日,FDA批准阿替利珠单抗与Cobimetinib和Vemurafenib联用,一线治疗携带BRAF V600突变的晚期黑色素瘤患者。
7月31日,FDA加速批准Tafasitamab-cxix与来那度胺联用,二线治疗成人复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者,包括低级别淋巴瘤引起的DLBCL,以及不适合接受自体干细胞移植(ASCT)的患者。
8月5号,FDA批准Belantamab mafodotin-blmf作为单药疗法,用于既往接受过至少4种疗法(包括抗CD38单克隆抗体、蛋白酶体抑制剂和免疫调节剂)的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
8月20日,FDA批准Carfilzomib与Daratumumab+地塞米松联合使用的两种给药方案(每周一次和每周两次),用于治疗既往接受过1-3线治疗的R/R MM患者。
国内获批新药或新适应证
1. 中国国产曲妥珠单抗上市
8月14日,根据NMPA位点的公示,复宏汉霖开发的曲妥珠单抗获得批准上市。

不久前的7月29日,该药率先在欧盟获得批准上市,用于治疗HER2阳性早期乳腺癌、HER2阳性转移性乳腺癌以及未经治疗的HER2阳性转移性胃癌或胃/食管交界处腺癌。该药在治疗复发或既往未经治疗的HER2 阳性转移性乳腺癌的疗效与原研药等效,其治疗一年的安全性、免疫原性结果与原研药相似。
2. 镭-223登陆中国!为CRPC骨转移患者带来三重获益
8月27日,氯化镭[223Ra]注射液(简称:镭-223)获得NMPA批准用于治疗伴有症状性骨转移且无已知内脏转移的CRPC患者。
镭-223是一款发射α粒子的放射活性治疗药物,镭-223是一款发射α粒子的放射活性治疗药物,关键III期ALSYMPCA研究证明与安慰剂相比,镭-223生存获益显著,具备良好的安全性,且能改善患者的生活质量,该治疗为前列腺癌患者带来三重获益。
3. 首个用于治疗PTCL的普拉曲沙中国获批上市
8月28日,萌蒂(中国)制药普拉曲沙(Pralatrexate)获批上市。该药物最初于2009年获得FDA 批准上市,是首个用于治疗PTCL的二氢叶酸还原酶抑制剂。

PROPEL研究是普拉曲沙治疗复发性或难治性PTCL患者的关键性研究。普拉曲沙治疗组的总生存(OS)比病例匹配对照组高3倍以上。对照组的中位OS为4.04个月(95% CI 2.60-6.01),而普拉曲沙组的中位OS为14.78个月(95% CI 10.61-22.31)。
美国上市新药或新适应证
4. FDA加速批准第三款CAR-T细胞疗法,治疗MCL
7月24日,美国FDA加速批准CAR-T细胞疗法Tecartus(Brexucabtagene autoleucel,原名KTE-X19),用于治疗复发/难治性MCL成人患者。这是首款获批治疗这类患者的CAR-T疗法。

Brexucabtagene autoleucel是一款靶向CD19的自体CAR-T疗法。它使用了包含T细胞筛选和淋巴细胞富集的XLP制造工艺。对于某些有循环淋巴母细胞迹象的B细胞恶性肿瘤来说,淋巴细胞富集是CAR-T疗法制造的必要步骤。目前,Brexucabtagene autoleucel正在I/II期临床试验中治疗急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)和MCL。Brexucabtagene autoleucel曾经获得FDA授予的突破性疗法认定和EMA授予的PRIME药品认定。
Brexucabtagene autoleucel的批准得到了正在进行的单组、开放标签ZUMA-2关键性临床试验数据的支持。该研究入组了74例复发/难治性MCL成人患者,这些患者既往接受过化疗、抗CD20抗体治疗和布鲁顿酪氨酸激酶抑制剂的治疗。
在这项研究中,在60名可评估疗效的患者中,87%的患者对Brexucabtagene autoleucel的单次输注产生应答,包括62%达到完全缓解(CR)的患者。在首次出现客观缓解后6个月的随访时,患者尚未达到中位缓解持续时间(DoR)。
5. 一线治疗黑色素瘤患者,阿替利珠单抗组合疗法获批扩展适应证
7月30日,FDA批准其重磅PD-L1抑制剂阿替利珠单抗与MEK抑制剂Cobimetinib和BRAF抑制剂Vemurafenib联用,一线治疗携带BRAF V600突变的晚期黑色素瘤患者。
此次批准,是基于Ⅲ期临床试验IMspire150的结果。在该研究中,与安慰剂加Cobimetinib和Vemurafenib相比,阿替利珠单抗+Cobimetinib和Vemurafenib可延长患者的PFS。阿替利珠单抗组合的PFS达到15.1个月,对照组为10.6个月(HR=0.78,p=0.025)。
6. 治疗最常见非霍奇金淋巴瘤,FDA加速批准“加强版”抗体疗法上市
7月31日,美国FDA加速批准Monjuvi(Tafasitamab-cxix)与来那度胺(Lenalidomide)联用,二线治疗成人复发/难治性DLBCL患者,包括低级别淋巴瘤引起的DLBCL,以及不适合接受ASCT的患者。

Tafasitamab-cxix是一种通过改造抗体Fc端增强细胞介导的细胞毒性反应的人源化抗CD19单克隆抗体,这一批准是根据II期L-MIND研究数据。研究结果显示,Tafasitamab-cxix与来那度胺联用,总缓解率(ORR)达55%,包括37%的CR率和18%的部分缓解(PR)率。中位DoR为21.7个月。
7. 全球首个BCMA抗体偶联药物获FDA加速批准,治疗R/R MM
8月5号,美国FDA批准Blenrep(Belantamab mafodotin-blmf)作为单药疗法,用于既往接受过至少4种疗法(包括抗CD38单克隆抗体、蛋白酶体抑制剂和免疫调节剂)的R/R MM成人患者。根据ORR,该适应证获得加速批准。这是全球首个获得批准的抗BCMA(B细胞成熟抗原)疗法。

该疗法的获批,是基于DREAMM-2研究的6个月初步结果。该研究纳入了患有R/R MM的患者,这些患者尽管接受了标准治疗,但病情仍在恶化。在研究中,接受中位既往7线治疗的患者(n=97)中,Belantamab mafodotin-blmf治疗的ORR为31%(97.5%CI 21-43);6个月分析时尚未达到中位DoR,73%的缓解者的DoR≥6个月。
8. FDA批准抗CD38抗体和Carfilzomib治疗R/R MM
8月20日,美国FDA批准安进的Carfilzomib与杨森的Daratumumab+地塞米松联合使用(DKd)的两种给药方案(每周一次和每周两次),用于治疗既往接受过1-3线治疗的R/R MM患者。新闻稿指出,这是首次由抗CD38抗体和Carfilzomib构成的组合疗法获得FDA批准治疗这一患者群体。

这一批准是基于名为EQUULEUS的Ib期临床试验和名为CANDOR的III期临床试验。CANDOR是第一个在R/R MM患者中比较DKd与Carfilzomib和地塞米松(Kd)组合治疗的随机III期临床试验。该研究达到了其主要终点,与接受Kd治疗相比,接受DKd治疗的患者的疾病进展或死亡风险降低了37%[HR=0.63;95%CI 0.464-0.854;p=0.0014(单侧)]。
参考文献
[1]https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20200814152837144.html
[2]https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20200828152220197.html
[3]https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20200828152220197.html
[4]https://mp.weixin.qq.com/s/dHcOADGVxpN2lBpNdfqyKg
[5]https://www.fda.gov/drugs/fda-approves-brexucabtagene-autoleucel-relapsed-or-refractory-mantle-cell-lymphoma
[6]https://mp.weixin.qq.com/s/NrKdgFuCzyXwLE5wPp_0QQ
[7]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-atezolizumab-braf-v600-unresectable-or-metastatic-melanoma
[7]https://www.businesswire.com/news/home/20200731005497/en/FDA-Approves-Monjuvi®-tafasitamab-cxix-Combination-Lenalidomide-Treatment
[9]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-tafasitamab-cxix-diffuse-large-b-cell-lymphoma
https://www.cancernetwork.com/view/nccn-adds-tafasitamab-cxix-in-combination-with-lenalidomide-to-b-cell-lymphoma-guidelines
[10]https://www.onclive.com/view/nccn-guidelines-grant-tafasitamab-category-2a-designation-in-dlbcl
[11]https://www.gsk.com/en-gb/media/press-releases/fda-approves-gsk-s-blenrep-belantamab-mafodotin-blmf-for-the-treatment-of-patients-with-relapsed-or-refractory-multiple-myeloma/
[12]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-granted-accelerated-approval-belantamab-mafodotin-blmf-multiple-myeloma
[13]http://www.globenewswire.com/news-release/2020/08/20/2081705/0/en/Genmab-Announces-Janssen-Granted-U-S-FDA-Approval-for-DARZALEX-daratumumab-in-Combination-with-Carfilzomib-and-Dexamethasone-in-Relapsed-or-Refractory-Multiple-Myeloma.html
[14]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-carfilzomib-and-daratumumab-dexamethasone-multiple-myeloma