免疫治疗大事记——首届肿瘤黑科技大会免疫及细胞治疗专场脑洞大开,炫酷呈现
近十年,随着肿瘤治疗领域的高速发展,越来越多的治疗药物及技术手段被研发并使用,但仍有巨大的、未被满足的临床需求亟待大力开发。基于此,由北京希思科临床肿瘤学研究基金会、良医汇主办,动脉网、华盖资本、医麦客联合主办的首届肿瘤诊疗黑科技评选活动拉开了帷幕,以期推动肿瘤精准诊疗进展。
8月30日的免疫及细胞治疗专场梳理了肿瘤免疫治疗发展大事记,探讨免疫及细胞治疗的最新进展,内容前沿而富有前瞻性。让我们一起看看谁是分子及免疫治疗的最“黑”科技!

首个皮下注射PD-L1纳米抗体Envafolima(KN035)抗肿瘤机制及疗效解析
免疫检查点是肿瘤细胞实现免疫逃逸的重要途径。但免疫治疗探索仍面临以下几大亟待克服的困境:①肿瘤间及肿瘤内部存在异质性;②合适生物标记物的发现;③免疫相关不良反应管理;④如何实现免疫治疗的便捷性、依从性,静脉输注不够便捷,患者依从性低;⑤免疫治疗全程管理;⑥超进展预测,治疗前如何鉴别易出现超进展人群,等等。
作为首个中国自主研发、全球首个进入临床开发的PD-L1纳米抗体——Envafolimab(KN035)有望解决上述困扰。
何为纳米抗体?这得从一头骆驼的故事说起。1993年首次报道在骆驼中发现一种不同于lgG的特殊抗体。该抗体是一种缺失轻链的抗体,被称为重链抗体,其重链可变区被成为纳米抗体,基因序列与人VH基因家族3序列具有高度同源性,保留了重链抗体的抗原结合性。
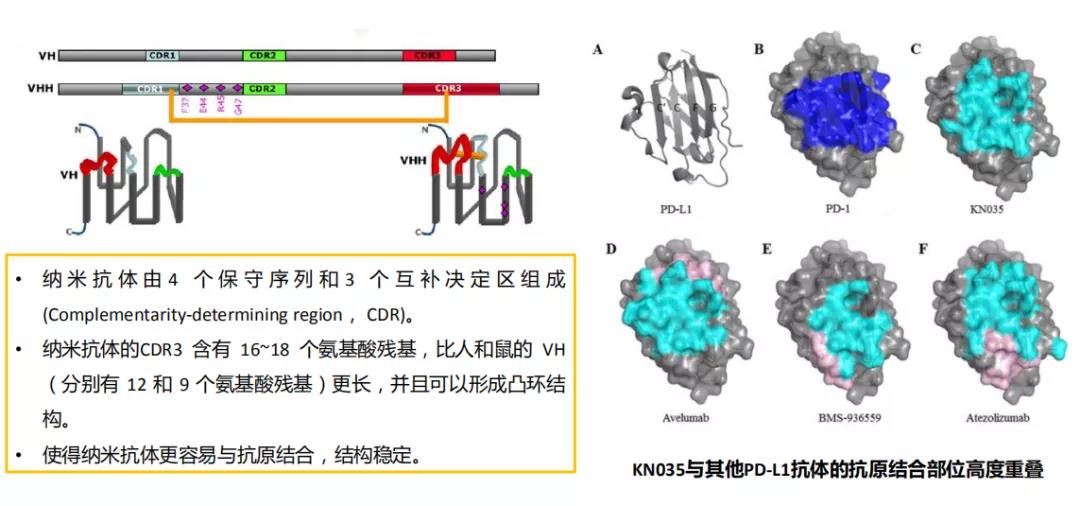
而Envafolimab正是利用这种骆驼的“重链抗体”制造出来:对骆驼进行PD-L1蛋白免疫→收集外周血淋巴细胞(含PD-L1抗体)→提取淋巴细胞RNA,构建噬菌体展示库→筛选得到PD-L1抗体序列→将抗体结合区人源化与人的LgG1 Fc段融合→得到KN035抗体。
Envafolimab纳米抗体(KN035)兼具传统抗体与小分子药物的优势:
结构创新。Envafolimab纳米抗体亲和力高、结构稳定。组织穿透力强,分子量仅为80kDa,仅为常规抗体的一半,可以快速、均匀的扩散至全身,适用于多种给药途径;
广谱高效。Envafolimab纳米抗体抗肿瘤活性强。临床前研究显示,Envafolimab蛋白浓度高,可以有效诱导T细胞的细胞因子分泌。为进一步明确其临床疗效,国内外多项临床研究正在开展;
稳定便捷。Envafolimab纳米抗体高水溶性/高耐性,在极端条件下可保持活性。其皮下注射的给药方式将改变患者的依从性及生活质量;
安全可靠。研究显示,Envafolimab纳米抗体安全性好。
至于其最终临床疗效如何,是否如先声药业曹原先生所说?实践是检验真理的唯一标准,让我们共同拭目以待。
后疫时代——Tebotelimab(LAG-3/PD-L1双抗)
LAG-3是什么?LAG-3在多种实体瘤中均有表达,是一种1型跨膜蛋白,在人体内激活后的T细胞和NK细胞上表达。LAG-3在被抗原激活的T细胞或衰竭的T细胞(如肿瘤侵润T细胞)里高表达 ,对PD-1抗体耐药的肿瘤侵润T细胞表达LAG-3显著地高于不耐药的肿瘤侵润T细胞。
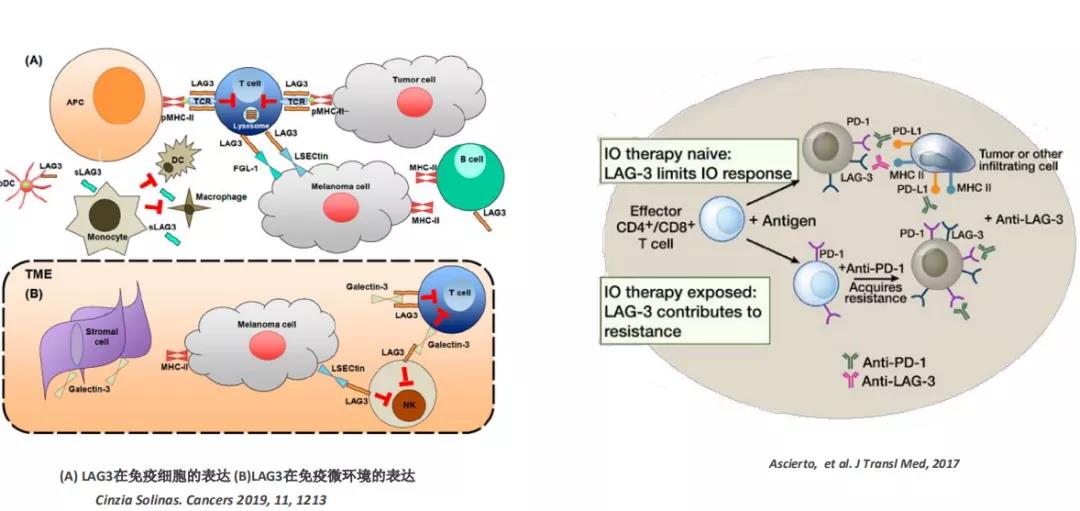
Tebotelimab正是再鼎医药推出的LAG-3/PD-1双特异性抗体。Tebotelimab具有稳定铰链、含有Fc段的LgG4的双特异性四价DART蛋白,可阻断表达PD-1和LAG-3两个免疫检查点分子的T细胞(CD4+和CD8+)与其配体(PD-L1/2和MHCII)的结合,从而逆转T细胞“抑制性”状态,恢复“耗竭”T细胞功能,增强肿瘤的免疫能力。
在临床前研究及基础研究中,Tebotelimab单药在不同瘤种中显示出抗肿瘤活性。I期数据显示,Tebotelimab耐受性良好,不良反应谱与PD-1单药相似。初步数据显示,PD-L1低表达的复发/难治性HER2+实体瘤患者ORR大于40%且临床前模型提示,无论BRCA突变状态或PD-L1表达,PARPi与抗PD-1药物具有协同作用。
再鼎医药黑永疆先生表示,“目前,再鼎医药正在开展多项Tebotelimab单药或联合用药在不用瘤种中的临床研究。”如HER2+转移性胃癌或胃食管腺癌(1L)、转移向胃癌或胃食管腺癌(2/3L)、肝癌(2L)、实体瘤、黑色素瘤等,让我们共同期待后续数据。
免疫治疗的困惑及未来思考
中山大学附属肿瘤医院蔡修宇教授代表临床医生发言,细数免疫治疗中的困惑及思考。
困惑一:使用激素人群是否可以使用免疫治疗?使用激素处理irAE对免疫治疗疗效无影响。
困惑二:PDL-1及PD-1疗效是否一样,不同公司的PD1疗效不一样?
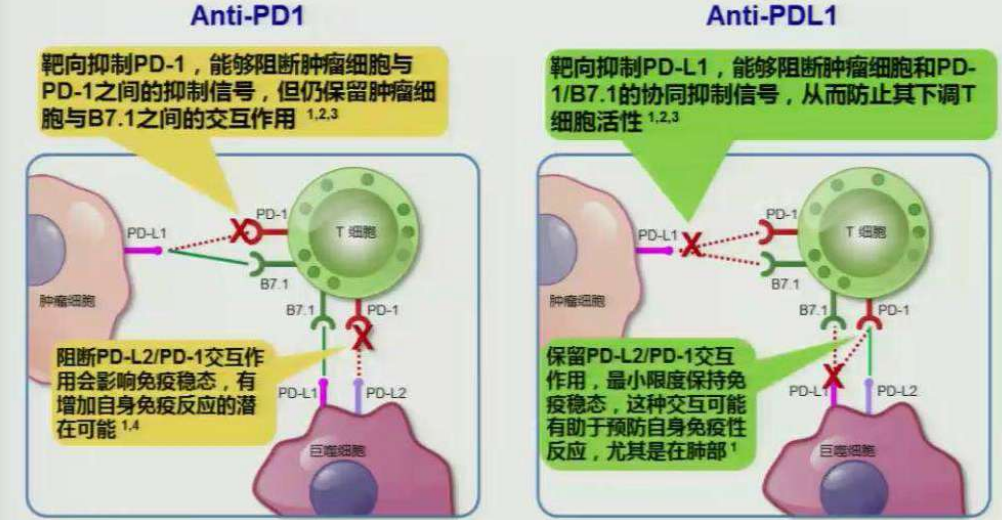
困惑三:自身免疫性疾病人群?使用PD-1/PD-L1抑制剂后基础自身疾病加重比例较低,但仍需密切关注有基础免疫疾病患者的免疫治疗风险。
困惑四:使用抗生素人群?
困惑五:病毒携带人群?
困惑六:驱动基因突变人群?
困惑七:如何看待免疫治疗患者出现超进展?高龄患者更容易出现超进展。因此,免疫抑制剂不是雪中送炭,而是锦上添花。
困惑八:假进展?充分利用低成本影像组学鉴别病人是否为假进展。
困惑九:孕妇及器官移植人群是否适合免疫治疗?
困惑十:特殊不良反应人群?
困惑十一:不同人群存在免疫治疗irAE差异?研究显示,比起肺癌患者,黑色素瘤患者有更高的消化道和皮肤毒性、更低的肺炎的发生;比起肾癌患者,黑色素瘤患者有更高的关节炎和肌痛的发生。
困惑十二:出现irAE患者是否继续使用免疫治疗?研究显示,免疫治疗停药再使用irAE再发、新发较高,对于重新使用免疫检查点抑制剂,应权衡利弊。
终极困惑:如何找到免疫检查点抑制剂的适用人群?充分研究免疫微环境对疗效的影响,确定有效的marker。
自分泌PD-1抗体CAR-T治疗实体肿瘤
不同于上述讲者立足免疫检查点抑制剂,上海细胞治疗集团刘祥箴女士从细胞免疫角度出发,阐述CAR-T细胞在实体肿瘤治疗中的应用。
自2013年免疫细胞治疗被Science杂志被评为年度十大科技突破之首开始,肿瘤免疫治疗开始进入大众视野。肿瘤免疫治疗经历了两大关键事件:其一、肿瘤免疫检查点抑制剂(CPB),以PD-1抑制性抗体药物为代表。其二,CAR-T细胞药物的上市,以CD19 CAR-T细胞药物为代表药物。
目前CAR-T细胞在血液肿瘤领域临床疗效显著,在实体瘤治疗上仍需探索。目前已有CAR-T治疗实体瘤的成功案例——2016年N Engl J Med报道的脑胶质瘤经CAR-T治疗取得显著疗效。但CAR-T治疗治疗实体肿瘤仍面临巨大挑战,包括肿瘤微环境的物理屏障、低氧、低PH、异质性等。因此CAR-T肿瘤治疗仍需进行策略上的探索(如图)。
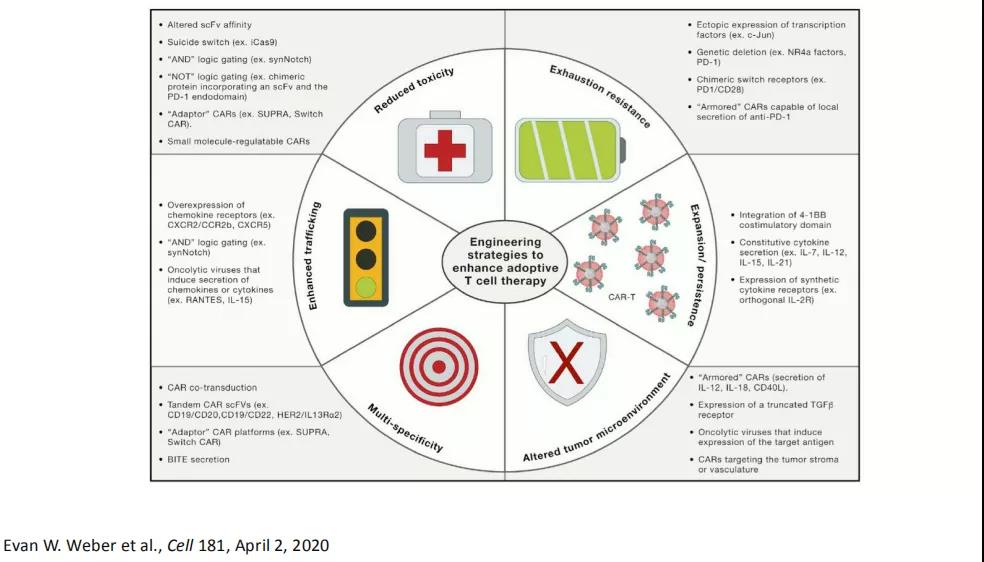
“CAR-T+免疫检查点阻断”是目前多家研究单位实体瘤及血液肿瘤的免疫治疗探索方向。根据上海细胞治疗集团在实体瘤中此联合方案的早期探索性数据,此联合方案呈现出疗效与安全性的双重利好势头。
是骡子是马,还需拉出来溜溜。具体临床反响如何,我们拭目以待。
治疗实体肿瘤的抗原特异性TCR-T细胞药物
何为下一代肿瘤治疗方向?有研究显示,免疫检查点抑制剂在晚期非小细胞肺癌中的客观应答率仅约20%。究其原因,与晚期肿瘤患者体内缺乏肿瘤抗原特异性T细胞有关。因此,T细胞治疗为其根本解决方案。目前T细胞治疗方案有:CAR-T细胞治疗、TCR-T治疗、TIL治疗等。
CAR-T细胞治疗在血液肿瘤取得成功,但在实体肿瘤中应用却存在局限性,细胞药物在实体肿瘤中存在挑战,天科雅生物医药雷佑甯先生带来天科雅的解决方案:
肿瘤抗原的缺乏——新靶点的利用,TCR-T细胞可以识别胞内和胞外抗原;TRUST技术,高效率的TCR筛选。
脱靶风险——靶点的选择,选择外源性蛋白和肿瘤新生抗原作为首要靶点;安全性,筛选胸腺成熟后的自身TCR。
耐药性——T细胞耗竭与肿瘤异质性:CHECK-T,新一代加载免疫检查点抑制剂分子的T细胞药物有望明显改善实体瘤治疗效果;TURBO-T,创新T细胞药物加载肿瘤微环境改造因子,激发广谱抗肿瘤免疫以对抗异质性。
想到,做到。是脑洞大开,也是创新发展。免疫及细胞治疗专场的精彩报告充分体现了肿瘤黑科技诊疗大会的主题——探索黑科技,世界不止眼前。在短暂而充实的口头报告中,我们不虚此行。会议最后,各位口头报告的专家联合大会主席、讨论嘉宾组成专家团进行圆桌讨论。
将来已来,未来已至!让我们共同期待肿瘤领域免疫治疗的发展,切实推动精准诊疗的进展。
9月1日物理治疗专场敬请期待
