《新英格兰医学杂志》发布Selpercatinib(Retevmo™)在RET驱动的晚期肺癌和甲状腺癌中的Ⅰ/Ⅱ期临床研究数据
礼来制药(NYSE:LLY)27日宣布,《新英格兰医学杂志》(NEJM)发布了Selpercatinib(LOXO-292Retevmo™)注册临床试验的Ⅰ/Ⅱ期研究结果,这是第一个也是目前唯一一种专门用于治疗转移性RET融合阳性非小细胞肺癌(NSCLC)成人患者,以及需要全身性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上的儿童患者,或者需要全身性治疗且放射性碘难治(如果适合接受放射性碘治疗)的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上的儿童患者。
Selpercatinib的上述适应证是基于LIBRETTO-001的Ⅰ/Ⅱ期临床研究的客观缓解率(ORR)和缓解持续时间(DoR)而获得FDA加速审批。NEJM分别就RET融合阳性NSCLC和RET改变的甲状腺患者队列分别发表了文章,主要侧重于各队列的疗效和安全性,这些数据显示了这两组患者人群持久的客观缓解。
礼来制药肿瘤业务总裁Anne White表示:
在今年FDA批准首次将RET抑制剂带给患者后,我们很高兴继续对RET驱动型癌症患者的最大型临床试验进行进一步详细的安全性和有效性分析。观察到的有意义的结果增强了该精准治疗药物在RET驱动的NSCLC和甲状腺癌中的治疗价值,并突显了礼来致力于帮助癌症患者享有更健康生活的承诺。
2020年5月,美国食品药品监督管理局(FDA)基于LIBRETTO-001的研究结果对Selpercatinib批准上市。该研究招募了初治和既往多次治疗的各种晚期实体瘤患者,包括RET融合阳性非小细胞肺癌(NSCLC),RET突变型甲状腺髓样癌(MTC),RET融合阳性甲状腺癌以及其他RET改变的晚期实体瘤。LIBRETTO-001的主要疗效指标是ORR和DoR。
RET融合阳性NSCLC
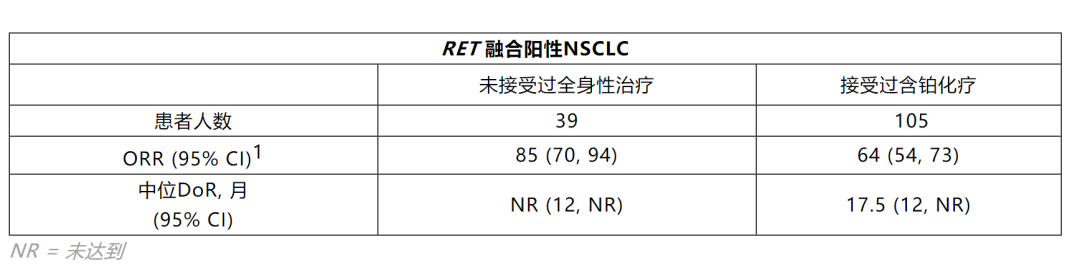
该文章着重介绍了入组的前105名RET融合阳性的转移性NSCLC患者,这些患者包括至少接受过一次含铂化疗以及39名未接受过全身性治疗的患者。所有分析基于意向治疗(ITT)人群。
美国纪念斯隆·凯特琳癌症中心早期药物研发负责人,LIBRETTO-001主要研究者Alexander Drilon博士表示:
携带有RET融合驱动的NSCLC患者具有巨大的未被满足的临床需求,需要个体化的疗法来进行治疗”,在这项研究中观察到的具有临床意义的结果表明,Selpercatinib可以帮助满足这一需求,为这些患者提供宝贵的治疗选择。
高达50%的RET融合阳性NSCLC患者会发生脑转移,在既往治疗过的具有可测量脑转移病灶的11名NSCLC患者中,有10名观察到了颅内有效性(CNS ORR),所有患者的CNS DoR均大于或等于6个月。
美国德克萨斯大学安德森癌症中心肿瘤学副教授和靶向治疗临床中心医学主任,LIBRETTO-001的共同研究者Vivek Subbiah博士表示:
鉴于RET融合阳性NSCLC的患者面临发生脑转移的高风险,因此颅内有效性是治疗中的重要考量因素。Selpercatinib在11名患者中有10名表现出持久的颅内有效性的事实表明,对于脑转移患者是一种有意义的治疗选择。
RET-改变型甲状腺癌
·
该文章重点介绍了在RET改变的三个甲状腺癌队列中,接受治疗的162名患者的有效性分析(前55名入组的曾接受凡德他尼和/或卡博替尼治疗的RET突变型MTC患者,88例未曾接受凡德他尼和/或卡博替尼治疗的RET突变型MTC患者,以及19例曾接受过全身性治疗的RET融合阳性的甲状腺癌患者)。所有分析基于ITT人群。
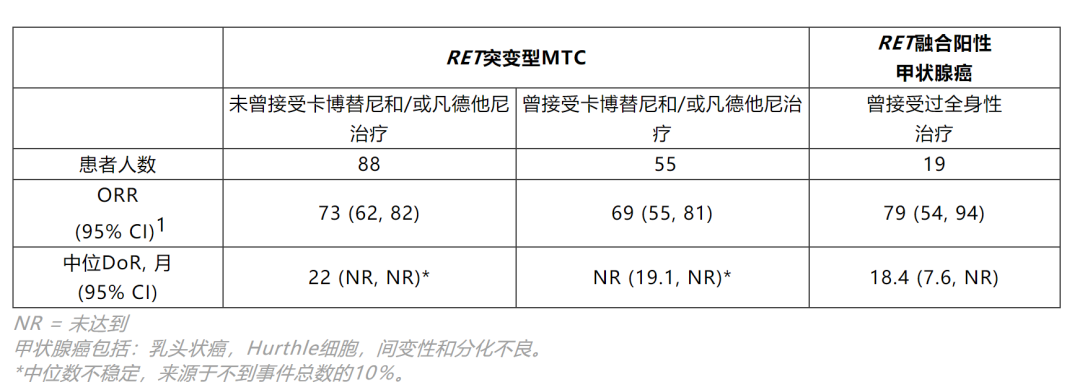
癌胚抗原(CEA)和降钙素的变化是预先确定的探索性终点,并且不受误差控制。生化缓解率(BRR)基于降钙素和CEA变化的最佳百分比。在既往接受过治疗的RET突变型MTC患者中,Selpercatinib治疗取得了很好的生化反应率(BRR)——血清肿瘤学标志物降钙素BRR为91%、癌胚抗原BRR为64%。
美国麻省总院癌症中心头颈肿瘤科主任Lori J. Wirth博士表示:
根据已公布的数据,Selpercatinib在一线和复发的RET突变型MTC均显示出优异且持久的有效性,为在这两种情况下中均可以作为一种新的标准治疗提供了有力的证据。
安全性数据
在144例接受Selpercatinib治疗的RET融合阳性NSCLC患者中,最常见的≥3级不良事件为高血压(14%),丙氨酸氨基转移酶升高(13%),天冬氨酸氨基转移酶升高(10%),低钠血症(6%)和淋巴细胞减少症(6%)。4名患者(3%)由于药物相关不良事件终止Selpercatinib治疗。
在162例接受Selpercatinib治疗的RET突变型MTC和RET融合阳性的甲状腺癌患者中,最常见的≥3级不良事件为高血压(21%),丙氨酸氨基转移酶升高(11%),天冬氨酸氨基转移酶升高(9%),低钠血症(8%)和腹泻(6%)。4名患者(3%)由于药物相关不良事件终止Selpercatinib治疗。
RET融合阳性NSCLC和RET驱动的甲状腺癌患者安全性分析中,Selpercatinib的不良事件谱均与LIBRETTO-001中531例接受Selpercatinib治疗的患者的总体安全性特征大致相似。在所有531例接受Selpercatinib治疗的患者中,有160例(30%)由于治疗相关的不良反应而需要降低剂量,有12例(2%)患者由于治疗相关的不良反应而终止Selpercatinib治疗,其中最常见的是丙氨酸氨基转移酶升高(2名患者)和过敏反应(2名患者)。
目前有两项随机的Ⅲ期临床试验(LIBRETTO-431和LIBRETTO-531)正在招募患者。
参考文献
1. 由孤立审核委员会根据实体肿瘤反应评估标准确定(RECIST v1.1)