多发性骨髓瘤获批新方案;慢性粒细胞白血病或迎新型STAMP抑制剂
要点一览
1. Lancet Oncology:与VRd方案相比,KRd方案没有改善PFS
2. BCJ:部分多发性骨髓瘤自体干细胞移植患者可长期缓解
3. 新药:诺华白血病口服疗法Ⅲ期临床达主要终点
4. 新药:FDA批准卡非佐米+daratumumab+地塞米松治疗多发性骨髓瘤
5.会议:第三届天津国际淋巴瘤高峰论坛会议在天津顺利召开
>>>> 1. Lancet Oncology:与VRd方案相比,KRd方案没有改善PFS
8月28日,Lancet Oncology发布了ENDURANCE Ⅲ期研究结果,研究表明,与VRd方案(硼替佐米+来那度胺+地塞米松)相比,KRd(卡非佐米+来那度胺+地塞米松)方案没有改善无进展生存期(PFS),并且毒性更大。

对于新诊断的多发性骨髓瘤患者,VRd方案是标准治疗方案,既往Ⅱ期研究结果显示KRd方案的疗效优于VRd方案,为了进一步验证其疗效,研究者进行了Ⅲ期研究。
研究纳入≥18岁的新诊断为多发性骨髓瘤的患者,且这些患者不适合或不打算立即进行自体造血干细胞移植(ASCT)。患者随机接受VRd方案或KRd方案诱导治疗36周。然后将完成诱导治疗的患者随机分配接受来那度胺无限期维持治疗或2年维持治疗。主要研究终点是诱导治疗时的PFS和维持治疗时的总生存期(OS)。
在2013年12月6日-2019年2月6日之间,共有1087例患者入选并随机分配至VRd方案(n=542)或KRd方案(n=545)组中。中位随访时间9个月(IQR 5-23),KRd组的中位PFS为34.6个月(95%CI 28.8-37.8),VRd组为34.4个月(95%CI 30.1-NE)(HR 1.04,95%CI 0.83-1.31;p=0.74)。两组均未达到中位OS。
安全性方面,VRd组和KRd组最常见的3-4级治疗相关非血液学不良事件是疲劳(6% vs 6%)、高血糖(4% vs 6%)、腹泻(5% vs 3%)、周围神经病变(8% vs <1%)、呼吸困难(2% vs 7%)、血栓栓塞(2% vs 5%)。VRd组中有2例患者(<1%)发生了与治疗有关的死亡(1例心脏毒性和1例继发性癌症);KRd组有11例(2%)患者发生与治疗相关的死亡。
研究者表示,在新诊断的多发性骨髓瘤患者中,与VRd方案相比,KRd方案没有改善PFS,并且毒性更大。VRd三联疗法仍是新诊断多发性骨髓瘤患者的标准诱导治疗方案,也是开发四种药物组合方案的基础。
>>>> 2. BCJ:部分多发性骨髓瘤自体干细胞移植患者可长期缓解
ASCT是多发性骨髓瘤的一种重要治疗方式。然而,大多数患者进行ASCT后会复发。8月28日,Blood Cancer Journal刊登了一项研究,探讨了那些对ASCT应答较好的多发性骨髓瘤患者的生存情况。

研究者将对ASCT应答较好的患者定义为在没有维持疗法的情况下>8年的PFS。回顾性分析了1998年8月1日-2006年1月3日期间在梅奥诊所接受治疗的多发性骨髓瘤患者,在研究期间接受ASCT的509例患者中,有46例(9%)是应答较好者。这些患者诊断时的中位年龄为57(50-63),大多数患者患有低危疾病,有40位患者在病程中可获得细胞遗传学数据。
中位随访16.2年(14.3-17.7),有34例(74%)患者达到完全缓解(CR)或更好,这些患者的中位PFS可达13.8年(95%CI10.5-18.5)年。上一次血液学评估结果显示,46例患者中仍有24例(52%)仍处于缓解状态。
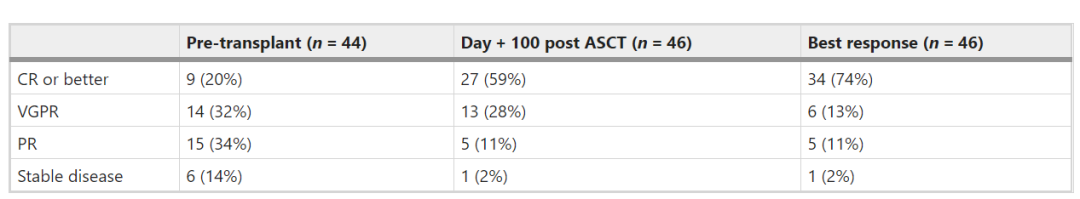
总之,该研究表明一小部分多发性骨髓瘤患者在ASCT后无需维持治疗即可获得持久的疾病控制。研究者表示对这些患者进行鉴定可能有助于防止过度治疗并降低后续治疗费用。
>>>> 3. 新药:Ⅲ期临床研究ASCEMBL达主要终点
8月26日,诺华公司宣布Ⅲ期临床研究ASCEMBL初步分析达到了主要终点,STAMP抑制剂asciminib(ABL001)与bosutinib(博舒替尼)相比,在24周治疗慢性期费城染色体阳性慢性粒细胞白血病(Ph+CML-CP)患者的主要分子反应(MMR)率方面具有统计学显著优势。

ASCEMBL是一项多中心、开放标签、随机Ⅲ期临床研究,旨在比较口服疗法asciminib与博舒替尼对慢性期Ph+CML-CP成年患者的治疗效果。研究招募了234例曾接受两种或多种酪氨酸激酶抑制剂(TKIs)治疗的患者,其中包括了对最近使用TKI治疗失败或不耐受的群体。将患者随机分为每日口服一次asciminib或博舒替尼。在24周时,研究人员评估患者血液中BCR-ABL基因数量的下降程度以定义MMR。
据悉,诺华计划将本次试验数据提交给即将召开的医学会议以及药物监管机构,美国食品和药物管理局(FDA)已经授予asciminib快速通道资格认定。今年6月,诺华首席执行官Vas Narasimhan曾表示,预计在2021年第一季度提交药物审批申请。
>>>> 4. 新药:FDA批准卡非佐米+daratumumab+地塞米松治疗多发性骨髓瘤
近日,FDA批准卡非佐米、daratumumab与地塞米松联合(DKd方案)用于已接受1-3线治疗的复发或难治性多发性骨髓瘤(R/R MM)成年患者。该批准基于CANDOR研究和EQUULEUS研究中DKd方案的疗效数据。
CANDOR研究评估了DKd方案对比Kd方案(卡非佐米+地塞米松)用于已接受1-3线治疗的R/R MM患者的疗效。研究显示,DKd组中位PFS未达到,Kd组中位PFS为15.8个月(95%CI:12.1-NE)(HR=0.63;95%CI:0.46-0.85;P=0.0014)。
EQUULEUS研究评估了DKd方案的总体缓解率(ORR)。在DKd组中,既往接受过1-3线治疗的85例R/R MM患者的ORR为81%(95%CI:71-89),中位缓解持续时间为27.5个月(20.5-无法估算)。
>>>> 5. 会议:第三届天津国际淋巴瘤高峰论坛会议在天津顺利召开
由中国抗癌协会淋巴瘤专业委员会、CSCO抗淋巴瘤联盟、天津市抗癌协会淋巴瘤专业委员会、天津市医疗健康学会共同主办。天津医科大学肿瘤医院、《中国肿瘤临床》与Cancer Biology & Medicine杂志社承办的“第三届天津国际淋巴瘤高峰论坛”于2020年8月29日-30日采取线上为主、线下为辅的形式召开。

本次会议邀请了国内外多位知名血液领域专家,共设置12个专场,涵盖B细胞淋巴瘤、T细胞淋巴瘤、霍奇金淋巴瘤、移植及免疫治疗、病理专题、基础及转化医学专题。并设置青年专场、护理专场、Post-Lugano &EHA欧洲连线专场。从基础转化到临床实践,从一线诊疗到疾病护理,从学术大咖到青年才俊,内容全面、精彩纷呈!
参考文献
[1] Prof Shaji K Kumar, Susanna J Jacobus, Carfilzomib or bortezomib incombination with lenalidomide and dexamethasone for patients with newlydiagnosed multiple myeloma without intention for immediate autologous stem-celltransplantation(ENDURANCE): a multicentre, open-label, phase 3, randomised,controlled trial.THE Lancet Oncology.Published:August 28,2020DOI:https://doi.org/10.1016/S1470-2045(20)30452-6
[2] Paquin, A., Visram, A., Kumar, S.K. et al.Characteristics of exceptional responders to autologous stem celltransplantation in multiple myeloma. Blood Cancer J. 10, 87(2020).https://doi.org/10.1038/s41408-020-00353-8
[3] https://mp.weixin.qq.com/s/xfEeSVxKYiivK7nuy1emMA
[4] https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-carfilzomib-and-daratumumab-dexamethasone-multiple-myelom
[5] http://news.medlive.cn/cancer/info-progress/show-171944_53.html
本文首发:医学界血液频道
本文作者:Sunny