宏愿,中国愿——首个“中国籍”曲妥珠单抗上市会成功举办
2020年8月14日,国内首个自主开发的曲妥珠单抗——汉曲优获得国家药品监督管理局(NMPA)批准用于HER2阳性早期乳腺癌、转移性乳腺癌和转移性胃癌。不久前的7月29日,该产品获得欧盟委员会批准,成为欧盟首个国产的单抗生物类似药。至此,汉曲优成为首个中欧双批的单抗生物类似药。时值半个月,国内顶尖乳腺癌专家共聚一堂,共启我国乳腺癌治疗新征程。
2020年8月29日,复宏汉霖乳腺癌高峰论坛,汉曲优全国上市会暨《不让一个HER2阳性患者落下》项目启动会在全国拉开帷幕。与以往会议不同的是,来自上海、广州和天津三个主会场、全国各省40个线下分会场2000多名专家以及线上近5000名乳腺癌医师在同一时刻,展开了一场“隔空交流”,共话乳腺癌抗HER2治疗的发展与前景,拉开了国产生物类似药治疗乳腺癌患者的崭新篇章;同时也共同探讨了如何助力“健康中国2030”,为实现“不让一个HER2阳性患者落下”的宏愿携手共进。作为迄今为止规模最为宏大的线上线下联动上市会,本次论坛的成功举办,为国内乳腺癌诊疗搭建了全面的学术交流平台,意义非凡。众多医学同道共同见证“宏愿”启航。

中国医学科学院肿瘤医院国家新药(抗肿瘤)临床研究中心主任、汉曲优国际多中心III期临床研究主要研究者徐兵河教授发表致辞:“今天,很高兴在这里见证我国自主开发的首个曲妥珠单抗类似药汉曲优的中欧上市。在汉曲优的开发过程中,我有幸担任汉曲优国际多中心III期临床试验的主要研究者,证实了汉曲优无论在临床前还是临床研究中均与原研药高度相似,两者在疗效与安全性上无临床意义上的差异。汉曲优的上市,将大幅度扩大HER2阳性乳腺癌患者的用药人群,降低患者的用药负担,并促进国家医保费用得到更有效的调控,这是我国生物医药产业的巨大进步。”
复旦大学附属肿瘤医院乳腺外科主任邵志敏教授发表致辞:“抗HER2治疗是我国乳腺癌治疗的一大难点,而曲妥珠单抗作为HER2阳性乳腺癌治疗的金标准用药,在治疗HER2 阳性的乳腺癌中发挥着关键作用。基于我国国情,开发优质的曲妥珠单抗生物类似药是非常必要的。而高品质曲妥珠类似药汉曲优的开发,早于临床阶段已经开始推动我国曲妥珠单抗的普及,为抗HER2治疗做出贡献。相信随着汉曲优的中欧获批上市,将更好解决HER2阳性乳腺癌患者的用药问题,为所有HER2阳性乳腺癌患者带来福音。”


“宏愿”启动-不让一个HER2阳性患者落下
鉴于中国基层医疗单位HER2检出率低、经济因素、诊疗不规范等多种因素,国内仍有相当一部分HER2阳性乳腺癌患者未能得到曲妥珠单抗的标准治疗。复宏汉霖立下中国愿(“宏愿”),希望通过启动《不让一个HER2阳性患者落下》项目,打造HER2诊疗生态圈,改善HER2阳性乳腺癌患者未被满足的医疗需求。

该项目计划从检测诊断、患者支付、大数据、患者教育、医生教育和药品准入六个模块,携手相关医疗单位搭建HER2阳性患者诊疗“健康生态圈”平台,通过积极配合国家及各地医疗保障局工作,联合行业协会及商业合作伙伴,协助推动中国生物类似药政策法规及医保支付标准的完善,并不断加快汉曲优的市场准入进度,提升药品覆盖范围;联合医生教育平台,加强对生物类似药政策法规的解读,推动基层医院和广阔市场乳腺癌诊疗规范化,提高汉曲优的品牌认知和认可;通过与检测诊断企业及病理中心合作,提高HER2检测率和阳性准确率;联合保险公司及基金会,改善患者支付能力,防止因病致贫和返贫;与学会及患教组织合作,减少医患沟通成本,提高患者治疗依从性;与大数据公司合作,加强汉曲优上市后临床研究,持续完善中国患者证据。通过以上六大板块全方位的布局,完善HER2阳性患者医疗生态圈。
论坛期间,嘉宾们对该项目的开展和期待进行了分享,秉着造福患者的情怀,希望通过规范化的早期筛查和治疗、完善的医患教育和随访管理,医保政策的覆盖,以及临床指导大数据的收集,来提升我国HER2阳性乳腺癌的诊疗水平,甚至在未来的中国生存预后能超越美国。复宏汉霖总裁张文杰先生表示:“为实现‘不让一个HER2阳性患者落下’的宏伟愿景,期待同各方合作伙伴共同努力,切实帮助病患解决诊治难题,加强中国HER2阳性乳腺癌患者的规范化诊疗,完善我国HER2阳性乳腺癌治疗体系建设。”
“曲”从东方来:汉曲优疗效得到国际的认可
乳腺癌是我国女性最为高发的恶性肿瘤,2018年中国乳腺癌新发病例数约37万例[1]。其中HER2阳性乳腺癌患者约占20%[2]。曲妥珠单抗是全球第一款靶向HER2蛋白的人源化单克隆抗体药物,最早于1998年9月被美国食品药品监督管理局(FDA)批准上市,单药用于已经过一种或多种化疗的HER2高表达转移性乳腺癌,或与紫杉醇联用治疗未经过化疗的HER2高表达转移性乳腺癌。如今,曲妥珠单抗的适应证已经扩展到HER2高表达的乳腺癌辅助治疗、HER2高表达转移性乳腺癌的全线治疗,以及未经治疗的HER2高表达转移性胃癌或胃/食管交界处腺癌。
大量研究证实曲妥珠单抗可有效提高HER2阳性乳腺癌患者的总体生存率,并被国内外权威指南积极推荐用于一线治疗。复宏汉霖自2012年12月就汉曲优乳腺癌适应证递交临床研究申请,2015年7月获得批准,随后在中国、乌克兰、波兰和菲律宾开展国际多中心III期临床试验。2019年4月,汉曲优获得NMPA新药上市申请受理,之后被纳入了优先审评程序,并于2019年6月获欧洲药品管理局(EMA)上市申请受理。2020年7月,欧盟委员会(European Commission,EC)批准复宏汉霖自主开发和生产的曲妥珠单抗(汉曲优,欧盟商品名:Zercepac)上市,至此,汉曲优成为进入欧洲市场的第一个“中国籍”单抗生物类似药,参与生物药的“世界杯”比赛。2020年8月,汉曲优获得NMPA批准上市,该药在欧盟和中国均获得了原研药的所有适应证:1)HER2阳性早期乳腺癌;2)HER2阳性转移性乳腺癌;3)HER2阳性转移性胃癌。
作为第一个国际化的“中国籍”单抗生物类似药,汉曲优与参照药进行了严格的头对头的比对研究,包括分析科学、非临床和临床比对研究。
分析科学研究显示,汉曲优与原研曲妥珠单抗具有相似的生物活性,免疫原性等各项分析科学特性[3]。
临床前研究显示,汉曲优与原研曲妥珠单抗具有相似的临床前药代动力学(PK)、药效学(PD)和毒理学(TK/TD)性质[4]。
汉曲优在2018年中国临床肿瘤学会(CSCO)年会及2018年欧洲肿瘤内科学会亚洲大会(ESCO-ASIA)年会上发布了I期临床研究结果(NCT02581748),证实了汉曲优与不同来源的原研曲妥珠单抗(中国市售和欧洲市售)达到药代动力学生物等效,安全性相似。
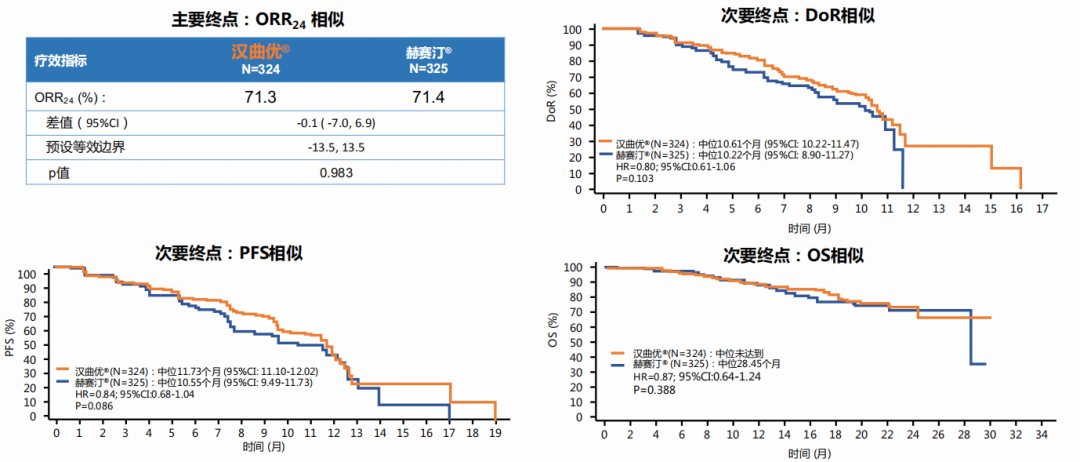
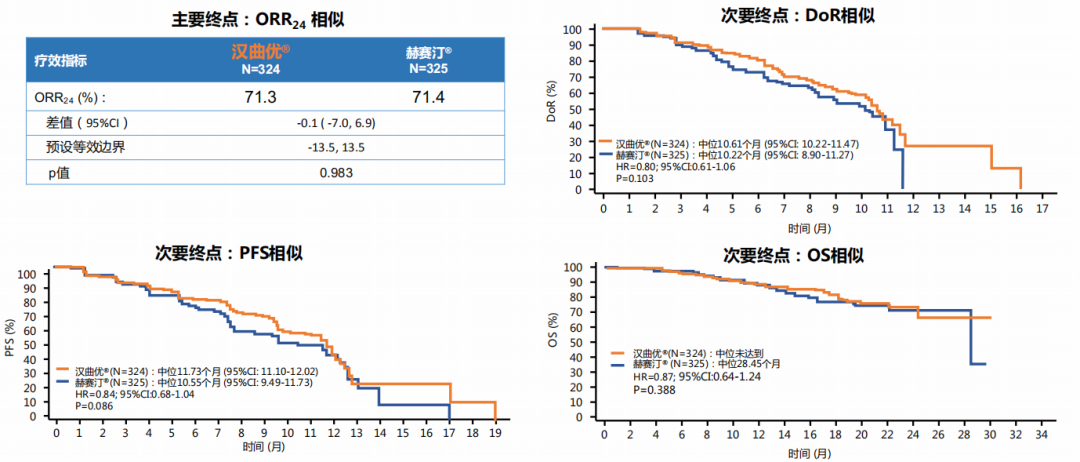
汉曲优是国内首个开展国际多中心III期临床研究的曲妥珠单抗生物类似药,在研究设计和实施过程中严格遵循国际标准。作为国内HER2阳性乳腺癌生物类似药中样本量最大、选用欧洲市售曲妥珠单抗作为参照药进行的III期临床比对研究,III期临床研究结果显示,汉曲优与欧洲市售曲妥珠单抗的24周最佳客观缓解率(ORR24)分别为71.3%和71.4%,ORR24组间差异95%置信区间在预设的等效区间内,汉曲优和欧洲市售原研曲妥珠单抗疗效等效性成立。
除此之外,在亚组分析人群中(中国 vs 非中国),汉曲优组与原研曲妥珠单抗组ORR 24周均无统计学差异(P>0.05),汉曲优组与原研曲妥珠单抗组在不同人群中的疗效相似。次要疗效终点如临床获益率(CBR)、疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)等,两个治疗组间无显著统计学差异(P>0.05)。在安全性方面,两组均未发生超出预期的不良事件。在不良事件中与药物相关的心脏疾病的发生率和严重程度上,汉曲优组和原研曲妥珠单抗组相似。
上述研究结果充分论证了与原研曲妥珠单抗相比,汉曲优在疗效、安全性和免疫原性方面均无临床意义的差别[5]。
期待汉曲优的上市能改善HER2阳性肿瘤的治疗现状,并通过生态圈的建立,联同各方构建HER2领域治疗新格局,实现“不让一个HER2阳性患者落下”的宏愿。
参考资料
[1] Feng R M, Zong Y N, Cao S M, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Communications, 2019, 39(1): 22.
[2] Yao M, Fu P. Advances in anti-HER2 therapy in metastatic breast cancer. Chin Clin Oncol 2018;7(3):27.
[3] Xie L, et al. BioDrugs. 2020 Feb 18. doi: 10.1007/s40259-020-00407-0.
[4] Henlius Internal Data.
[5]汉曲优-BC01临床研究报告(报告版本:期中分析报告II,1.0 版本,2019 年10 月25 日)