中国前列腺癌患者基因检测专家共识(2020年版)
[摘要] 随着第二代测序(next-generation sequencing,NGS)技术在前列腺癌诊疗中愈加广泛的应用,越来越多的患者能够从前列腺癌精准治疗中获益。美国食品药品管理局(Food and Drug Administration,FDA)已批准多聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂用于携带同源重组修复基因突变的转移性去势抵抗性前列腺癌的治疗;而就程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)抗体等免疫检查点抑制剂而言,错配修复缺陷及高微卫星不稳定型前列腺癌患者能够通过帕博利珠单抗(pembrolizumab)治疗获益。此外,NGS检测对于携带胚系基因突变患者家属肿瘤发病风险的预估也具有重要作用。如何在利用NGS技术精准定位可获益前列腺癌患者的同时避免过度检测,如何在遗传咨询中针对基因突变进行解读并提供后续的诊疗建议,从而为中国前列腺癌患者制定个体化的治疗方案是所有临床医师面临的重要问题。在《中国前列腺癌患者基因检测专家共识(2018年版)》和《中国前列腺癌患者基因检测专家共识(2019年版)》的基础上,中国抗癌协会泌尿男生殖系肿瘤专业委员会及中国临床肿瘤学会前列腺癌专家委员会组织专家结合最新发表的数据形成《中国前列腺癌患者基因检测专家共识(2020年版)》(以下简称《2020年版共识》),以便进一步指导NGS基因检测在前列腺癌诊疗中的规范应用,不断优化患者的个体化诊疗方案,探索并建立以肿瘤生物标志物为引导的临床治疗路径。
[关键词] 前列腺癌;第二代测序技术;基因检测
[Abstract] With more wide application of next-generation sequencing(NGS) technology in prostate cancer, increasing numbers of patients have benefited from the precision treatment. The USA Food and Drug Administration(FDA) has approved the poly(ADP-ribose) polymerase(PARP) inhibitor for the treatment of metastatic castration-resistant prostate cancer with homologous recombination repair gene mutations. As for programmed death-1(PD-1)/programmed death ligand-1(PD-L1) inhibitors, the outcome of unselected cases is limited whereas patients with mismatch repair defects have a positive response to pembrolizumab. In addition, the application of NGS plays an important role in predicting the cancer risk in family members with gene mutation. And it is important for every clinician to consider how to precisely locate the patients likely benefiting from NGS, avoiding over-detection and provide advices based on gene mutations. In order to further guide the standardized application of NGS, optimize the individualized diagnosis and treatment for prostate cancer patients, and establish a clinical treatment pathway guided by tumor biomarkers, China Anti-Cancer Association Genitourinary Cancer Committee and Chinese Society of Clinical Oncology Committee on Prostate Cancer updated this expert consensus with newly published research.
[Key words] Prostate cancer; Next-generation sequencing technology; Genetic testing
1
前言
随着第二代测序(next-generation sequencing,NGS)技术在包括前列腺癌等肿瘤临床诊疗中得到愈发广泛的应用,对NGS在前列腺癌临床应用过程中的检测内容、检测技术、生物信息学分析、数据处理及解读等环节的质量管理提出了更高的要求。国外已出台了诸如《基因检测对遗传性前列腺癌风险评估作用:2017年费城前列腺癌会议共识》[1](以下简称《费城共识》)等共识以规范该技术在前列腺癌患者诊疗及筛查中的应用;中国抗癌协会泌尿男生殖系肿瘤专业委员会也相继出版了《中国前列腺癌患者基因检测专家共识(2018年版)》[2]和《中国前列腺癌患者基因检测专家共识(2019年版)》[3]。
《中国前列腺癌患者基因检测专家共识(2020年版)》(以下简称《2020年版共识》)在综合国内外最新指南共识的基础上,参考最新发表的前列腺癌精准治疗相关研究数据和文献,进一步规范和指导前列腺癌基因检测的对象、内容、技术、数据处理和解读。推荐有意愿进行基因检测的受检者以指导治疗决策或以遗传咨询为目的进行基因检测。随着中国前列腺癌患者基因突变特征及精准治疗数据的不断产出,未来将继续结合中国前列腺癌患者的精准诊疗数据更新本共识;同时继续呼吁建立医院、基因检测实验室(公司)等相关机构共同参与的协作数据共享平台或数据库,以明确中国前列腺癌患者的驱动基因突变分子特征及其与转移、复发、疗效评估、药物不良反应的相关性等信息。《2020年版共识》专家委员会也倡导各单位组建生殖泌尿肿瘤精准医学专家团队(genitourinary molecular tumor board,GU-MTB),为肿瘤治疗提供更多选项,优化患者的个体化诊疗方案,并建立生物标志物引导的临床治疗路径。
2
适宜进行基因检测的对象
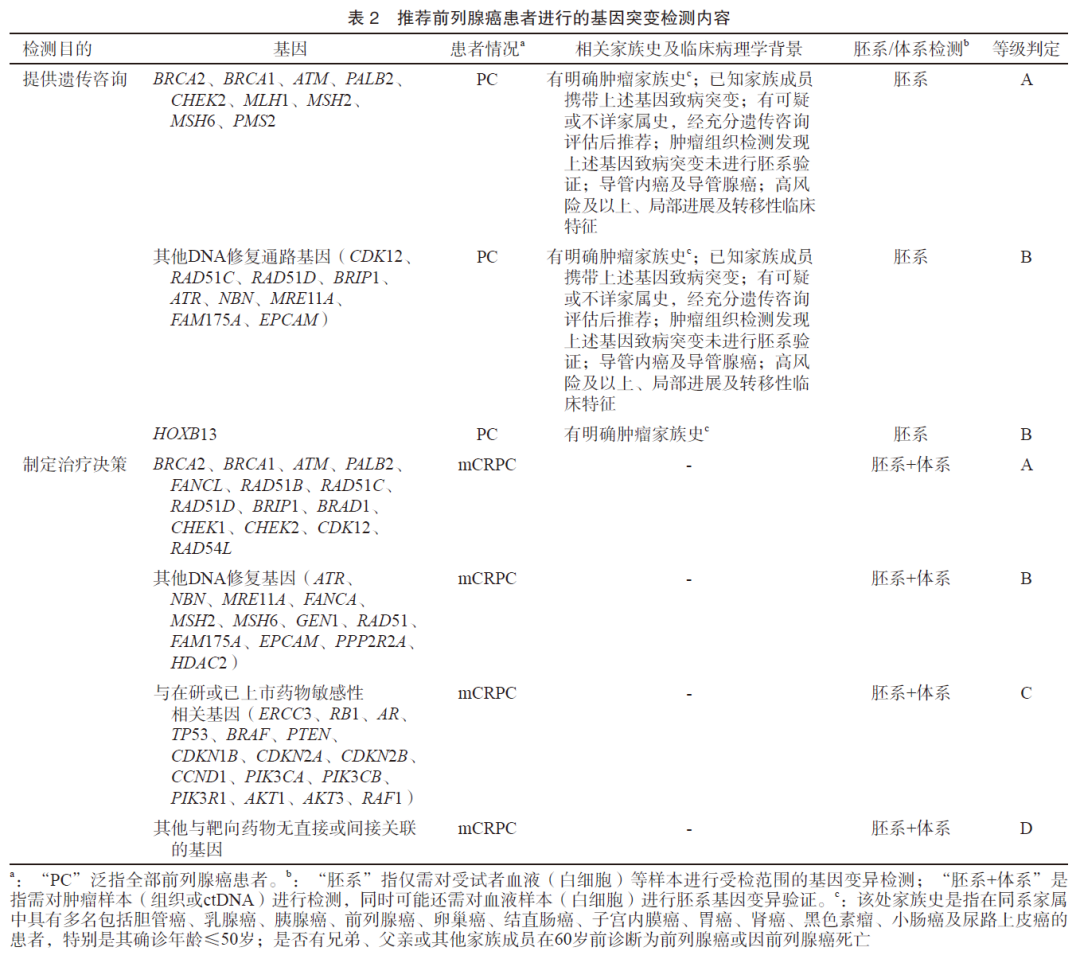
不同病情和治疗阶段的前列腺癌患者的基因突变特征各异[4],基于前列腺癌临床实践及药物研发现状,推荐基于“提供遗传咨询”和“制定治疗决策”为目的的NGS基因突变检测(表1)。

提供遗传咨询:评估是否适宜进行基因检测需要结合前列腺癌患者的家族史、临床及病理学特征。其中家族史需要考虑:① 是否有兄弟、父亲或其他家族成员在60岁前诊断为前列腺癌或因前列腺癌死亡;② 是否在同系家属中具有3名及以上包括胆管癌、乳腺癌、胰腺癌、前列腺癌、卵巢癌、结直肠癌、子宫内膜癌、胃癌、肾癌、黑色素瘤、小肠癌及尿路上皮癌的患者,特别是其确诊年龄≤50岁;③ 患者个人是否有男性乳腺癌或胰腺癌病史;④ 是否已知家族携带相关胚系致病基因突变。《NCCN指南》显示,BRCA1/2基因有害突变的携带者在65岁之前罹患前列腺癌的风险增加,特别是BRCA2胚系突变患者有更高的早发前列腺癌和前列腺癌死亡风险。因此,《2020年版共识》推荐BRCA1/2胚系突变的携带者从40岁起每年行基于前列腺特异性抗原(prostate-specific antigen,PSA)的前列腺癌筛查。
对于初诊未进行风险评估、极低风险至中风险的前列腺癌患者,其家族史的获得及遗传咨询是检测前的必要步骤:对于具有明确相关家族史、已知家族成员携带胚系致病基因突变的上述风险级别患者,推荐进行DNA损伤修复相关基因(特别是BRCA2、BRCA1、ATM、PALB2、CHEK2、MLH1、MSH2、MSH6、PMS2)的胚系变异检测;对于家族史不详的上述风险级别患者,需要结合临床特征进行遗传咨询后综合判断是否有必要进行相关检测。对于高风险、极高风险、局部进展及转移性前列腺癌患者,推荐进行DNA修复基因(特别是BRCA2、BRCA1、ATM、PALB2、CHEK2、MLH1、MSH2、MSH6、PMS2)的胚系变异检测。另外,IDC-P和DAP是前列腺癌中具有独特病理学特征的亚型。DAP发生率较低,仅占全部前列腺癌患者的1%;而IDC-P在不同的样本类型、风险及临床分期前列腺癌患者中所占比例不同:在低风险、中风险、高风险及转移复发前列腺癌中,IDC-P的比例分别为2.1%、23.1%、36.7%及56.0%[5]。与腺癌患者相比,IDC-P和DAP患者基因组不稳定性、错配修复基因及同源重组修复(homologous recombination repair,HRR)基因(特别是BRCA2基因突变)比例更高[6-8]。IDC-P和DAP患者预后较差,对具有该病理学特征的前列腺癌患者,不论是否存在明确的肿瘤家族史均推荐进行胚系基因检测。
制定治疗决策:对于所有mCRPC患者,推荐进行至少包含HRR基因胚系及体系变异的检测,并可以考虑行微卫星不稳定性(microsatellite instability,MSI)和DNA错配修复缺陷(DNA mismatch repair deficiency,dMMR)检测。如肿瘤组织检测已发现与肿瘤发病风险相关基因突变而缺乏胚系变异验证的前列腺癌患者,建议遗传咨询后再考虑是否进行检测。
3
检测内容
虽然通过NGS技术发现多数mCRPC患者存在具有临床价值的基因突变[9],但是由于药物研发及相关药物在前列腺癌患者临床研究中的证据有限,针对前列腺癌患者的NGS基因检测应在增加受检者获益及避免过度检测中求得平衡。《二代测序技术在肿瘤精准医学诊断中的应用专家共识》[10]建议检测应包含国际、国内指南中明确指定、美国食品药品管理局(Food and Drug Administration,FDA)/中国国家药品监督管理局(National Medical Products Administration,NMPA)批准的适应证相关的临床分型基因突变,还应纳入正在开展的任何期别(Ⅰ~Ⅲ期)临床试验中的药物相关靶点、已完成或即将开展的临床试验的入组标准中药物相关靶点及其他癌种指南中推荐的药物相关靶点。有限基因数量的组合则可能导致治疗、遗传相关基因突变信息遗漏并增加受试者后续检测费用及样本损耗。因此《2020年版共识》建议针对不同遗传背景及检测目的的受检者,应根据实际需要进行检测组合的筛选,检测组合和检测流程应在临床应用前进行充分的性能分析评估。其中,国际指南、共识及大型临床研究均发现HRR基因突变前列腺癌患者对奥拉帕利(olaparib)等多聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂敏感;《NCCN指南》推荐HRR基因突变的CRPC患者接受olaparib治疗(1类推荐),推荐卢卡帕尼(rucaparib)作为BRCA突变的CRPC的治疗方案(2A类推荐);同时美国FDA已批准olaparib用于治疗经新型内分泌治疗后进展且携带HRR突变的mCRPC患者(ATM、BRCA1、BRCA2、BARD1、BRIP1、CDK12、CHEK1、CHEK2、FANCL、PALB2、RAD51B、RAD51C、RAD51D、RAD54L),批准rucaparib治疗经新型内分泌治疗和多西他赛化疗后进展且携带BRCA突变的mCRPC患者。
此外,目前受到广泛关注的免疫检查点抑制剂如程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)抗体在未经筛选的前列腺癌患者中受益较为有限;《NCCN指南》建议通过检测错配修复及MSI筛选出的dMMR及高微卫星不稳定(microsatellite instability-high,MSI-H)型前列腺癌患者再考虑帕博利珠单抗(pembrolizumab)治疗(表2~3)。

3.1 NGS检测的样本类型
根据检测目的需要区分胚系(germline,来源于父母生殖细胞的变异,可通过生殖细胞继续遗传给子代)或体系(somatic,机体细胞后天产生的基因变异)变异检测。其中使用受试者的血液(优先考虑)、唾液、口腔拭子等样本可进行胚系变异检测;而受试者肿瘤组织(如新鲜肿瘤组织、石蜡包埋组织切片等)或循环肿瘤DNA(circulating tumor DNA,ctDNA)则可进行胚系+体系变异检测,在肿瘤组织或ctDNA检测的基础上,必要时需要进行胚系基因变异验证(或同时进行胚系基因变异检测)。由于前列腺癌中体系突变的存在(尤其是HRR基因),单纯的胚系突变检测不足以反映肿瘤实际的基因突变状态。ctDNA来自于肿瘤细胞剥落的片段DNA释放入血液中,通过无创获取血液样本可以实现动态监测肿瘤变化,因此也越来越广泛地应用于临床实践中。ctDNA检测灵敏度和特异度受限于血浆中的ctDNA的基因突变丰度,一项纳入45例mCRPC患者的研究[11]显示,ctDNA的基因突变丰度<2%不能准确地进行突变检测,基因突变丰度<35%不能计算基因拷贝数变异,基因突变丰度≥35%时与组织样本检测一致性可达到90%以上。局限期前列腺癌肿瘤负荷较小,血浆中ctDNA的基因突变丰度较低,低于检测阈值,液体活检不能发现临床有意义的突变[12]。在一项纳入53例新诊断转移性激素敏感性前列腺癌患者的研究[13]中,在平均测序深度927×的条件下,血浆ctDNA的基因突变丰度均值为11%,液体活检与组织检测一致性为80%;在短期(22 d)雄激素剥夺治疗(androgen deprivation therapy,ADT)后,ctDNA的基因突变丰度下降至1%左右。在mCRPC患者中,70%以上患者ctDNA的基因突变丰度>2%,与组织检测一致性达到90%[14]。目前组织检测仍是基因检测的金标准,在组织检测失败或组织不可及的情况下,可以考虑使用ctDNA的检测方式,两者之间的一致性还需要进一步的研究探索和数据支持。
3.2 NGS检测的基因
3.2.1 BRCA2、BRCA1及ATM
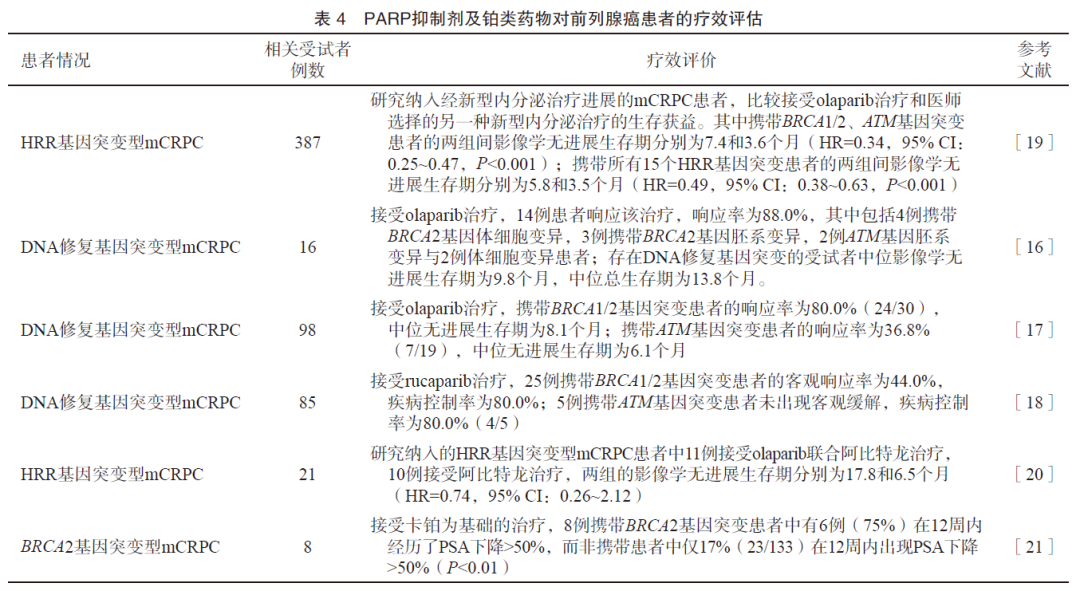
一项对2019例受试者的研究[15]发现,携带胚系BRCA1/2基因突变与更具侵袭性、更高概率的淋巴结、远端转移发生及更短的生存时间相关。TOPARP-A、TRITON2及TOPARP-B等多项大型Ⅱ期临床研究[16-18]均发现,具有DNA修复(特别是BRCA1/2)基因体细胞或胚系变异型mCRPC患者可能对PARP抑制剂敏感。Ⅲ期临床研究PROfound[19]明确证实具有HRR基因突变的患者(特别是BRCA1/2和ATM),能够从olaparib单药治疗中获益,其中BRCA1/2和ATM突变患者能够降低66%的影像学进展或死亡风险(表4)。同时有限的证据显示,携带该分子特征的前列腺癌患者可能对铂类药物化疗敏感。最近的研究[19]对2 792例mCPRC患者行肿瘤组织NGS检测发现,27.9%的患者存在HRR基因突变,其中携带BRCA2基因突变的患者比例为8.7%,携带ATM基因突变的患者比例为5.9%,携带BRCA1基因突变的患者比例为1.0%;中国前列腺癌患者携带BRCA1/2及ATM基因突变比例的研究数据较为匮乏,2019年发表的一项纳入316例中国前列腺癌患者的研究[22]显示,通过胚系基因检测,6.33%的受试者携带BRCA2,0.63%的受试者携带BRCA1,0.63%的受试者携带ATM基因致病变异。而在转移性激素敏感性前列腺癌阶段,一项纳入139例患者的研究[23]显示,28例患者(20.1%)携带胚系DNA损伤修复相关基因突变,突变患者会在更短时间内进展至mCRPC(8.3个月 vs 13.2个月,HR=2.73,P<0.001),特别是BRCA2突变患者中位至mCRPC时间仅为6.3个月。
3.2.2 其他HRR相关基因
在转移性、高风险和中低风险前列腺癌患者中携带胚系DNA修复基因突变的比例为11.8%、6.0%和2.0%[24];除上述的BRCA1/2及ATM基因外,在转移性前列腺癌患者中还检出CHEK2、RAD51D、ATR、NBN、GEN1、MRE11A、BRIP1及FAM175A等DNA修复基因胚系变异[24]。中国316例前列腺癌患者中除BRCA1/2、ATM外,还检出2例GEN1(0.63%)、1例CHEK2(0.32%)及1例FANCA(0.32%)基因胚系致病变异,提示中国转移性前列腺癌患者胚系基因突变谱与国外人群存在差异[22]。导致DNA修复缺陷的相关基因的胚系变异和体细胞变异,均是铂类药物和PARP抑制剂的增敏性潜在生物标志物,但由于携带该基因突变前列腺癌患者比例较低且临床入组人数有限,因此上述基因及具体变异与铂类药物和PARP抑制剂疗效的相关性有待进一步临床验证[16]。约12.9%的东亚mCRPC患者和4.2%的非东亚mCRPC患者可能携带CDK12基因突变/缺失,CDK12缺失与基因组不稳定性及免疫原性相关,携带该分子特征的患者可能对PARP抑制剂[17-19]及免疫检查点抑制剂敏感[25]。一项大型Ⅲ期临床研究[19]显示,在mCRPC的肿瘤组织中,BARD1、BRIP1、CDK12、CHEK1、CHEK2、FANCL、PALB2、RAD51B、RAD51C、RAD51D和RAD54L等HRR基因的突变比例总和约为12.3%,并且携带这些基因突变的患者对PARP抑制剂的治疗敏感。
3.2.3 错配修复基因
回顾性研究[26]发现,错配修复基因突变型前列腺癌患者的临床和病理学特征更具侵袭性。国外研究[9,27]报道,前列腺癌患者中dMMR及MSI-H患者比例为2%~5%。另有研究[4]报道,约3%的前列腺癌患者携带MSH2(2%)、MLH1(1%)、MSH6(1%)及PMS2(<1%)基因体细胞变异,携带上述基因突变的患者往往具有最高的总体基因突变数量。在中国316例前列腺癌患者中,携带MSH6、MSH2基因胚系致病变异的患者比例均为0.63%,未发现携带MLH1、PMS2基因胚系致病变异的患者[22]。
既往研究[28-29]认为,免疫检查点抑制剂在前列腺癌或mCRPC患者中疗效不佳。PD-1抗体pembrolizumab已于2017年5月获得美国FDA批准用于不可切除或转移性dMMR或MSI-H型实体瘤治疗。多项研究[26-27,30]纳入的有限数量的dMMR/MSI-H型前列腺癌患者均显示对pembrolizumab有较高的敏感性(表5)。《NCCN指南》推荐局部进展、转移性及mCRPC患者进行MSI-H及dMMR检测,如确诊为MSI-H或dMMR型,mCRPC患者可在特定治疗阶段考虑pembrolizumab治疗(2B类),同时需要进行遗传咨询及考虑林奇综合征(Lynch syndrome)的相关基因检测,进一步的MMR基因胚系变异检测可以明确其遗传性改变规律。考虑到先行免疫组织化学或MSI再根据结果决定行胚系变异检测的时间比较久,对于符合阿姆斯特丹标准或中国人林奇综合征家系标准(详见《遗传性结直肠癌临床诊治和家系管理中国专家共识》[31])、且有意愿将胚系变异的检测前置的前列腺癌患者可以考虑直接进行胚系变异检测。

3.2.4 其他基因
有研究[32]报道,在家族性前列腺癌患者中发现HOXB13基因突变(主要为G84E);但是基于中国前列腺癌遗传学联合会前列腺癌的研究数据,在671例受检者中仅有3例携带HOXB13基因突变(P=0.027),且突变为G135E而非高加索人中的G84E热点[33]。HOXB13基因的检测并无明确的治疗指导作用,但对直系家属具有肿瘤风险评估价值。《费城共识》提出需要对与遗传性前列腺癌相关的HOXB13基因进行检测(共识率95%),但鉴于其在中国患者中的发生率及靶向治疗相关性,《2020年版共识》建议综合受检者前列腺癌家族史考虑HOXB13基因突变的检测意义。
除HRR基因及DNA错配修复通路相关基因外,研究发现前列腺癌患者中还会出现包括AR、TP53、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号转导通路(PTEN、PIK3CA、PIK3R1、AKT1、AKT3等)、WNT信号转导通路(APC、CTNNB1、RNF43等)、细胞周期通路(RB1、CCND1、CDKN2A/B、CDKN1B、CDK4等)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路(BRAF、HRAS、KRAS等)以及染色体重塑(KMT2A、KMT2C、KMT2D、KDM6A等)等基因突变。针对以上通路的靶向药物如AKT抑制剂,显示出在晚期前列腺癌的抗肿瘤活性,Ⅰb期研究[34]显示能够降低25%的影像学进展或死亡风险。但目前临床应用证据仍比较有限,对上述基因突变检测的意义仍有待进一步确认,同时鼓励具有相关基因突变的前列腺癌患者积极参与药物临床研究。
近期多项研究[35-36]发现,RB1基因突变或缺失对mCRPC患者具有重要的预后预测价值,在mCRPC中,RB1基因突变或缺失与更差的生存期及阿比特龙或恩杂鲁胺更短的治疗时间有关,。另外,AR基因扩增/配体结构域变异及TP53基因突变也与前列腺癌阿比特龙及恩杂鲁胺敏感性降低相关[35]。
FOXA1是与AR受体通路相关的重要基因,FOXA1高表达与前列腺癌的不良预后相关。最近的一项对208例局限期前列腺癌患者的研究发现,41%的中国患者携带FOXA1突变,远高于既往西方发达国家患者的比例。并且中国患者FOXA1突变绝大部分为热点突变,可能通过调节AR通路促进前列腺癌的发生、发展[37]。
4
NGS检测流程的规范
基于NGS技术的基因检测流程可以分为6个环节,即样本获取及处理、核酸抽提、文库构建、上机测序、数据分析、变异解读及临床检测报告出具。每个环节都包括相应的质控步骤,以下结合前列腺癌特点简要介绍各环节重点,详情请参照《临床分子病理实验室二代基因测序检测专家共识》[38]、《二代测序技术在肿瘤精准医学诊断中的应用专家共识》[10]、《基于下一代测序技术的BRCA基因检测流程中国专家共识》[39]等共识要求。
① 样本获取及处理:胚系突变检测一般使用血液、唾液、口腔拭子等样本,目前以血液为主。肿瘤检测一般使用手术或穿刺获得的肿瘤样本。由于前列腺癌病程较长,手术存档标本保存年限长、质量差导致NGS检测失败,二次穿刺获取新鲜肿瘤组织难度大,患者接受度低,在mCRPC阶段可以抽取血浆ctDNA进行检测。② 核酸抽提:针对不同的样本类型,需要使用不同的DNA提取方法和试剂,优先采用中国NMPA批准上市的试剂框进行DNA提取。DNA的质量控制需要从纯度、浓度及片段化程度进行充分评估。提取后的剩余样本建议长期保存或保留至报告结果产生后按流程销毁。③ 文库构建及质控:文库制备可采用基于扩增子的方法和基于杂交捕获的方法,需考虑适用样本、DNA起始量等因素选择合适的文库制备试剂框,需从DNA浓度及片段大小等方面对文库进行质控。④ 上机测序:构建好的文库在高通量测序仪上进行上机测序,测序完成后需要对原始数据进行质控,一般参考Q30值,再进行后续的生物信息分析。⑤ 数据分析:质控后的原始数据常规的分析流程包括数据比对、变异识别、变异注释等,不同类型的变异采用特定的生物信息学分析方法,数据比对、去冗余之后需要对测序深度等检测指标进行质控。⑥ 变异解读及临床检测报告出具:变异解读是检测结果分析的关键步骤。变异分类建议根据致病性分为5类:5类-致病性、4类-可能治病性、3类-意义未明、2类-可能良性及1类-良性。数据解读标准和规范可参照《ACMG及AMP序列变异解读标准和指南(2015版)》[40]。
5
GU-MTB
《2020年版共识》专家委员会倡导各单位组建GU-MTB,以进一步规范本中心的基因检测与精准治疗。GU-MTB应纳入多学科成员,至少应包括1名熟悉精准医学的肿瘤科医师(基于患者的临床病理学信息发起基因检测需求,熟悉检测信息用于患病风险、预后疗效、靶向治疗等临床场景,并对患者的检测及治疗结果进行跟踪随访)、1名病理科医师(评估患者的肿瘤标本特征并提供符合检测需求的送检样本)、1名经培训的肿瘤遗传咨询医师(对检测结果进行解读和咨询工作,并开展可能的家族患病风险评估和早期干预),以及充分认知相关领域精准医学进展的放射诊断科医师、外科医师、内科医师、核医学科医师和本中心临床试验管理医师(参与精准医学临床试验的设计和开展)。GU-MTB有助于为肿瘤治疗提供更多选项,进一步优化并整合不同的治疗方案,为患者制定更加适宜的以生物标志物引导的临床治疗路径[41-42]。
[参考文献]
GIRI V N, KNUDSEN K E, KELLY W K, et al. Role of genetic testing for inherited prostate cancer risk: Philadelphia Prostate Cancer Consensus Conference 2017[J]. J Clin Oncol, 2018, 36(4): 414-424.
叶定伟, 朱 耀. 中国前列腺癌患者基因检测专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(8): 627-633.
YE D W, ZHU Y. Expert consensus on genetic testing in Chinese prostate cancer patients(2018 edition)[J]. China Oncol, 2018, 28(8): 627-633.
叶定伟, 朱 耀. 中国前列腺癌患者基因检测专家共识(2019年版)[J]. 中国癌症杂志, 2019, 29(7): 553-560.
YE D W, ZHU Y. Chinese expert consensus on genetic testing of prostate cancer patients(the 2019 edition)[J]. China Oncol, 2019, 29(7): 553-560.
ABIDA W, ARMENIA J, GOPALAN A, et al. Prospective genomic profiling of prostate cancer across disease states reveals germline and somatic alterations that may affect clinical decision making[J]. JCO Precis Oncol, 2017, 2017: 10.
PORTER L H, LAWRENCE M G, ILIC D, et al. Systematic review links the prevalence of intraductal carcinoma of the prostate to prostate cancer risk categories[J]. Eur Urol, 2017, 72(4): 492-495.
ISAACSSON VELHO P, SILBERSTEIN J L, MARKOWSKI M C, et al. Intraductal/ductal histology and lymphovascular invasion are associated with germline DNA-repair gene mutations in prostate cancer[J]. Prostate, 2018, 78(5): 401-407.
RISBRIDGER G P, TAYLOR R A, CLOUSTON D, et al. Patient-derived xenografts reveal that intraductal carcinoma of the prostate is a prominent pathology in BRCA2 mutation carriers with prostate cancer and correlates with poor prognosis[J]. Eur Urol, 2015, 67(3): 496-503.
BÖTTCHER R, KWELDAM C F, LIVINGSTONE J, et al. Cribriform and intraductal prostate cancer are associated with increased genomic instability and distinct genomic alterations[J]. BMC Cancer, 2018, 18(1): 8.
ROBINSON D, VAN ALLEN E M, WU Y M, et al. Integrative clinical genomics of advanced prostate cancer[J]. Cell, 2015, 161(5): 1215-1228.
张绪超, 梁智勇, 王升跃, 等. 二代测序技术在肿瘤精准医学诊断中的应用专家共识[J]. 中华医学杂志, 2018, 98(26): 2057-2065.
ZHANG X C, LIANG Z Y, WANG S Y, et al. Expert consensus on the application of next-generation sequencing technology in accurate medical diagnosis of tumor[J]. Natl Med J China, 2018, 98(26): 2057-2065.
WYATT A W, ANNALA M, AGGARWAL R, et al. Concordance of circulating tumor DNA and matched metastatic tissue biopsy in prostate cancer[J]. J Natl Cancer Inst, 2017, 109(12): djx118.
HENNIGAN S T, TROSTEL S Y, TERRIGINO N T, et al. Low abundance of circulating tumor DNA in localized prostate cancer[J]. JCO Precis Oncol, 2019, 3: 10.
VANDEKERKHOVE G, STRUSS W J, ANNALA M, et al. Circulating tumor DNA abundance and potential utility in de novo metastatic prostate cancer[J]. Eur Urol, 2019, 75(4): 667-675.
ANNALA M, VANDEKERHOVE G, KHALAF D, et al. Circulating tumor DNA genomics correlate with resistance to abiraterone and enzalutamide in prostate cancer[J]. Cancer Discov, 2018, 8(4): 444-457.
CASTRO E, GOH C, OLMOS D, et al. Germline BRCA mutations are associated with higher risk of nodal involvement, distant metastasis, and poor survival outcomes in prostate cancer[J]. J Clin Oncol, 2013, 31(14): 1748-1757.
MATEO J, CARREIRA S, SANDHU S, et al. DNA-repair defects and olaparib in metastatic prostate cancer[J]. N Engl J Med, 2015, 373(18): 1697-1708.
MATEO J, PORTA N, MCGOVERN U B, et al. Olaparib in patients with metastatic castration-resistant prostate cancer with dna repair gene aberrations(TOPARP-B): a multicentre, open-label, randomised, phase 2 trial[J].Lancet Oncol, 2020, 21(1): 162-174.
ABIDA W, BRYCE A H, VOGELZANG N J, et al. Preliminary results from TRITON2: a phase 2 study of rucaparib in patients with metastatic castration-resistant prostate cancer(mCRPC) associated with homologous recombination repair(HRR) gene alterations[J]. Ann Oncol, 2018, 29(suppl_8): Ⅷ271-Ⅷ302.
DE BONO J, MATEO J, FIZAZI K, et al. Olaparib for metastatic castration-resistant prostate cancer[J]. N Engl J Med, 2020, 382(22): 2091-2102.
CLARKE N, WIECHNO P, ALEKSEEV B, et al. Olaparib combined with abiraterone in patients with metastatic castration-resistant prostate cancer: a randomised, doubleblind, placebo-controlled, phase 2 trial[J]. Lancet Oncol, 2018, 19(7): 975-986.
POMERANTZ M M, SPISÁK S, JIA L, et al. The association between germline BRCA2 variants and sensitivity to platinum based chemotherapy among men with metastatic prostate cancer[J]. Cancer, 2017, 123(18): 3532-3539.
WEI Y, WU J, GU W, et al. Germline DNA repair gene mutation landscape in Chinese prostate cancer patient[J]. Eur Urol, 2019, 76(3): 280-283.
WEI Y, WU J L, GU W J, et al. Prognostic value of germline DNA repair gene mutations in de novo metastatic and castration-sensitive prostate cancer[J]. Oncologist, 2020, 25(7): e1042-e1050.
PRITCHARD C C, MATEO J, WALSH M F, et al. Inherited DNA-repair gene mutations in men with metastatic prostate cancer[J]. N Engl J Med, 2016, 375(5): 443-453.
WU Y M, CIEŚLIK M, LONIGRO R J, et al. In activation of CDK12 delineates a distinct immunogenic class of advanced prostate cancer[J]. Cell, 2018, 173(7): 1770-1782. e14.
ANTONARAKIS E S, SHAUKAT F, ISAACSSON VELHO P, et al. Clinical features and therapeutic outcomes in men with advanced prostate cancer and DNA mismatch repair gene mutations[J]. Eur Urol, 2019, 75(3): 378-382.
LE D T, DURHAM J N, SMITH K N, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade[J]. Science, 2017, 357(6349): 409-413.
TOPALIAN S L, HODI F S, BRAHMER J R, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443-2454.
KWON E D, DRAKE C G, SCHER H I, et al. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration resistant prostate cancer that had progressed after docetaxel chemotherapy(CA184-043): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2014, 15(7): 700-712.
GRAFF J N, ALUMKAL J J, DRAKE C G, et al. Early evidence of anti-PD-1 activity in enzalutamide-resistant prostate cancer[J]. Oncotarget, 2016, 7(33): 52810-52817.
袁 瑛, 熊 斌, 徐 烨, 等. 遗传性结直肠癌临床诊治和家系管理中国专家共识[J]. 实用肿瘤杂志, 2018, 33(1): 3-16.
YUAN Y, XIONG B, XU Y, et al. The Chinese expert consensus on clinical diagnosis, treatment and pedigree management of hereditary colorectal cancer[J]. J Pract Oncol, 2018, 33(1): 3-16.
EWING C M, RAY A M, LANGE E M, et al. Germline mutations in HOXB13 and prostate-cancer risk[J]. N Engl J Med, 2012, 366(2): 141-149.
LIN X, QU L, CHEN Z, et al. A novel germline mutation in HOXB13 is associated with prostate cancer risk in Chinese men[J]. Prostate, 2013, 73(2): 169-175.
DE BONO, UGO D, DANIEL N, et al. Randomized phase Ⅱ study evaluating Akt blockade with ipatasertib, in combination with abiraterone, in patients with metastatic prostate cancer with and without PTEN loss[J]. Clin Cancer Res, 2019, 25(3): 928-936.
ABIDA W, CYRTA J, HELLER G, et al. Genomic correlates of clinical outcome in advanced prostate cancer[J]. Proc Natl Acad Sci U S A, 2019, 116(23): 11428-11436.
CHEN W S, AGGARWAL R, ZHANG L, et al. Genomic drivers of poor prognosis and enzalutamide resistance in metastatic castration-resistant prostate cancer[J]. Eur Urol, 2019, 76(5): 562-571.
LI J, XU C, LEE H J, et al. A genomic and epigenomic atlas of prostate cancer in Asian populations[J]. Nature, 2020, 580(7801): 93-99.
编写组. 临床分子病理实验室二代基因测序检测专家共识[J]. 中华病理学杂志, 2017, 46(3): 145-148.
Writing group. Expert consensus on next-generation gene sequencing in clinical molecular pathology laboratory[J]. Chin J Pathol, 2017, 46(3): 145-148.
编写组. 基于下一代测序技术的BRCA基因检测流程中国专家共识[J]. 中华病理学杂志, 2018, 47(6): 401-406.
Writing group. Consensus of Chinese experts on BRCA gene detection process based on next-generation sequencing technology[J]. Chin J Pathol, 2018, 47(6): 401-406.
SUE R, NAZNEEN A, SHERRI B, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424.
叶定伟, 朱 耀. 借精准医学之力深化前列腺癌的多学科综合治疗[J]. 中华外科杂志, 2019, 57(6): 401-403.
YE D W, ZHU Y. Using the theory of precision medicine to optimize the multidisciplinary comprehensive treatment of prostate cancer[J]. Chin J Surg, 2019, 57(6): 401-403.
叶定伟, 秦晓健, 朱 耀, 等. 泌尿男生殖系统肿瘤多学科团队诊治组织与实施规范中国专家共识(2020年版)[J]. 中国癌症杂志, 2020, 30(4): 313-320.
YE D W, QIN X J, ZHU Y, et al. Consensus of Chinese experts on the organization and implementation of the multidisciplinary team for diagnosis and treatment of genitourinary system tumors(2020 Edition)[J]. China Oncol, 2020, 30(4): 313-320.