审思明辨,聚焦肺癌系统治疗新时代下放疗地位的“升级”
2020年8月23日,“放疗靶向学院”大会于青岛线下和线上成功召开,大会汇聚肺癌和放射科领域多位专家学者,探讨肺癌靶向与放疗应用的最新前沿进展。大会邀请山东省肿瘤医院的李宝生教授、青岛大学附属医院的陆海军教授共同担任会议主席,李宝生教授、陆海军教授担任上半场学术盘点部分主持,河南省肿瘤医院的蒋月教授与陆海军教授担任下半场思辨争鸣部分主持,多位专家学者在学术盘点中分享了放疗及靶向治疗在早期、局晚期及晚期非小细胞肺癌(NSCLC)治疗中的应用策略,思辨争鸣部分则聚焦了靶向治疗时代的肺癌照射野大小问题。
李宝生教授在开场致辞中指出:“肺癌的系统性治疗已经进入免疫治疗、靶向治疗的新时代,在这一背景下,相对传统的放疗使用方式也值得进一步探索,找到与免疫治疗、靶向治疗等系统性治疗更好的结合方式,进一步改善患者的预后。”同样,陆海军教授也表示:“放疗是肺癌局部治疗的重要手段,如何以精准放疗为主结合综合治疗提高疗效是进一步延长患者生存期的重要研究方向。”
傅小龙教授:
放疗与药物在早期NSCLC治疗中的探索
上海市胸科医院的傅小龙教授分享了放疗在早中期肺癌,以及手术切缘阳性肺癌中,与系统性治疗手段联合使用的相关进展。
1
放疗在早中期NSCLC中的应用
随着影像、计算机和放疗技术的快速发展,放疗进入精准治疗时代,其中立体定向消融放疗(SABR)已成为早期NSCLC的标准治疗方式之一,局部控制率可超过90%,且不良反应轻。
SABR对患者的基础身体状况要求较低,目前是不可手术或拒绝手术者的标准治疗选择,且其适应证还在不断拓宽,如应用于多发微、小结节癌患者,但与手术相比,SABR无法为患者提供定性病理诊断结果,可能会导致一些相关问题。

虽然穿刺活检、无创检测等技术,可以在放疗后提供病理诊断相关信息,但如肺部亚实性结节(SSN)等情况,由于诊断定性就较为困难,患者应采用SABR等放疗还是手术,在临床上往往就较难抉择,部分患者可能被过度治疗。
近年来采用神经网络判断等手段,可以作为辅助手段,一定程度上提升诊断的准确性,以在临床实践中对SSN等患者选择获益最大的治疗方式。

2
支气管切端R1切除NSCLC的放疗
肺癌手术后的切除状态可分为完全切除、不完全切除、不确定切除三种,其中完全切除的标准较为苛刻,临床实现难度较大,过往文献报告显示不完全切除(R1)率约为1%-14%。
对这类不完全切除的患者,美国NCDB数据库、德国多中心回顾性分析等多项研究显示,显示术后放疗或能带来一定的生存获益,但获益主要与治疗前的临床分期有关,仅限于II/III期患者,而I期患者接受放疗可能对预后不利;患者的淋巴结状态、放疗剂量(>54Gy)也可能是影响总生存(OS)的孤立因素。

目前美国国家综合癌症网络(NCCN)临床实践指南中,对分期在IA期,接受不完全切除患者术后放疗的推荐级别为2B级,而其它指南推荐也无一致意见。上海市胸科医院的回顾性分析结果,与NCDB数据库结论相近,因此对分期在早期,但手术后切缘阳性患者进行术后辅助放疗的价值,仍需要大规模前瞻性研究证实。
曾铭教授:
放疗与药物在晚期NSCLC治疗中的探索
四川省人民医院的曾铭教授以EGFR突变阳性晚期NSCLC的治疗为核心,分析了放疗联合靶向治疗的作用机制、治疗模式和临床获益。
1
放疗联合靶向治疗的作用机制
我国及亚洲国家的肺癌患者中,EGFR突变阳性患者均较为常见,这对肿瘤的生物学行为有明显影响。进入免疫治疗时代,EGFR突变阳性肺癌被视为“冷肿瘤”,并不适合免疫治疗,靶向治疗仍是治疗的主要手段。
放疗虽然是局部治疗手段,但其联合EGFR-TKI使用存在明确的增效机制,如EGFR-TKI可抑制放疗后癌细胞的损伤修复,使细胞周期停留在对放疗相对敏感的G1、G2/M期等。对病情晚期的NSCLC患者,放疗+靶向治疗或可大有作为,破解多数EGFR-TKI不能给患者真正带来生存获益的难题。

2
放疗联合靶向治疗在治疗颅内转移中的应用
肺癌的远处转移,是导致治疗失败和患者死亡的主要原因,远处转移可以分为颅内、颅外转移两大类。在化疗时代全脑放疗(WBRT)和局部手术,是颅内转移主要的治疗方式。
TKI药物的出现改变了脑转移患者的治疗格局,虽然一代/二代EGFR-TKI存在入脑能力差的问题,三代TKI奥希替尼的出现显著改善了存在脑转移EGFR阳性患者的预后,颅内病灶客观缓解率和控制率明显提高。

但进入TKI治疗时代,颅内转移的治疗也存在一些常见误区,如颅内转移灶的基因突变状况、转移灶数量对预后影响其实非常明显,以及对转移灶处理的原则、随访频率尚未达成一致,对全脑放疗的副作用认识存在偏差等。
回顾性分析数据提示,放疗联合EGFR-TKI治疗存在颅内转移的患者,疗效较TKI单独使用更好,治疗安全性也有保证,但治疗模式、放疗时机等方面仍有待后续临床试验探索,以进一步改善疗效,奥希替尼的相关临床研究结果值得期待。

3
放疗联合靶向治疗在颅外转移中的应用
骨转移、肝转移等也是晚期NSCLC常见的转移部位,放疗联合靶向治疗的使用模式目前数据较少,仍有待临床探索提供证据。如2015年美国研究提示,SBRT联合一代EGFR-TKI厄洛替尼,可显著提升患者的无进展生存(PFS)和OS,后续研究将SBRT的范围扩大到了全部寡转移病灶,结果有待后续随访证实。
2020年在美国临床肿瘤学会(ASCO)年会上公布中期结果的中国III期研究SINDAS(Abstract #9508)也显示,SBRT77放疗联合一代EGFR-TKI,一线治疗寡转移患者获益明显。如果将一代EGFR-TKI更换为奥希替尼等三代TKI,可能会取得更好的疗效。

葛红教授:
放疗与药物在局晚期NSCLC治疗中的探索
河南省肿瘤医院的葛红教授基于目前不可切除局部晚期NSCLC治疗策略和临床诊疗中的问题,分析了EGFR突变患者采用放化疗联合EGFR-TKI的治疗前景。
1
不可切除局部晚期NSCLC患者的现有治疗模式
我国有约四分之一的NSCLC肺癌患者确诊时已为III期,这些患者仍可通过多学科诊疗(MDT),接受以治愈为目标的根治性治疗,使生存获益最大化。但多数III期患者,可能已失去最佳的手术治疗时机,即不可切除的局部晚期NSCLC患者。

此前这类不可切除III期患者的标准治疗方案,是根治性的同步放化疗,治疗可以为患者带来长期生存获益,是国内外权威指南及共识一致推荐的标准治疗选择,但围绕同步放化疗的优化策略多年未取得进展,长期疗效仍难以令人满意。

2
免疫治疗联合同步放化疗,开启III期肺癌治疗新时代
放化疗与免疫治疗联合,存在互相增效的机制。放疗可通过多种机制,激活机体抗肿瘤免疫应答来降低远处播散,辅助免疫治疗和化疗,协同发挥抗肿瘤作用,联合治疗的生存获益,已得到PACIFIC等大型临床研究的证实。

PACIFIC研究是免疫联合放化疗,在III期(局部晚期)NSCLC的首次成功,研究中患者在同步放化疗后,接受PD-L1抑制剂度伐利尤单抗维持治疗,3年OS率达到57%,中位OS和PFS都较安慰剂组显著改善。
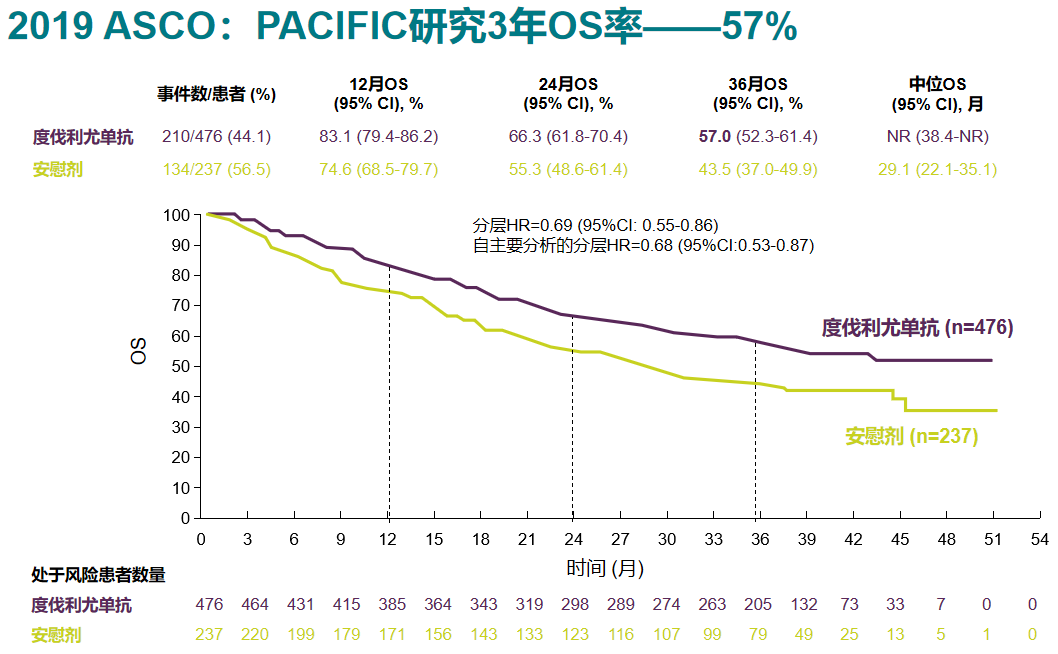
度伐利尤单抗维持治疗的效果,已得到真实世界数据的认证,但对EGFR突变患者可能并不适用。PACIFIC研究未要求患者行驱动基因检测,试验中只入组了45例EGFR突变患者,这些患者免疫治疗的获益,相对EGFR阴性患者明显更少。
帕博利珠单抗单药治疗PD-L1阳性、EGFR突变初治晚期NSCLC的临床II期试验,就因缺乏疗效而失败。此外KEYNOTE-010/CheckMate-057/OAK等研究的亚组数据也提示,免疫治疗可能并不适用于EGFR突变的患者。
除了疗效不佳,EGFR突变患者使用PD-1抑制剂的安全问题同样不可忽视,因此2019年的Ⅲ期非小细胞肺癌多学科诊疗专家共识中,多数专家(72.5%)不推荐EGFR突变患者在放化疗后,使用免疫治疗作为维持治疗。

综合以上情况来看,EGFR等驱动基因阳性的不可切除III期肺癌患者,需要寻找新的治疗优化出路,以进一步改善预后。
3
放疗联合TKI,带来治愈新希望
与联合免疫治疗时类似,同步放疗或放化疗联合EGFR-TKI,也存在协同增效机制,如放疗破坏血脑屏障,增加TKI的入脑;TKI可增加EGFR突变癌细胞对放疗的敏感性等。

2017年ASCO年会公布的RECEL研究数据显示,与同步放化疗相比,EGFR-TKI+同步放疗,可显著延长EGFR突变患者的PFS。2020年ASCO年会公布的一项中国多中心回顾性分析(Abstract #9047),也证实了放疗联合EGFR-TKI同步一线治疗,相对序贯治疗和TKI单药治疗的获益。

而在奥希替尼获批后,同步放化疗+奥希替尼维持治疗也已经开展了临床探索,奥希替尼具有独特的优势,可以高效地抑制EGFR-TKI敏感突变及T790M耐药突变,交出了良好的临床研究数据。
III期FLAURA研究中,奥希替尼组的中位PFS达到前所未有的18.9个月(HR=0.46;95%CI:0.37-0.57;P<0.001),疾病进展或死亡风险下降54%。奥希替尼治疗组的中位OS为38.6个月(95%CI:34.5-41.8),相较于对照组的31.8个月(95%CI:26.6-36.0)具有显著性差异,也是首个有OS获益的EGFR-TKI。


基于这一结果,奥希替尼相继被国际、国内多个临床实践指南推荐,在不可切除III期患者中的应用前景备受期待。未来的LAURA研究将入组200例放化疗(CRT)后的局部晚期患者,探索奥希替尼维持治疗对EGFR阳性不可切除III期患者的治疗价值。
讨论要点
对上半场学术盘点部分的分享,临沂市肿瘤医院的黄丙俭教授、山东省肿瘤医院胡旭东教授和威海市中心医院的祝胜杰教授等专家学者发表了个人看法:
1. 术后辅助放疗与辅助化疗等手段的联合应用,应考虑患者的临床分期、切除是否完全,回顾性分析已经提示对IA期等低危患者,放疗可能无法带来获益,但如果考虑到治疗整体的副作用,仍应优先考虑“无化疗”的辅助治疗模式;
2. 对存在EGFR突变的局晚期NSCLC患者,单纯采用TKI靶向治疗可能会使患者失去根治的机会,同步放化疗仍应是优先考虑的手段;但与IV期患者不同,局晚期NSCLC同步放化疗后的维持治疗目前仍缺乏统一标准,对EGFR突变阳性患者可考虑持续TKI维持治疗,现有证据支持这一模式的获益;
3. 在一线治疗晚期NSCLC患者当中,放疗联合EGFR-TKI等靶向治疗的增效机制已较为明确,但由于安全性、疗效与治疗时机密切相关,还需要前瞻性临床试验证实同步、序贯等模式的优劣,尽量实现个体化治疗。
思辨争鸣:
靶向治疗时代,肺癌照射野大小探讨
围绕肺癌系统性治疗进入靶向、免疫治疗时代,肺癌放疗照射野是大是小的问题,由临沂市肿瘤医院专家团队(正方)和青岛大学附属医院的专家团队(反方)分别就“靶向免疫时代,肺癌照射野应该小”和“靶向免疫时代,肺癌照射野应该大”进行了精彩的辩论。
正方:靶向免疫时代,肺癌照射野应该小
由黄丙俭、刘莲花、王浩铭、王文华四位专家组成的临沂市肿瘤医院团队认为,肺癌靶向免疫时代,应在多模态影像技术支持下精确勾画肺癌照射靶区,“小而不漏”,在决不妥协疗效的基础上尽量缩小靶区。
随着4D-CT、PET/CT功能影像、MR等多模态影像技术及主动呼吸门控系统等技术进步,精准确定肺癌靶区,避免肿瘤漏照、同时避免正常肺组织受照射过多,对放疗科医生都成为了可能。在这些基础上,放疗应做到肺癌靶区小而不漏。

如RTOG9311等前瞻性研究提示,对不可手术NSCLC患者采用选择性淋巴结照射,并不能带来生存获益,患者生存率低于累及野放疗。小靶区不仅有助于提高疗效,还可以降低放射性肺炎、肺纤维化等不良反应的发生率。
而在肺癌系统性治疗的新时代,缩小放疗照射靶区可以为其它治疗手段“留出空间”,降低各种治疗叠加导致的不良反应程度,从而保证治疗方案整体顺利进行。
反方:靶向免疫时代,肺癌照射野应该大
青岛大学附属医院的张永春、姜韬、安宁、陈志英四位专家则认为,虽然针对患者肿瘤分期的不同,放疗靶区有所差异,但免疫靶向时代肺癌靶区范围不应缩小。
早期NSCLC的SBRT靶区,仅包括原发病灶;局晚肺癌根治性放疗的靶区,一般包括原发病灶+阳性淋巴结(IFI),而晚期NSCLC放疗靶区,可按是否寡转移区分,寡转移可按局部肺癌治疗胸腔病灶,而非寡转移可SBRT照射所有转移灶。
由于放疗联合免疫治疗存在多种增效机制,相关临床研究已经大量开展。2020年ASCO年会报告了纳武利尤单抗(Abstract #9035)、阿替利珠单抗联合SABR治疗早期NSCLC的两项II期研究数据,原发灶局部照射+免疫治疗是安全有效的。

在局晚NSCLC中,PACIFIC研究确立了同步放化疗后免疫巩固治疗的地位,后续的PACIFIC2、DETERRED、NICOLAS等研究则有望优化治疗模式,但这些研究主要聚焦了免疫治疗的使用时机,采用的放疗模式仍然主要为传统的累及野照射。
对晚期寡转移NSCLC患者,采用SBRT、局部消融等局部治疗,或采用EGFR-TKI联合放疗的获益,已得到SINDAS、Bauml等多项临床研究的证实,且相关研究均未采用缩小靶区的做法,仍然保证了治疗的安全性。
因此NSCLC的放疗现行靶区,已充分考虑放疗副反应,在不影响疗效的前提下进行了优化,临床实践中也应根据公认范围进行初步勾画,再根据患者一般状况、肺基础功能等进行个体化调整,而不应在进入免疫靶向时代后进行靶区的缩小。
辩论部分1:大靶区放疗如何实现“大而不损”?
对于大靶区放疗如何实现“大而不损”的问题,青岛大学附属医院的团队表示,目前已有多项研究提示,免疫/靶向治疗联合SBRT治疗在照射全部原发和转移病灶,提升疗效,带来根治机会的基础上,并未明显导致安全性问题。
对于晚期寡转移NSCLC患者放疗的范围和剂量问题,临沂市肿瘤医院团队认为,基于目前的循证医学证据,进入免疫/靶向时代的晚期患者放疗范围和剂量,更多时候仍应根据个体化原则,结合RTOG相关放疗原则进行确定。
辩论部分2:N2阳性淋巴结患者放疗的范围和剂量
对于N2阳性淋巴结患者放疗的范围和剂量问题,青岛大学附属医院的团队认为,应把患者区分为可手术/不可手术,如手术后患者应照射同侧肺门、阳性纵隔淋巴结及隆突下淋巴结,非根治性切除患者的放疗范围应扩大到下一站淋巴结,即大靶区放疗;而不可手术患者的放疗范围,即使是在免疫/靶向时代,仍应以累及野照射的思路为主,两项中国研究均采用这一模式实现了明显临床获益。
对于IIIC期NSCLC患者的放疗模式,临沂市肿瘤医院团队表示,由于IIIC期患者存在肿块巨大、淋巴结转移多等特点,应根据初始系统性治疗,如靶向治疗、化疗、免疫治疗等手段的效果,进行后续的放疗靶区勾画和剂量调整。
辩论部分3:放疗理念应转为“最小损伤治愈”
临沂市肿瘤医院团队总结认为,靶向、免疫治疗的到来让放疗不再孤军奋战,放疗的理念应从过去的“最大剂量耐受”,转变为如今的“最小损伤治愈”。根据肺癌的分子分型,放疗应该与系统治疗有机结合,进行个体化治疗。以“小而不漏”为前提,设计最佳的治疗靶区和剂量,才能使疗效最大化。
青岛大学附属医院团队在总结中提出,缩小放疗靶区会存在降低病灶局部控制率、影响疗效的风险,而进入靶向/免疫治疗时代,放疗的作用并没有相对减弱,因此仍应遵循较大放疗野的治疗原则,为患者争取更好的预后。
最后,担任会议主席的山东省肿瘤医院李宝生教授对此次会议进行了总结。李教授指出,此次会议对肺癌系统性治疗新时代,放疗在早期、局部晚期及晚期NSCLC患者治疗中的应用探索进行了精彩的探讨。在靶向、免疫治疗时代,放疗的治疗作用和价值并未减弱,与系统性治疗的有机结合,使放疗对不同分期NSCLC患者的治疗都体现了价值,但最优方案选择、治疗时机和使用的安全性问题,也需要临床研究进一步深入探索。未来希望放疗与其它治疗手段真正实现有机结合,为患者带来更多的获益。