非小细胞肺癌靶向治疗最新进展大盘点来啦
敌人很强大,但我们也无需太过悲观。当前的肺癌,特别是非小细胞肺癌(NSCLC),正进行着治疗方式的巨大变革。从传统化疗到靶向治疗,非小细胞肺癌患者的生存时间不断提高!以晚期EGFR突变非小细胞肺癌患者为例[2]:
1995年至2002年间的传统化疗时代,肺癌患者的生存时间约10个月至12个月;
2009年EGFR靶向治疗使患者生存期延长到22个月;
2012年精准优化治疗使患者生存期延长到31个月;
2016年克服耐药难题后,患者中位生存期达到39个月,部分患者生存期更长。
靶向治疗给临床疗效带来了巨大的改变,恰好处于这场变革中的患者是相对幸运的,并且,更重要的是,这一切还只是开局,靶向治疗从未停下前进的步伐!
CSCO指南:这三大突变基因应当检测!
非小细胞肺癌靶向治疗领域日新月异,但必须说明的是,东西方人群在靶点分布、靶向治疗疗效上存在差异,因此,对于新治疗方案要更加谨慎。
2020年《中国临床肿瘤学会(CSCO)原发性非小细胞肺癌诊疗指南》对驱动基因阳性非小细胞肺癌的治疗推荐主要包括三类:表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)、c-ros原癌基因1酪氨酸激酶(ROS1)。
1 EGFR突变
EGFR属于人表皮生长因子受体家族,在细胞增殖和生长等生理过程中发挥重要作用。EGFR突变作为首个被发现的驱动基因,可引起酪氨酸激酶的异常活化,致使一系列细胞生物学行为的失控,导致非小细胞肺癌。
相关研究表明,EGFR在肺癌中的过度表达水平与不良预后密切相关。由此,针对携带EGFR突变的非小细胞肺癌靶向治疗药物,EGFR酪氨酸激酶抑制剂(EGFR-TKI)应运而生。
第一代EGFR-TKI主要有吉非替尼、厄洛替尼和埃克替尼。在治疗携带EGFR突变的非小细胞肺癌患者时,与传统化疗相比,吉非替尼与厄洛替尼都有着更好的临床疗效。第二代不可逆的EGFR-TKI代表药物阿法替尼,其作用靶点为EGFR和HER2。与吉非替尼相比,阿法替尼作用范围更广,能够进一步提高携带EGFR突变患者的无进展生存期。
然而,应用第一代及第二代EGFR-TKI治疗的患者最终都不可避免地产生耐药,其机制有多种,以T790M突变最为常见,50%以上的耐药都是由该机制引起。于是,以奥希替尼为代表的第三代EGFR-TKI便横空出世了,既可以抑制EGFR的敏感突变,同时可有效的选择性阻断T790M突变。
但是奥希替尼也并非万能,应用奥希替尼在初期取得较好的疗效,但部分患者用药数月后仍会出现耐药,最常见原因为C797S突变。存在该突变的患者对奥希替尼耐药,却对第一代EGFR-TKI敏感,因此,若C797S 突变及 T790M 突变为反式的,可采用第一代及第三代 EGFR-TKI 联合治疗[4]。
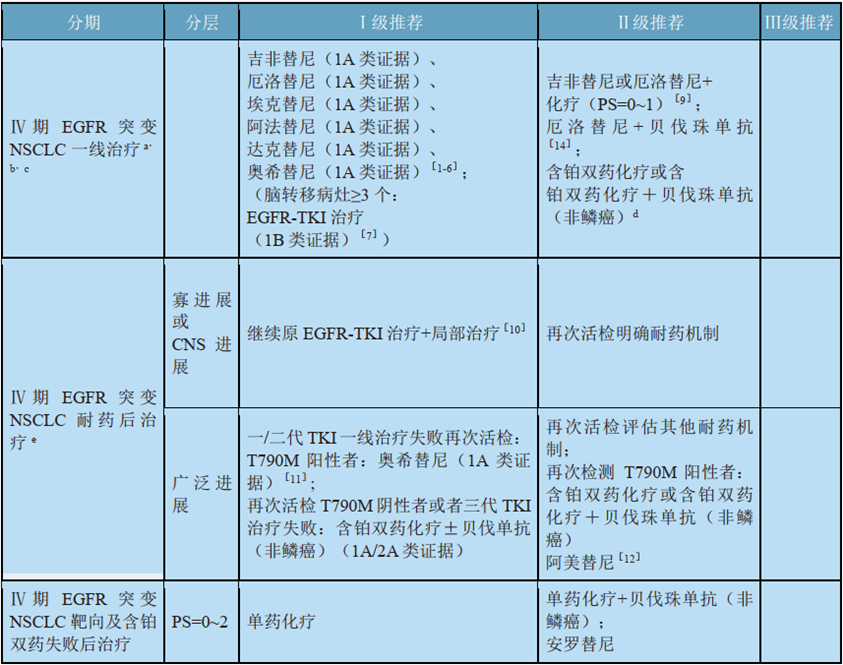
表1:2020 CSCO指南对EGFR突变NSCLC的治疗推荐
2 ALK基因融合
ALK 基因融合是继 EGFR后引起 NSCLC 的第二大突变, 有 2% ~ 7% 的NSCLC 是由该基因突变引起。
克唑替尼是一种受体酪氨酸激酶抑制剂(RTK),可同时抑制ALK、MET及ROS1的活化。作为临床治疗ALK基因融合阳性非小细胞肺癌最有效的靶向药之一,克唑替尼的客观缓解率和疾病控制率显著优于传统化疗。但和其他TKI一样,在使用克唑替尼一段时间后,患者同样会出现耐药,耐药机制主要包括ALK耐药基因突变、ALK基因扩增以及旁路信号通路如EGFR和丝裂原活化蛋白激酶上调等。并且,由于克唑替尼不易通过血脑屏障,患者可出现如肺癌脑转移等进展性病情。
为克服克唑替尼耐药,第二代ALK-TKI被相继研发出来,包括塞瑞替尼、阿来替尼及Brigatinib。二代ALK-TKI对血脑屏障更具穿透性,对肿瘤向中枢神经系统转移的患者具有更好的疗效。
然而,尽管第二代ALK-TKI对40%~50%的克唑替尼耐药患者有效,但是患者在治疗一段时间后,仍然出现耐药,最主要的机制为G1202R突变。Lorlatinib作为第三代ALK-TKI,是一种新型、高效的选择性ALK/ROS1抑制剂,对大多数ALK耐药突变具有显著疗效,且有很强的血脑屏障穿透能力,Lorlatinib已被美国食品药品监督管理局批准用于既往接受过第一代或第二代ALK-TKI治疗但病情仍持续进展的非小细胞肺癌患者[4]。
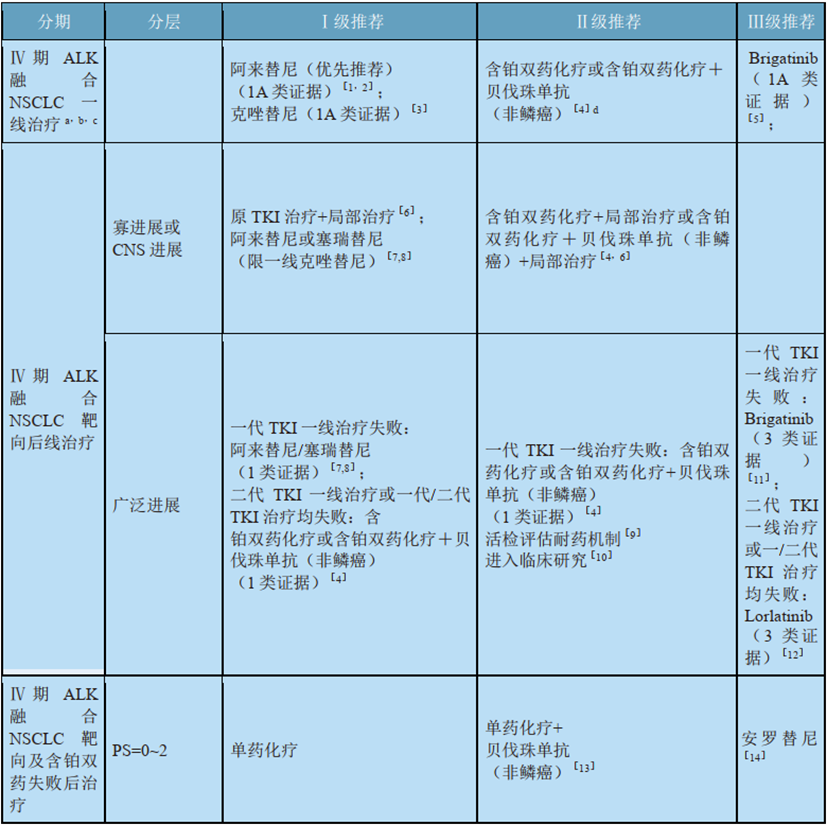
表2:2020 CSCO指南对ALK突变NSCLC的治疗推荐
3 ROS1基因重排
ROS1基因重排是引起非小细胞肺癌分子机制中一种新型孤立亚型,突变频率在肺腺癌中占1%~2%。由于ROS1和ALK在激酶结构域内有高度的同源性,所以ALK-TKI对ROS1融合基因阳性的患者有较好的治疗效果,例如克唑替尼、塞瑞替尼和Lorlatinib等[4]。
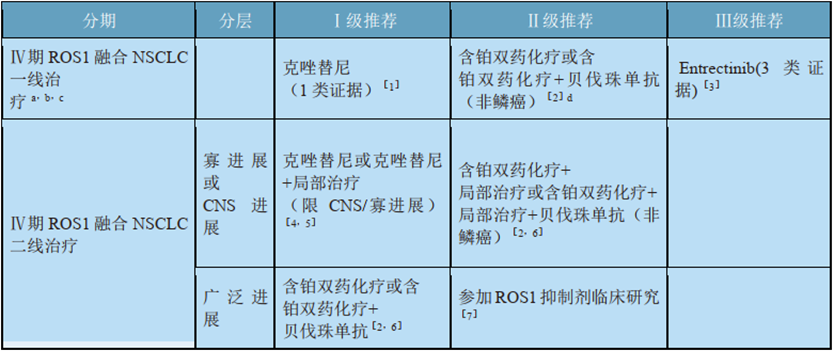
表3:2020 CSCO指南对ROS1突变NSCLC的治疗推荐
除了EGFR、ALK和ROS1这三大靶点,BRAF、NTRK、MET、HER2和RET等新兴靶点也逐渐研发出新靶向药,但目前均未在国内获批上市,期待进一步的研究成果。
靶向联合治疗锋芒初显,未来可期!
1 靶向联合化疗
与靶向治疗的联合治疗中,化疗是最早也是尝试较多的方案。
2016年9月,《J Clin Oncol》杂志发表了一项探索化疗和EGFR靶向药联合的随机、II期临床研究,共纳入195例东亚EGFR敏感突变的晚期NSCLC患者。与吉非替尼单药组相比,吉非替尼联合培美曲塞组的患者中位无进展生存期延长近5个月(15.8个月 vs 10.9个月)[5]。
另一项更具说服力的研究是2018年ASCO大会上公布的NEJ009研究。NEJ009研究是首例对比EGFR靶向药联合含铂类双药(培美曲塞+卡铂)与单药EGFR靶向药一线治疗EGFR敏感突变晚期非小细胞肺癌的III期临床研究,结果显示联合治疗组的中位无进展生存期达到20.9个月,而单药组仅11.2个月。并且,联合组的中位总生存期也显著延长[6]。
2 靶向联合抗血管生成治疗
靶向联合抗血管生成的方案很早就在国内获批。
Ⅲ期随机对照研究 CTONG1509探索贝伐珠单抗与厄洛替尼联合方案在中国人群的疗效和安全性,贝伐珠单抗联合厄洛替尼相比厄洛替尼单药显著延长EGFR突变晚期非小细胞肺癌患者的中位无进展生存期(中位18.0个月 vs 11.3个月, P<0.001)[3]。
然而,在总生存期方面,2020年ASCO大会公布的来自日本的III期NEJ026研究数据则显示,在厄洛替尼的基础上联合贝伐珠单抗未能给患者带来总生存期获益,联合治疗组和单药组的中位生存时间无显著差异(50.7个月 vs 46.2个月)[7]。
2020年5月30日,美国FDA正式批准了雷莫芦单抗联合厄洛替尼作为EGFR 19外显子缺失或21外显子L858R突变的转移性非小细胞肺癌的一线治疗。根据RELAY研究的数据,联合方案一线治疗EGFR突变晚期非小细胞肺癌患者,中位无进展生存期达到19.4个月[8]。
除了进口药物,国产抗血管生成药物同样熠熠生辉。安罗替尼是一种国产新型多靶点酪氨酸激酶抑制剂(TKI),作用于血管内皮细胞生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)、干细胞生长因子受体(c-Kit)等位点,不但可以抑制肿瘤细胞的增殖,也可以抑制肿瘤血管生成。
2019年世界肺癌大会(WCLC)公布了安罗替尼联合厄洛替尼一线治疗EGFR突变阳性的晚期非小细胞肺癌的初步疗效,92.6%的患者肿瘤缩小,100%的患者肿瘤得到控制,并且联合给药的毒副反应可耐受[11]。
时间来到2020年,美国临床肿瘤学会(ASCO)年会上报道了安罗替尼联合埃克替尼一线治疗携带EGFR敏感突变晚期非小细胞肺癌患者的研究数据,结果显示,患者客观缓解率(ORR)和疾病控制率(DCR)分别为70%和96.7%,显示出令人鼓舞的疗效,且安全性可管理[12]。
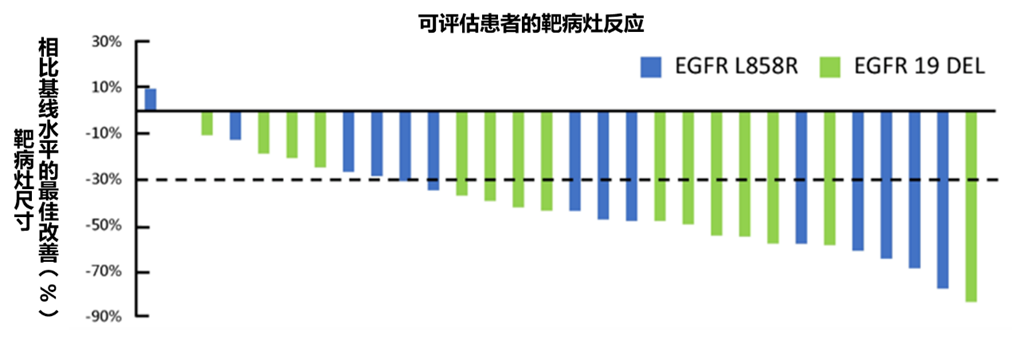
图1:安罗替尼联合埃克替尼一线治疗EGFR突变阳性晚期NSCLC疗效瀑布图
此外,安罗替尼联合埃克替尼一线治疗EGFR突变阳性伴有共突变晚期非小细胞肺癌患者的研究成果也即将亮相2020年欧洲肿瘤医学协会会议(ESMO 2020)!客观缓解率(ORR)和疾病控制率(DCR)数据更佳,效果可期。
总结
靶向治疗自诞生后发展迅速,已经极大地改善了驱动基因阳性非小细胞肺癌患者的预后。但也存在一些问题,例如耐药性、不良反应等。
目前,对于靶向治疗的模式、特异性、安全性以及新靶点等研究仍在不断探索中,在未来,靶向治疗一定会为更多的非小细胞肺癌带来福音,使其真正受益。