乳腺癌中紫杉类药物临床应用专家共识
乳腺癌是女性最常见的恶性肿瘤,根据国家癌症中心发布的最新数据显示,乳腺癌的发病率和死亡率分别位居女性恶性肿瘤的第1位和第5位,严重威胁女性健康[1]。紫杉类药物包括紫杉醇及其衍生物(多西他赛),是一类具有抗癌活性的二萜生物碱类化合物,疗效确切,是乳腺癌治疗中最常用的药物之一。为帮助临床医师更加合理地应用紫杉类药物,进一步规范诊疗行为,本专家委员会基于循证医学证据的进展,组织制定了《乳腺癌中紫杉类药物临床应用专家共识》。
紫杉类药物的作用机制
紫杉醇
紫杉醇最初于20世纪60年代从太平洋紫杉的树皮中分离提取,并于1971年被阐明化学结构,现为半化学合成物,具有广泛且明显的生物活性。其主要抗肿瘤作用机制是通过促进微管蛋白二聚体的聚合并阻止其解聚达到稳定微管的作用,从而抑制分裂间期和有丝分裂细胞功能重要的微管网的正常动态重组,同时导致微管束的排列异常,影响肿瘤细胞分裂。
静脉给予紫杉醇后,其浓度在血浆中呈现双相性降低曲线,血浆蛋白结合率为89%~98%。紫杉醇在体内分布尚未充分阐明,主要以非肾性清除。在不同程度的肝损伤患者中,对紫杉醇输注3 h的体内过程和不良反应进行评价,与血清胆红素正常患者相比,当紫杉醇剂量为175 mg/m2时,其在血清胆红素≤2倍正常值上限患者血浆中的浓度升高,但不良反应发生率未见明显增加,严重程度也未见明显加重。
在血清胆红素>2倍正常值上限患者中,即使在紫杉醇减量的情况下,重度骨髓抑制的发生率也较高,但其血浆浓度未见升高。关于肾功能不全对紫杉醇体内过程的影响尚未开展研究。紫杉醇具有高度亲脂性,不溶于水,需要用聚氧乙基代蓖麻油进行溶解。聚氧乙基代蓖麻油在体内降解时释放组胺,可导致严重过敏反应,并在血液中形成微小颗粒包裹紫杉醇分子,影响药物分子向组织扩散,进而影响抗肿瘤效应。因此,相继研发了旨在提高紫杉醇水溶性和药物治疗指数的紫杉醇脂质体和紫杉醇白蛋白结合型(以下简称白蛋白紫杉醇)。
紫杉醇脂质体
紫杉醇脂质体是由磷脂、胆固醇等材料构成的类似于细胞膜磷脂双分子层结构的脂质体包载紫杉醇,用药后易被网状内皮系统摄取,使药物主要在肝、脾、肺和骨髓等组织富集,而在心、肾分布较少,从而提高了药物的治疗指数,降低了药物毒性,提高了患者的耐受性。
白蛋白紫杉醇
白蛋白紫杉醇以纳米微粒白蛋白为载体,可通过白蛋白的独特转运机制(gp60-窖蛋白-SPARC),即受体介导胞转作用、高通透性和滞留效应(the enhanced permeability and retention,EPR),促进药物更多地进入肿瘤细胞内,达到较高的肿瘤细胞内浓度,具有相对靶向性。尚无白蛋白紫杉醇在胆红素水平>1.5 mg/dl和(或)血肌酐水平>2 mg/dl患者中的研究数据。
多西他赛
多西他赛是在紫杉醇的基础结构上进行改造合成的,具体为紫杉醇母核C10上的乙酰氧基被羟基取代,以及C13侧链N上的苯甲酰基被叔丁氧羰基取代。其抗肿瘤作用机制与紫杉醇类似,通过促进小管聚合成稳定的微管并抑制其解聚,从而使游离小管的数量明显减少,但结构上的特性使得多西他赛具有更高的微管亲和力,在相同不良反应剂量条件下,多西他赛的抗微管解聚能力大约是紫杉醇的2倍。多西他赛的药代动力学特点与剂量无关,符合三室药代动力学模型,血浆蛋白结合率超过95%,多西他赛及其代谢产物主要经粪便排泄,经粪便和尿排出的量分别约占所给剂量的75%和6%,仅有少部分以原型排出。
临床应用
化疗是乳腺癌综合治疗的重要组成部分,按照不同的应用时期可分为早期乳腺癌的术后辅助化疗、早期或局部晚期乳腺癌的术前新辅助化疗和晚期乳腺癌的一线、多线解救化疗等。紫杉类药物被广泛应用于上述各种治疗阶段。
(一) 辅助化疗
乳腺癌术后辅助化疗的选择应基于复发风险的个体化评估、肿瘤病理学分子分型(表1)和不同治疗方案的反应性。
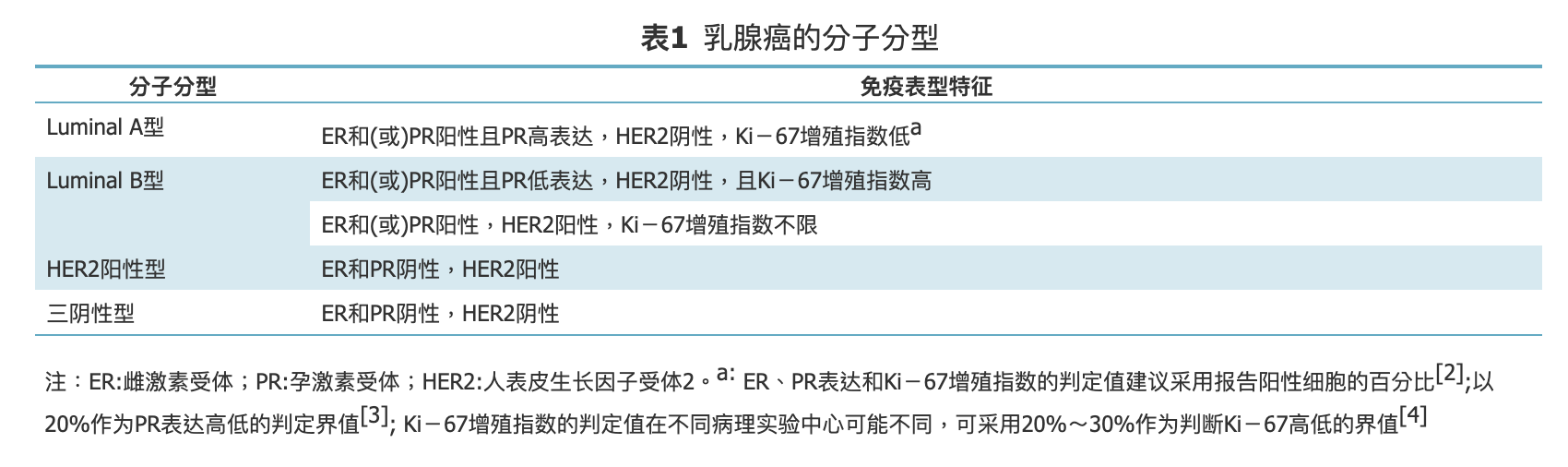
表1.乳腺癌的分子分型
适应证
具有以下高危因素的乳腺癌患者考虑接受辅助化疗:浸润性肿瘤>2 cm;腋窝淋巴结阳性;激素受体阴性;人表皮生长因子受体2(human epidermal growth factor receptor-2, HER2)阳性(对T1a以下患者,目前存在争议);组织学分级3级等。但上述单一指标并非化疗绝对适应证,术后是否接受辅助化疗应综合考虑患者的复发风险(表2)、分子分型、生理条件、基础疾病、患者意愿、化疗可能的获益和不良反应后决定。
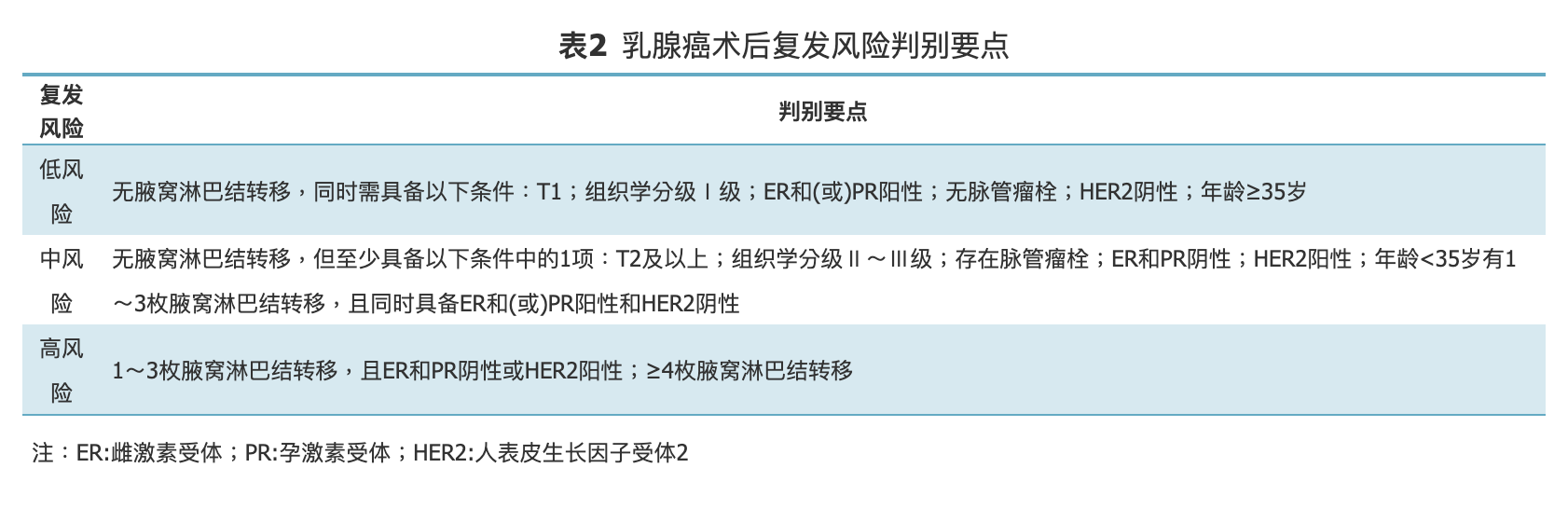
表2.乳腺癌术后复发风险判别要点
基于TAILORx研究结果[5],对激素受体阳性、HER2阴性,腋窝淋巴结阴性的早期乳腺癌患者可以进行21基因检测,对于21基因检测复发风险评分>30分的患者,建议辅助化疗联合内分泌治疗;对于21基因检测复发风险评分为26~30分的患者,推荐辅助化疗联合内分泌治疗;对于年龄≤50岁且21基因检测复发风险评分为16~25分的患者,可以考虑辅助化疗联合内分泌治疗。但考虑到目前我国尚无大样本规范21基因检测的临床研究,临床应用需谨慎选择。
含紫杉类药物的化疗方案在乳腺癌术后辅助治疗中的应用
2000年,美国食品药品监督管理局(Food and Drug Administration, FDA)批准紫杉醇用于乳腺癌术后辅助治疗。迄今,多个大规模临床试验数据均证实紫杉类药物是乳腺癌术后辅助化疗方案的重要组成部分。
(1)在蒽环类药物的基础上序贯或联合紫杉类药物:20世纪90年代,在早期乳腺癌患者术后辅助化疗中开展了一系列在蒽环类药物的基础上联合或序贯紫杉类药物的研究。CALGB9344[6]和NSABPB-28[7]2项大型随机对照研究比较了4个周期AC[多柔比星(ADM)+环磷酰胺(CTX)]方案基础上序贯或不序贯4个周期紫杉醇,均证实了紫杉醇的加入可以进一步减少复发,并改善患者生存。
PACS 01研究结果显示,与6个周期FEC[氟尿嘧啶(5-Fu)+表柔比星(EPI)+环磷酰胺(CTX)]方案相比,3个周期FEC序贯3个周期多西他赛在淋巴结阳性患者术后辅助治疗中表现出明显优势[8]。BCIRG 001研究结果显示,多西他赛联合蒽环类(TAC方案)在无病生存(disease free survival, DFS)和总生存(overall survival, OS)方面均显著优于FAC方案[9],具体化疗方案见表3。

表3.乳腺癌患者辅助治疗阶段推荐的含紫杉类药物化疗方案
(2)紫杉类药物的"去蒽环"方案:US Oncology9735研究比较了4个周期AC方案和4个周期TC[多西他赛(DOC)+环磷酰胺(CTX)]方案治疗Ⅰ~Ⅲ期乳腺癌,结果显示,TC方案可显著改善患者的DFS和OS[10],具体化疗方案见表3。
(3)紫杉醇的双周方案和每周方案:CALGB 9741研究提示,对于腋窝淋巴结阳性患者,AC-P[多柔比星(ADM)+环磷酰胺(CTX)序贯紫杉醇(PTX)]双周密集方案可明显改善患者的DFS和OS[11]。
ECOG 1199研究显示,在4个周期AC方案治疗后,紫杉醇每周方案和多西他赛3周方案均优于紫杉醇3周方案[12]。基于上述研究,本共识更推荐在4个周期AC方案后序贯紫杉醇,采用双周密集或每周给药的方式,具体化疗方案见表3。
推荐在HER2阴性患者中,高复发风险首选双周密集AC-P方案,可选方案为剂量密集AC序贯紫杉醇周疗方案、TAC方案;对于中复发风险患者首选AC-T每3周方案,可选方案为FEC-T;低复发风险患者首选TC方案(尤其是对蒽环类药物禁忌或不能耐受的患者),可选方案为AC、CMF[环磷酰胺(CTX)+甲氨蝶呤(MTX)+氟尿嘧啶(5-Fu)],具体化疗方案见表3。
(4)联合抗HER2靶向治疗:①适应证:a:T1c以上的HER2阳性乳腺癌患者应接受辅助化疗联合抗HER2靶向治疗。b:T1b或N1mi的HER2阳性乳腺癌患者推荐接受辅助化疗联合曲妥珠单抗治疗。②相对禁忌证:治疗前左心室射血分数(left ventricular ejection fraction, LVEF)<50%。
20%~30%的乳腺癌患者存在HER2基因扩增,其与肿瘤的发生、浸润、生长有关。抗HER2靶向治疗可明显降低乳腺癌患者的复发和死亡风险,改善预后。HERA研究显示,辅助化疗后序贯使用1年曲妥珠单抗可以明显降低HER2阳性乳腺癌患者的复发和死亡风险,延长曲妥珠单抗辅助治疗至2年不能进一步改善DFS[13]。
NSABPB-31研究[14]和NCCTGN 9831研究[15]的联合分析表明,曲妥珠单抗和紫杉醇同时使用(AC→P3WH或PWH方案)较常规AC→P3W或PW方案可以降低复发风险。BCIRG 006研究表明,相比对照组AC→T,TCH组和AC→TH组的DFS获益相近,并且TCH方案的不良反应更易耐受[16]。
APT研究显示,小肿瘤、淋巴结阴性的HER2阳性乳腺癌患者使用每周紫杉醇方案联合曲妥珠单抗治疗的3年DFS率为98.7%,并且出现严重不良反应事件的风险很低[17]。同样,4个周期TC+H(C为环磷酰胺)方案在早期HER2阳性乳腺癌患者中也取得了相似结果[18]。APHINITY研究证实,当在曲妥珠单抗+化疗的基础上再加用帕妥珠单抗时,帕妥珠单抗明显提高患者的无浸润性疾病生存(invasive disease-free survival, iDFS),淋巴结阳性和激素受体阴性亚组获益更加明显[19]。
本共识针对HER2阳性乳腺癌患者的推荐治疗方案包括TCH、AC→TH等。对于淋巴结阳性的患者,可将帕妥珠单抗加入到辅助治疗方案中。
对于淋巴结阴性的小肿瘤患者,尤其是受体阴性者,PWH和TC×4+H也是可以选择的方案。抗HER2辅助治疗的持续时间仍为1年。
(二) 新辅助化疗
适应证
(1)不能达到理想美容效果的有保乳需求的Ⅱ~Ⅲ期乳腺癌患者;(2)局部晚期乳腺癌患者。
含紫杉类药物化疗方案在乳腺癌新辅助治疗中的应用
新辅助化疗是局部晚期或炎性乳腺癌的规范疗法,可使肿瘤降期利于手术,提高保乳率,可直观地了解个体肿瘤对化疗药物和方案的敏感性等。随机临床研究证实,相同的方案用于新辅助治疗或辅助治疗对于患者远期疗效的影响是相似的[20,21]。因此,原则上辅助治疗推荐的化疗方案也可考虑用于新辅助治疗。详细方案参见辅助化疗(表3)。
(2)HER2阳性乳腺癌采用曲妥珠单抗治疗是现阶段新辅助靶向治疗的金标准[22],NeoSphere研究[23]和TRYPHAENA研究[24]证实了在曲妥珠单抗基础上加入帕妥珠单抗可进一步提高病理完全缓解(pathological complete response, pCR)率。
PEONY研究[25]也在中国人群中验证了这一结论。有蒽环类药物使用禁忌、高龄或其他心脏疾病的患者,可以使用不含蒽环的方案,如TCH±帕妥珠单抗方案。①推荐方案:TCH±帕妥珠单抗;AC→TH/PWH/P2WH±帕妥珠单抗。②其他方案:TC(环磷酰胺)+H、FEC→TH±帕妥珠单抗、TH/PWH/P2WH±帕妥珠单抗→FEC、PWH。
(3)BRCA基因突变乳腺癌:GeparSixto研究[26]和BrighTNess研究[27]显示,对于BRCA基因突变的患者,含铂类药物的新辅助化疗方案可能提高患者的pCR率。因此,本共识推荐对已知携带BRCA基因突变患者如行新辅助治疗时,可优选紫杉类药物联合铂类药物方案。
(三) 晚期化疗
晚期乳腺癌的治疗目的是控制疾病进展,改善患者生活质量,延长生存时间。鉴于蒽环类药物的心脏累积不良反应和辅助治疗中已被广泛使用,紫杉类药物成为晚期乳腺癌最常用的化疗药物。1994年,美国FDA批准紫杉醇用于治疗复发转移性乳腺癌。
适应证
(1)单药化疗:肿瘤发展相对较慢,肿瘤负荷不大,无明显症状,特别是老年耐受性较差患者(2)联合化疗:病情进展较快,肿瘤负荷较大或症状明显的患者,需要使肿瘤迅速缩小或症状迅速缓解的患者。
含紫杉类药物的化疗方案在晚期乳腺癌中的应用
(1)HER2阴性乳腺癌:
①单药化疗:常用的紫杉类单药包括紫杉醇(紫杉醇脂质体)、多西他赛和白蛋白紫杉醇,其他药物包括蒽环类(多柔比星、表柔比星、多柔比星脂质体)、抗代谢类药物(卡培他滨、吉西他滨)和非紫杉类抗微管药物(艾立布林、长春瑞滨),具体化疗方案见表4。
②联合化疗:原则上,既往未接受过化疗者(包括辅助化疗),首先考虑蒽环联合紫杉类药物。蒽环类治疗失败或达累积剂量者,优先选择紫杉类为基础的药物。
辅助治疗曾接受紫杉类药物治疗,距离复发时间>1年者,可以再次使用,优选未曾使用过的紫杉类药物。紫杉类药物联合吉西他滨或卡培他滨是一线治疗最常用的方案[28,29]。对于BRCA突变的晚期三阴性乳腺癌患者,含铂单药或紫杉类药物联合铂类方案具有一定优势[30]。阿特珠单抗联合白蛋白紫杉醇在肿瘤浸润免疫细胞程序性死亡蛋白配体1(programmed death-ligand 1, PD-L1)阳性的三阴性乳腺癌的一线治疗中,与单纯化疗相比,明显延长了患者的无进展生存时间(progression free survival,PFS)[31]。
(2)HER2阳性乳腺癌:CLEOPATRA研究显示,在多西他赛联合曲妥珠单抗的基础上加入帕妥珠单抗可明显改善患者的PFS和OS,多西他赛联合曲妥珠单抗+帕妥珠单抗可作为HER2阳性转移性乳腺癌的一线治疗方案[32]。在经济条件不允许的前提下,紫杉类药物联合曲妥珠单抗是晚期HER2阳性乳腺癌患者的一线推荐方案。有学者在临床研究中比较了在紫杉类药物和曲妥珠单抗的基础上,联合或不联合第2种化疗药物(卡铂或卡培他滨)的疗效,其结果显示,三药联合方案在客观缓解率和PFS方面有优势,但不能延长患者的OS[33],临床中应考虑既往治疗、联合用药的毒性,根据不同患者的情况选择联合或单药化疗方案,其他可选择的单药包括卡培他滨和长春瑞滨[34,35]等。


表4.乳腺癌患者晚期治疗阶段推荐的含紫杉类药物化疗方案
不良反应及其管理
紫杉类药物常见的不良反应包括过敏反应、骨髓抑制、神经毒性、器官功能损害等,大多数不良反应经对症处理后可获得缓解。
过敏反应
紫杉类药物本身和部分溶媒均可引起过敏反应。过敏反应发生率为30%~41%,严重过敏反应发生率为2%~5%[36]。所致过敏反应为Ⅰ型过敏反应,发生较早,一般出现在前几个疗程开始输注的2~10 min内,多表现为皮肤瘙痒、荨麻疹、潮红、恶心、呼吸困难等,严重者可导致死亡。多西他赛过敏反应发生率低于紫杉醇;紫杉醇脂质体、白蛋白紫杉醇则很少发生过敏反应。
临床上,通过预处理可明显降低过敏反应发生率。不同紫杉类药物的预处理方式见表5。然而预处理并不能完全消除过敏反应,因此,在应用紫杉类药物期间,特别是开始输注的前10 min,需要密切观察和监护。
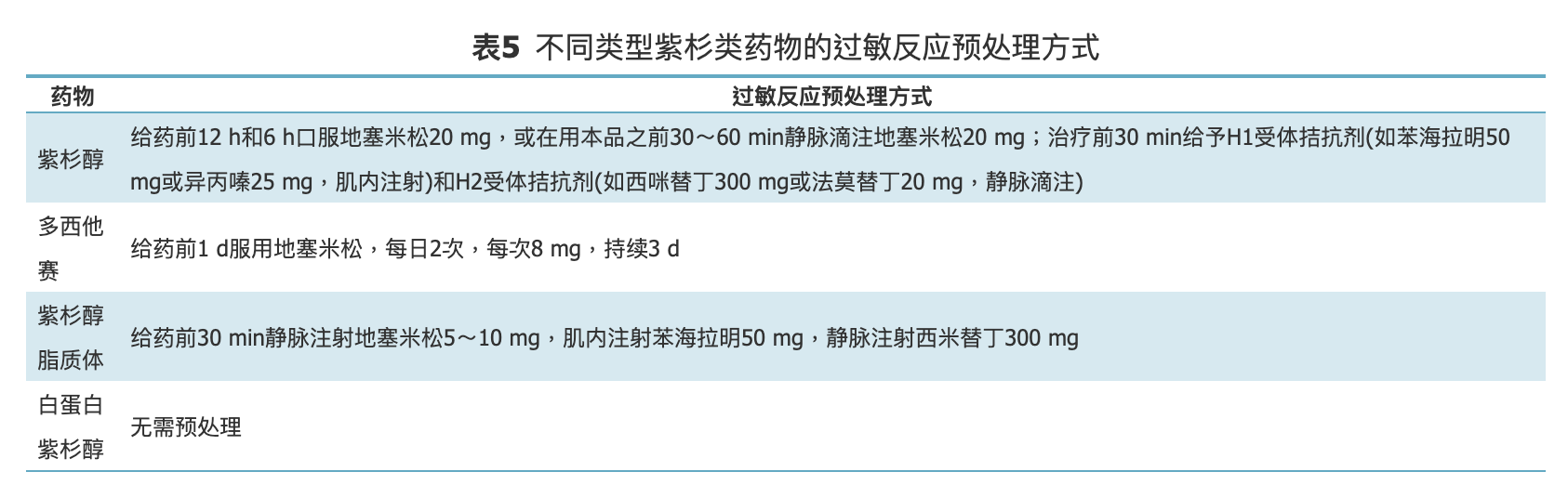
表5.不同类型紫杉类药物的过敏反应预处理方式
(1)轻度过敏反应及处理:①立即停止过敏药物输注,更换输液器,维持静脉通路通畅。②吸氧,保持呼吸道通畅,必要时气管插管。③抗过敏治疗,静脉推注地塞米松5~10 mg,或静脉滴注氢化可的松200 mg。④密切监测患者生命体征。轻度过敏反应经上述处理,患者生命体征平稳2~3 h后,在严密监护的同时,再次尝试缓慢输注该药物。若再次发生过敏反应,可尝试换用其他紫杉类或非紫杉类药物,并告知患者及其家属该类过敏药物需避免再次使用。
(2)重度过敏反应及处理:一旦发生,立即停药,迅速给予抗休克、抗过敏等治疗。① 0.1%肾上腺素0.3~0.5 mg肌内注射,成人最大剂量为1 mg,每15~30 min重复1次;若患者出现严重低血压或心搏骤停,同时予以心肺复苏。若肾上腺素升压无效,则可静脉滴注多巴胺溶液,以1~5 μg·kg-1·min-1起始,根据血压情况进行剂量调整。②维持循环容量,进行液体复苏,保证足够的组织灌注。③保持呼吸道通畅,吸氧,喉头水肿影响呼吸时,行气管插管或气管切开。呼吸抑制时可考虑尼可刹米或洛贝林等呼吸兴奋剂。④抗过敏治疗:静脉推注地塞米松5~10 mg,或静脉滴注氢化可的松200 mg或甲泼尼龙1~2 mg/kg;苯海拉明40~50 mg肌内注射,或异丙嗪25~50 mg肌内注射等。⑤其他:维持水、电解质、酸碱平衡等。发生严重过敏反应者不应再次尝试同类药物,生命体征平稳24 h后,可在严密监护下尝试其他紫杉类药物或非紫杉类药物。
骨髓抑制
骨髓抑制是紫杉类药物的剂量限制性毒性。12%~20%的患者可发生中性粒细胞减少性发热,约1%的患者可并发严重感染导致死亡[37]。紫杉类药物也可影响血小板和红细胞。有研究显示,氨磷汀对减轻骨髓抑制有一定作用。氨磷汀能够刺激正常造血干(祖)细胞的生长,促进正常造血功能恢复[38,39]。若患者出现严重的骨髓抑制,在积极对症支持治疗的同时,可考虑在下一周期减量,或停用紫杉类药物。
神经毒性
神经毒性是紫杉类药物常见的不良反应,呈剂量依赖性和累积性特点,部分可以逆转。主要包括感觉神经毒性、自主神经毒性和运动神经毒性等,其中感觉神经病变最为常见[40,41]。患者多表现为触觉减退、肢端麻木、刺痛,呈手套-袜套样改变等。神经营养类药物在治疗紫杉类药物引起的感觉异常周围神经病中的作用数据虽仍存在争议,但临床有一定治疗效果。
既往研究显示,在化疗前应用正常细胞保护剂(如氨磷汀)可有效降低3~4级化疗相关神经毒性的发生率[42]。感觉异常周围神经病患者可用药物包括B族维生素(维生素B1、B6、B12和复合维生素B)、叶酸和烟酰胺[43]。神经性疼痛对症治疗常用药物包括三环类抗抑郁药、5-羟色胺再摄取抑制剂类和钙通道阻滞剂类,其中度洛西汀治疗神经性疼痛被认为得到目前最佳的数据支持[44]。
心血管系统
紫杉类药物可以引起心律失常,临床上较常见的是无症状性或可逆性心动过缓,患者也可能出现心肌缺血、室上性心动过速、房室束支传导阻滞等症状[45]。
关节和肌肉症状
约超过50%接受紫杉醇治疗的患者可能出现关节或肌肉疼痛,通常在紫杉醇治疗后2~3 d出现,一般症状较轻,几天后可恢复。紫杉醇脂质体、白蛋白紫杉醇和多西他赛的关节或肌肉疼痛的发生率较低,非甾体抗炎药可用于缓解关节或肌肉疼痛[46]。
肝功能
紫杉类药物对肝功能的损害主要表现为转氨酶和胆红素水平升高,对于有肝胆疾病的患者应谨慎观察,及时给予保肝、降酶治疗[47]。
胃肠道系统
紫杉类药物属于中度致吐类药物,治疗期间,患者可能会出现轻至中度胃肠道反应,如恶心、呕吐、口腔溃疡和腹泻等不良反应,可予以止吐治疗和对症处理[48,49]。
其他
包括乏力、头痛、脱发等。紫杉类药物静脉给药还可引起注射部位反应(包括静脉和局部炎症、药物渗出等)的发生。处理方法参考常规化疗药物外渗的处理原则,局部封闭、皮下注射解毒药物等[50]。
剂量调整
(1)紫杉醇:如患者出现严重的中性粒细胞减少(定义为中性粒细胞计数绝对值<0.5×109/L且持续1周以上),或严重外周感觉神经症状,在后续治疗中剂量可减少20%左右(2)多西他赛:治疗期间,如患者发生中性粒细胞减少性发热且中性粒细胞计数绝对值<0.5×109/L且持续1周以上,出现重度或蓄积性皮肤反应或重度外周神经症状,多西他赛剂量可由100 mg/m2减至75 mg/m2和(或)由75 mg/m2减至60 mg/m2,若在60 mg/m2剂量时仍出现上述症状,则建议停止治疗(3)白蛋白紫杉醇:如患者出现严重的中性粒细胞减少(定义为中性粒细胞计数绝对值<0.5×109/L且持续1周以上),或严重外周感觉神经症状,白蛋白紫杉醇剂量可由260 mg/m2, 21 d为1个周期减至220 mg/m2, 21 d为1个周期;若再次出现上述症状,可继续将剂量减至180 mg/m2, 21 d为1个周期。出现3级外周感觉神经症状,应暂停治疗直至恢复至1或2级,且在后续疗程中予以减量。
综上所述,紫杉类药物自问世以来,经过20余年的临床研究和应用,其在乳腺癌化疗中的地位已基本确立,并广泛应用于乳腺癌的新辅助、辅助及晚期治疗等多种阶段。不仅单药有效率高,也常与其他化疗和(或)靶向药物联合使用。在不良反应方面,主要剂量限制性毒性为骨髓抑制,其他不良反应多为一过性,患者耐受性佳。随着肿瘤治疗的蓬勃发展,紫杉类药物与免疫治疗等新兴疗法的联合应用也在计划或进行中,其临床应用前景将越来越广阔。