“双特异性抗体”助力PD-1阻断免疫疗法,抗肿瘤免疫更强更持久!
以PD-1/PD-L1阻断剂为代表的免疫治疗已成为癌症治疗史上重要的里程碑,然而单药免疫治疗有限的应答率和原发/继发性耐药是该疗法所面临的主要难题。既往研究表明,CD28共刺激途径与PD-1检查点之间存在相互作用:PD-1通过TCR/CD3复合物和/或CD28的去磷酸化来减弱T细胞的激活。基于此,靶向CD28并联合PD-1阻断,或将产生更广泛、更持久的抗肿瘤免疫反应,有望实现肿瘤清除。
近日,基于54位科学家联合发表在Science 转录 Medicine上的一项最新研究,一种新型抗肿瘤免疫疗法——共刺激性CD28双特异性抗体高调亮相!该疗法旨在克服免疫治疗的耐药性,通过连接T细胞和肿瘤抗原,增强T细胞杀灭肿瘤细胞的能力。

这项研究对于癌症的免疫治疗具有重要的借鉴意义,其结果表明,类似于嵌合抗原受体(CAR)T细胞疗法,PD-1阻断联合靶向CD28双特异性抗体可以产生强效、持久的抗肿瘤活性,且耐受良好,无需制备,能够针对多种常见癌症,对于改善癌症的免疫治疗效果拥有巨大的潜力。
我们知道,T细胞活化过程受两条关键信号调控:信号1—T细胞活化的触发,即T细胞受体/CD3复合物(TCR/CD3) 在由抗原呈递细胞(APC)、病毒感染细胞或肿瘤细胞表达的主要组织相容性复合物(MHC)的背景下与特定肽结合时发生活化。信号2—共刺激受体激活导致T细胞活化的增强;与之对应,当共抑制受体(免疫检查点)激活时,T细胞活化减弱。TCR/CD3复合物聚集在T细胞及其靶细胞的界面,亦称为免疫突触上,突触中聚集着信号分子、细胞因子、颗粒酶,以及共刺激和共抑制受体。
双特异性抗体,顾名思义,具有双重识别能力:它们经过改造后可以驻留在T细胞表面受体上,并与肿瘤细胞本身的表面抗原结合,从而将两种细胞聚集在一起,并激活T细胞杀灭肿瘤的能力。早期的研究中,通过将肿瘤特异性抗原(TSA)与TCR/CD3复合物交联,从而取代并模拟信号1,以触发T细胞激活。将TSA与T细胞上的CD28交联,可以构建一种“共刺激双特异性抗体(双特异性TSAxCD28)”,从而模拟信号2以增强T细胞的活化。
先前的研究表明,尽管TSAxCD28与TSAxCD3具有显著协同作用,但两类双抗联合使用显著增加了表达TSA正常组织损伤的风险。因此,在这项最新研究中,54位科学家另辟蹊径,将PD-1阻断疗法来模拟信号1以触发T细胞的活化,双特异性TSAxCD28疗法模拟信号2来增强T细胞活化,结果证实这种联合疗法明显增强的肿瘤对抗PD-1治疗的反应--甚至赋予了原先对抗PD-1单药治疗无反应的肿瘤产生反应,并诱导了持久的抗肿瘤免疫,促进了肿瘤内T细胞活化和T细胞记忆,且在动物模型中没有出现全身细胞因子的释放。双特异性TSAxCD28在单独或与抗PD-1抗体联合使用时表现出良好的耐受性。这些数据表明,将这类靶向CD28的双特异性抗体(TSAxCD28)与PD-1阻断疗法相结合,可以提供一种“现成”的生物联合治疗,具有明显增强、特异性、协同和持久的抗肿瘤活性,而不需要额外定制。
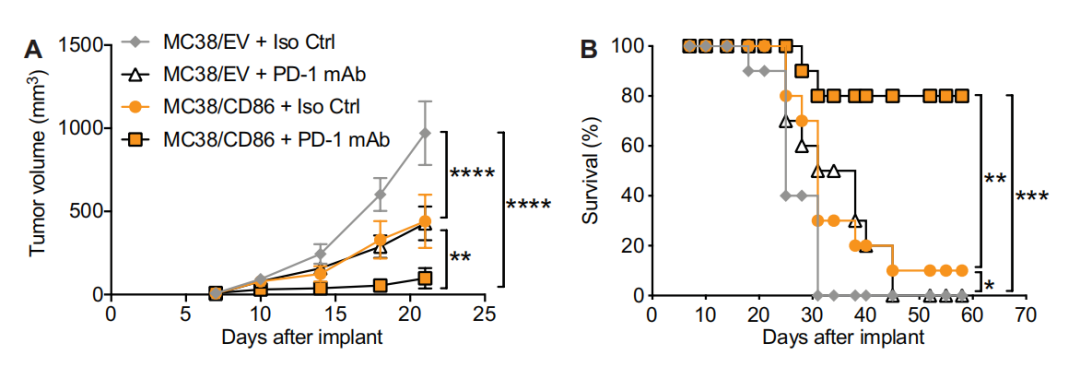
图:CD28配体增强PD-1单抗治疗效果
当前这项研究的人员首先在同基因小鼠模型中证实,PD-1阻断疗法的抗肿瘤作用可以在肿瘤细胞上强制过表达“天然的”CD28配体来增强。然后利用荧光标记的CD20xCD3双特异性抗体模拟肽MHC/TCR结合,并可视化T细胞与形成免疫突触的靶细胞的相互作用,发现PD-L1:PD-1结合可将CD28从免疫突触中排除,从而抑制T细胞的激活,而阻断PD-1则可使CD28在突触中积累,从而使其在靶细胞上遇到配体时更有效地促进T细胞的激活。
研究者接下来生成了一种前列腺特异性抗原(PSMA)的PSMAxCD28双特异性抗体,并在细胞系中证实双特异性PSMAxCD28与PD-1阻断联合诱导的IL-2释放是两者单独使用时的三倍,证实两者具有协同促进T细胞的活化的作用。这种协同不仅仅是T细胞和靶细胞交联增加或更为接近所致,而是因为T细胞表面的CD28受体本身具有较强的抗肿瘤作用,当靶向激动该受体时促进了更多的T细胞活化和多种细胞因子的产生,从而促进强大的免疫反应。在同基因动物模型中,同样看到了联合治疗荷瘤小鼠的存活率较任一单药增加了2.5倍以上。不仅如此,CD28双特异性抗体可以通过促进内源性TCR/CD3依赖的T细胞反应而增强PD-1mAB的抗肿瘤作用,这同时也会导致长期的免疫记忆的形成,因此这样的组合可以驱动持久的抗肿瘤反应。当生成EGFRxCD28双特异性抗体时,结果与上述一致:EGFRxCD28双特异性抗体与PD-1mAb联合产生了强效而持久的抗肿瘤免疫反应。
为了比较CD28超激动剂与TSAxCD28双特异性抗体单药或与PD-1mAB联合应用的耐受性,研究者对犬只猴子和转基因人源化小鼠进行了探索性研究表明,与CD28超激动剂相比,无论是双特异性PSMAxCD28 还是EGFRxCD28 ,还是与PD-1mAb联合,都不会产生任何显著的细胞因子释放、T细胞增殖或T细胞活化。这些结果表明,与直接激活免疫系统的CD28 超激动剂相比,这些共刺激CD28双特异性抗体在没有信号1的情况下不能孤立地刺激免疫系统,这与体外研究一致。
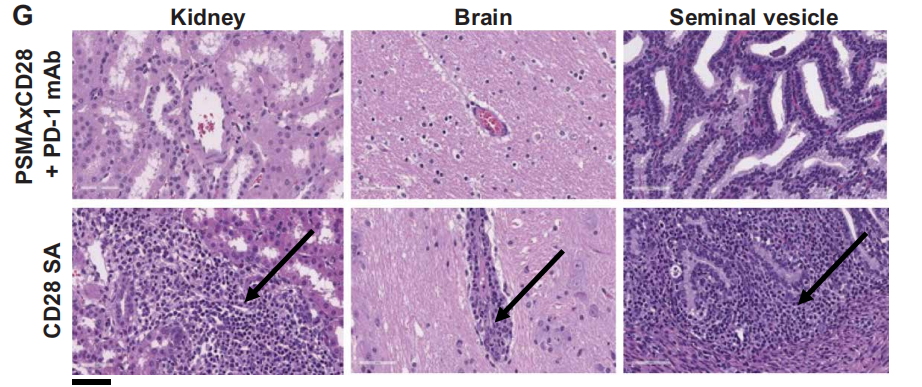
图:PSMAxCD28联合PD-1单抗对比CD28超激动剂
该研究引入了使用TSAxCD28共刺激双特异性抗体来增强肿瘤部位T细胞信号和激活的概念,利用两种不同的肿瘤靶点(PSMA和EGFR)验证了联合CD28共刺激双特异性抗体与PD-1mAb的免疫疗法不仅能产生较强的T细胞活化,而且能提供持久的抗肿瘤反应,而不产生脱靶毒性。同时,由于结合了肿瘤相关抗原,使得这一双特异性抗体具有肿瘤靶向性,可以使更多的肿瘤相关T细胞激活和并避免正常器官毒性。特别是,使用CD28双特异性抗体不直接激活CD28(除非聚集在肿瘤细胞表面),仅在肿瘤部位可能促进T细胞共刺激,避免了CD28激活抗体的全身毒性。
将基于CD28的双特异性与临床验证的PD-1mabs结合,是耐受性好、现成的、强效且持久抗肿瘤活性的一种组合。这一新的免疫疗法组合是稳健的,不限瘤种,具有广泛应用前景的新的免疫治疗,让我们拭目以待!
责任编辑:Nathan
排版编辑:Nathan
参考文献
Janelle C. Waite, Bei Wang, Lauric Haber, et al. Tumor-targeted CD28 bispecific antibodies enhance the antitumor efficacy of PD-1 immunotherapy. [J]. Science 转录 Medicine, 2020.
转自:良医汇-肿瘤医生APP