胰腺导管腺癌(PDAC)的多学科诊疗标准及相关进展(上)
由于确诊时分期晚和系统治疗的疗效欠佳,胰腺导管腺癌(PDAC)的预后仍较差。然而,多学科诊疗模式使得局限期PDAC接受手术治疗后可获得较好的总体生存率、局部控制率和无转移生存期。针对肿瘤特异性分子靶向药物治疗可改善晚期转移性患者的疾病控制率。波兰的学者对PDAC的MDT诊疗模式及相关进展作了系统的综述,具有临床指导意义,这篇综述于近日重磅发表在CA: A Cancer Journal for Clinicians上。

流行病学
胰腺癌是所有常见恶性实体瘤中预后最差的,5年总生存率约为10%。据估计,到2020年美国将有57,600人被诊断为胰腺癌,47,050人将死于胰腺癌,成为第三大癌症死亡原因。胰腺癌诊断的平均年龄是70,2013年至2017年间胰腺癌的男性发病率高于女性(14.9例和11.6例/10万人/年),死亡率也高于女性(12.7例和9.6例/10万人/年)。在过去的10年中,发病率和死亡率年平均增长为0.3%,这些趋势是人口老龄化、预期寿命延长以及肥胖和糖尿病的发病率升高的综合作用结果。
大约95%的胰腺癌是外分泌细胞肿瘤,最常见的是胰腺导管腺癌(PDAC)。PDAC的高死亡率对临床医生提出了4个重要挑战。首先,胰腺位于上腹部深处胃的后方及主动脉及其上腹部主要分支之间,导致进展中的肿瘤不易被发现,肿通常生长在血管周围并包绕这些血管导致仅有15%到20%的肿瘤可以接受手术切除。第二,PDAC表现出早期转移的侵袭性生物学特征,超过50%的患者确诊时表现已出现远处转移,大多数接受切除手术的患者也会在术后4年内发生转移,这表明在有局限期患者体内已存在微转移灶。第三,PDAC的生理作用会极大地降低病人的体能状态,限制高强度治疗耐受性。确诊时高达80%的患者存在恶病质,这可因胰腺外分泌和内分泌功能障碍进一步恶化。最后,PDAC对多种抗肿瘤治疗表现出耐药性,即使给予有效的全身药物治疗和放疗,仍会迅速进展,且病理学完全应答率低。实际上仅有不到3%的转移性疾病患者存活时间超过5年,而这一指趾在局限性 I A 期患者中上升到70%以上。由此得出PDAC的生存预后不良因素:T分期晚,高组织学分级,淋巴结转移或远处转移,切除后有无肉眼或显微镜下的残留病变,侵及主要血管及体能状态差。
临床表现
尽管大多数PDAC患者确诊时已有临床症状,但通常是非特异性的,这导致了出现临床症状和确诊的时间有大于2个月的延迟。最常见的主诉症状是疲劳(86%),体重减轻(85%),厌食症(83%),黄疸(56%),恶心(51%)、腹痛(79%)、腹泻(44%)、瘙痒(32%)和高脂血症(25%)。包括黄疸(55%)、肝肿大(29%)、恶病质(13%)、上腹肿块(9%)或腹水(5%)在内的23种PDAC的体征要少见得多。由于没有特异性的诊断原则,使得基础保健医生和一线医生很难制定完善的相关检查方案。在新确诊的糖尿病、有PDAC家族病史、复发性或慢性胰腺炎病史的下出现上述任何症状,都应引起临床医生考虑确诊为PDAC的可能性。最近的证据显示,PDAC相关代谢紊乱导致的骨骼肌和脂肪消耗,是肿瘤存在的早期证据。
危险因素和早期筛查
尽管PDAC总体预后不良,但来自美国国家癌症研究所和SEER的数据强调了早期检查对预后的影响。分析2010年至2016年SEER数据显示,虽然只有2.9%的远处转移PDAC患者生存≥5年,但是大约有39.4%的局限性患者仍可获得5年生存期。经内镜超声诊断肿块小于1cm的PDAC患者5年生存率更高(CT可检测肿块或无阻塞症状患者达到约70%),然而,最近美国的一项对PDAC高危个体长期随访的研究结果表明,切除进展期肿瘤前病变是治愈的关键。这些发现再次强调了PDAC早期筛查的重要性,即使在原位癌(胰腺上皮内瘤变-3 [PanIN-3])阶段也可能如此。
但是 最近美国USPSTF组织强调不推荐一般人群进行PDAC的长期筛查并得出了中高度确定性的结论, 该筛查没有获益或者弊大于利,因此被评为“D”级不予推荐。一方面,考虑到上述关于PDAC的早期筛查对分期特异性生存率的影响,USPSTF的建议似乎是有悖于此。另一方面,反对一般人群进行PDAC筛查有意义的证据是,PDAC的发病率约为13/10万,仍相对少见。相比之下,USPSTF推荐普通人群筛查的乳腺癌和结直肠癌的发病率分别约为69/10万和38/10万。换言之,即使是敏感性为100%,特异性为99%的“完美”PDAC生物标志物将会得到接近1%阳性预测价值,必将导致大量不必要的影像学检查或其他潜在有害性检查,大大增加了卫生保健费用和患其他疾病风险。为了规避此缺点,USPSTF已经从其筛选报告中排除了PDAC高风险人群的筛查。
约10%的PDAC的易感癌基因存在致病性胚系突变,其中BRCA2和ATM是2个最常见的基因位点,其次是BRCA1、PALB2、CDKN2A/p16和LKB1/STK11;错配修复基因(hMLH1、hMSH2、hPMS6);以及其他更少见的变体(表1)。值得注意的是,只有一半的患者为致病突变,根据ASCO和NCCN最近更新的指南建议, 所有诊断为PDAC的患者均应接受胚系突变监测(而不是限于怀疑有家庭史者),这增加了BRCA1/BRCA2突变病人可能从PARP抑制剂治疗中的获益。突变阳性患者的一级亲属应对易感致病性突变基因进行检测,价格昂贵的血液和唾液的多基因芯片可极大简化了上述检测过程。无症状的胚系突变携带者表明存在大量潜在患病的高危人群,事实上,此类人群已被USPSTF指南明确纳入一般风险人群筛查。尽管最近国际联盟提出了可在学术研究范围内达成共识的总体指导意见,但目前对于胚系突变携带者的长期监测方式仍未达成广泛共识,其中也包括适用于此人群中最佳影像学检查方式。然而,来自2个最大家族性PDAC的回顾性数据显示了长期监测对预后的影响,大多数(75%-90%)癌症病例在可切除阶段得到确诊,可转化为大于3年的疾病特异性生存率。
表1:胰腺癌易感基因
第2类高危人群为胰腺囊肿的患者,也可从早期筛查中受益。胰腺囊肿分为炎性囊肿(包括胰腺假性囊肿)和非炎性囊肿(包括粘液性和非粘液性病变)。胰腺的粘液性囊肿包括导管内乳头状粘液瘤和粘液囊性肿瘤,都认为是PDAC的前体病变,是最常见的(约90%)与侵袭性腺癌相关的前体亚型,CT或MRI检查可确定肉眼可见的囊性前体而被用于癌症进展的长期筛查。值得注意的是,对影像学数据的回顾性研究表明一般人群中有2%到3%的人可能有无症状的胰腺囊肿,而在老年人中这个指趾增加到大于10倍。鉴于每年仅有不超过5%-10%的PDAC发生于囊性病变,无症状胰腺囊肿大多数本质上是良性病变,可定期观察。数据显示,无侵入性囊性病变通常可以通过手术切除治愈,而侵入性囊性病变的患者5年生存率下降50%以上,这提示了胰腺囊肿患者早期筛查的重要性。因此,鉴别已经进展到高级别上皮内瘤变或PDAC的粘液性囊肿患者至关重要。但基于SEER的数据,MRI偶然发现的囊肿有17/10万的可能是PDAC,这表明需要非常大的评估基数来预防1例非预期PDAC死亡,因此关于胰腺囊肿筛查的建议在很大程度上过于夸大其词,而且提出这些建议的证据来自证据级别低的病例系统性和回顾性报告。最近,内镜下抽吸的胰腺囊肿液组织可用于粘液囊肿的分子生物标志物以及癌症的进展的检测,已在临床领域得到应用并获得优于临床影像学检查。
第3类高危人群是慢性胰腺炎患者,最常继发于慢性酒精依赖、吸烟、高甘油三酯血症、糖尿病或肾功能衰竭。大约5%的持续20年的慢性胰腺炎患者将进展为PDAC,其中吸烟者的风险增加。根据USPSTF筛查指南,散发性慢性胰腺炎患者目前不建议进行PDAC筛查,但USPSTF建议PRSS1基因胚系突变导致的遗传性胰腺炎患者应纳入筛查范围内,该患者患PDAC的风险要高出大约50倍,再次证明了炎症和癌症之间的密切联系。
尽管每年PDAC的确诊患者有上述危险因的占比约为15% - 20%,但大多数仍属于散发性病例(表2)。对于无囊肿或家族史等临床危险因素的个体,我们如何做到早发现胰腺癌?吸烟和不健康的体重指数都会略微(大约1.5到2倍)增加患病风险,我们可以采取戒烟以及保持健康体重指数的公卫干预措施。应用全基因组关联性的研究表明,与对照组相比,病例组存在数千种基因组多态性,可明确鉴定出PDAC的多重易感性等位基因,如ABO血型基因和编码端粒酶逆转录酶(TERT)的等位基因。与上述致病性胚系突变(BRCA1/BRCA2、ATM等)相比,等位基因变异对终生患病风险的影响非常有限,但累积风险不可估量。将易感等位基因信息纳入多基因风险评估中,可以识别出高达1/4有终生患病风险的个体,并纳入长期筛查中。在过去的几十年间,在所有患者中有一半以上的无症状PDAC临床表现为新的高血糖或糖尿病。葡萄糖稳态失衡可能是PDAC引起的副肿瘤综合征,且早于临床诊断36个月就开始出现,并伴有皮下脂肪组织的改变。早期PDAC的液体活检方法包括抗原和microRNA在内的循环因子可用于区分早期PDAC患者和健康及良性胰腺肿瘤。此外,最近的数据已证实肠道和胰腺微生物改变直接促进胰腺肿瘤的形成和发展,提示粪便中肠道菌群成分的改变也可能有助于PDAC的诊断。未来癌症干预措施的模式将会是基于多基因风险评估、家族史、吸烟史、体重指数的PDAC高风险人群的鉴别、干预以及预期利大于弊的筛查方案。
表2:胰腺癌风险因素
诊断
实验室检查
PDAC的诊断仅有临床症状和体征无法确诊,临床表现为黄疸或上腹痛的患者应进行血细胞计数、血液化学和肝功能检查,包括血清转氨酶、碱性磷酸酶和胆红素,以评估胆红素血症(胆红素)、肝转移(碱性磷酸酶)、肝炎(氨基转移酶)和营养状况(白蛋白、前白蛋白)。对于上腹痛患者,还应测量血清脂肪酶,以评估急性胰腺炎。肿瘤标志物CA19-9(属于Lewis抗原)常用于PDAC的诊断。在有症状患者中,CA19-9的敏感性和特异性为70% - 90%,但在无症状患者中,CA19-9升高的阳性预测值仅为0.9%,良性胰胆疾病、PDAC以外的癌症也可导致CA19-9的升高,以及5% - 10%的PDAC不表达Lewis抗原,因此CA19-9不足以作为该人群的确诊指标。最新数据表明,血清CA19-9与MUC5AC或血小板反应蛋白2等其他生物标志物的结合提高了血清检测的特异性,为未来基于血液的检测提供了可能的确诊方法。血清CA19-9水平与肿瘤大小密切相关,其升高程度与预后相关。在一项对局限期患者的研究中,CA19-9在130单位/ml以上预测潜在不可切除,还预测1500例以上可切除患者的生存预后。尽管局限期PDAC和高水平CA19-9的患者通常建议予以腹腔镜分期检查和新辅助治疗,但ASCO指南并没有明确该建议的CA 19-9的cut off值。由于血清CA 19-9的升高可由肿瘤或胆汁扩张引起,因此胆道梗阻患者放置支架后应重新检测CA 19-9以评估真实的肿瘤负荷。连续检测CA 19-9通常用于评估CA 19-9升高的患者对治疗的反应性。术后CA19 -9未达到正常化认为是预后差和潜在转移的表现。同样,系统治疗期间CA 19-9的下降与患者生存延长有关。CA19-9下降到最低点后上升提示治疗失败,这通常出现在影像学出现复发或进展之前。血清CA 19-9的改变并能取代影像学用于治疗反应性或疾病复发的评估。在某些肿瘤中,肿瘤特异性的生物标志物,如CEA或CA125升高,也可用于治疗反应和复发评估,但仅在部分PDAC患者中升高,因此其诊断价值有限。
影像学检查
CT是疑似PDAC的首选影像学检查,由于CT成本较低且应用广泛,因此比MRI更受青睐。CT和MRI检测PDAC的敏感性相当,CT为76-96%,MRI为83-94%。MRI是有CT禁忌症(如严重碘化造影剂过敏或肾功能不全)患者替代影像学检查。对于CT表现不明确的肝脏病变,MRI也可用于鉴别诊断。PET/CT可以发现传统分期检查未发现的胰腺外转移性疾病。虽然不推荐用于常规分期,但对高危的肝外转移患者可考虑PET/CT。EUS的主要作用是通过穿刺活检用于PDAC的确诊。在高度选择的病例,EUS可能有助于发现在CT或MRI上难以观察到的胰腺小肿块,因此是一些早期检测方案的首选影像学检查。
CT 明确肿瘤可切除性的准确性范围从73%到87%, MRI为70%到79%。与MRI相比,CT提供了较高的空间分辨率,不易受呼吸运动影响,这对显示肿瘤与邻近血管之间的关系至关重要。PDAC确诊和分期的准确性主要依赖于合适的影像学方案、后处理技术和放射科医生的经验。
经“Society of Abdominal Radiology”和“American Pancreatic Association”认可的胰腺癌CT检查方案为:造影剂(>300mg /ml iodine)以3-5ml/秒的速度静注对比扫描获得胰腺实质期(40–50s)和门静脉期(65–70s)的CT检查。采用多平面重建方式将薄层扫描数据重建成0.75mm至3mm的轴向切片,三维(3D)重建以充分评估血管受累情况。电影渲染是一种最新的3D渲染技术,它可以提供接近真实病灶的细节,并有望提高肿瘤与血管关系的可视化成像技术(图1和图2)
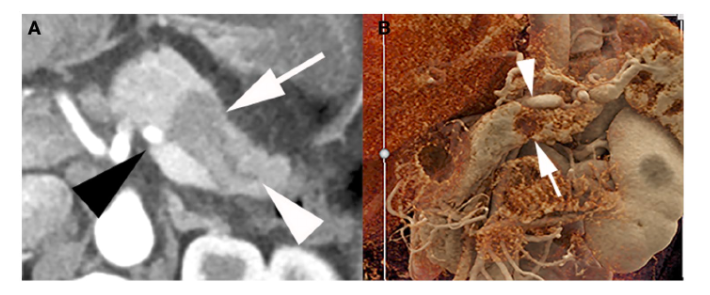
图1:1例44岁女性可切除PDAC影像学资料
分期
美国癌症联合委员会(AJCC)根据TNM分期系统对PDAC分期。第8版AJCC手册修订了早期版本中T和N分期。T分期主要是基于肿瘤大小,T4定义为动脉受累,不论肿瘤大小。根据无淋巴结受累(N0)和区域淋巴结受累数量(N1为1-3个,N2为≥4个)进一步划分了N分期,而不仅仅是单纯的受累淋巴结无(N0)或有(N1)。AJCC系统的主要目的是提供预后信息,而不是治疗指南。
表3:NCCN指南对PDAC可切除性定义

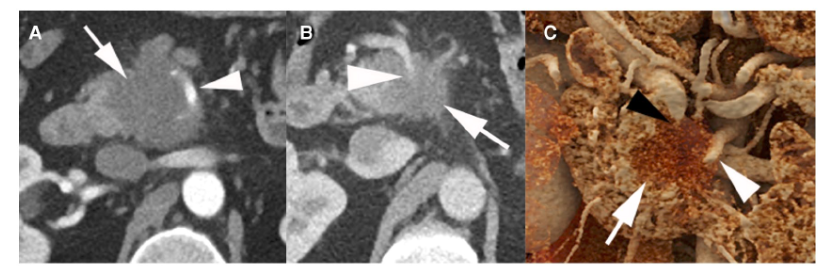
图2:1例50岁男性局部晚期PDAC影像学资料
NCCN指南根据局限性PDAC的术前影像学表现的可切除性分为可切除、临界可切除和局部晚期病变(表3)。肿瘤侵犯动脉未超过周径的180度被认为临界可切除,而超过180度通常被认为局部进展(除了下述的例外)(图2)。肿瘤与静脉临近、包绕静脉或血栓形成,但静脉段可重建,均为临界可切除。不可重建的静脉受累认为是局部进展。NCCN指南与其他指南有许多相同建议,除了肿瘤腹主动脉包绕(>180度)的情况例外(表4)。胰体或胰尾肿瘤伴腹腔动脉包绕,但未累及主动脉或胃十二指肠动脉为临界可切除,采用改良Appleby手术(图3)。然而,在其他指南中,存在腹腔动脉包绕被认为是不可切除的。
表4:可切除性标准比较
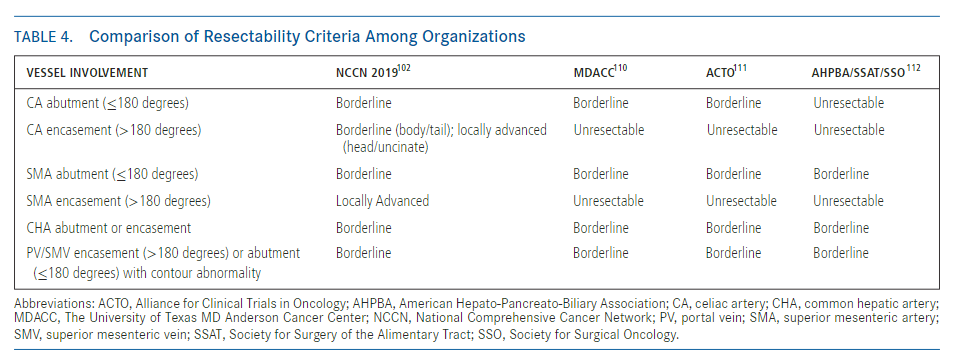
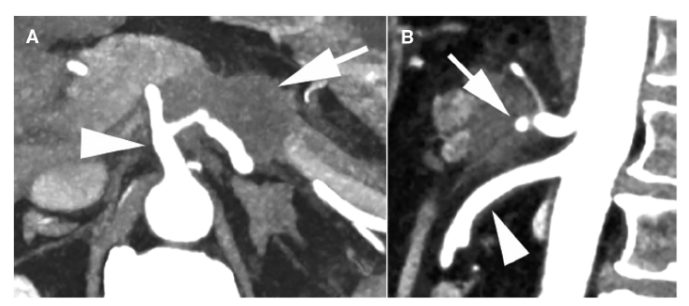
图3:改良Appleby手术
转移性PDAC的MDT规范
一线治疗
转移性PDAC在临床上最常见,吉西他滨曾是转移性PDCA一线治疗的标准方案,与5-氟尿嘧啶(5-FU)相比,中位OS延长5.65个月。2011年III期临床试验 PRODIGE 4/ACCORD 11证实,与接受吉西他滨作为转移性PDAC一线治疗的患者相比,接受FOLFIRINOX(5-FU, 亚叶酸钙,伊立替康和奥沙利铂)的中位OS和中位无进展生存(PFS)显著改善(中位OS: 11.1个月vs. 6.8个月,HR 0.57,P <0.001);中位PFS: 6.4个月vs. 3.3个月,HR 0.47,P<0.001)。FOLFIRINOX是体能状态好患者的标准一线治疗方案。另一种一线治疗方案是吉西他滨联白蛋白结合型紫杉醇,III期MPACT试验证实其与吉西他滨单药治疗转移性PDAC,中位OS(HR 0.72,P<0.01)和中位PFS均获得1.8个月的延长(HR, 0.69,P<0.01)。转移性PDAC患者既能耐受化疗,又能从高强度联合化疗中获益,但由于缺乏上述方案的头对头比较研究,许多临床医生根据病人的体能状态和耐受性来制定方案,而FOLFIRINOX方案认为是耐受性欠佳,但可能更有效的方案。
增加新的细胞毒性药物的联合方案是目前优化治疗策略的方式。一项以吉西他滨、白蛋白结合型紫杉醇和顺铂联合化疗作为一线治疗方案的Ib/II期研究,证实了该方案的安全性并提供了可能临床获益的早期证据(PFS为10.1个月)。虽然此结果表明增加了铂类的联合化疗方案的疗效,但在缺乏III期数据的情况下应谨慎解释。
二线治疗
二线治疗主要包括替代一线用药的氟尿嘧啶类的其他双药联合方案。根据MPACT研究结果,接受FOLFIRINOX一线治疗的患者,二线治疗可选择吉西他滨联合白蛋白结合型紫杉醇。而接受吉西他滨联合白蛋白结合型紫杉醇一线治疗的患者,二线治疗可选择FOLFIRINOX、FOLFOX或5-FU +纳米脂质体伊立替康方案。其他方案适用于体能状态差或因限制剂量毒性而无法耐受FOLFIRINOX方案。FOLFOX已在多个临床试验中评估,中位PFS约为3.5个月。然而,随机III期PANCREOX研究,对比了二线FOLFOX与5-FU/亚叶酸钙方案,两者PFS相似,但FOLFOX的OS和毒性反应比5-FU/亚叶酸钙更差,此结果对奥沙利铂加入联合治疗方案的获益性存疑。随机III期NAPOLI-1试验对比了纳米脂质体伊立替康单药或者联合5-Fu和5-FU/亚叶酸钙治疗转移性胰腺癌,结果显示纳米脂质体伊立替康组可改善OS达6.1个月,对比5-FU/CF组的4.2个月(HR 0.67;P = 0.012)。
维持治疗
多程化疗的患者势必长期暴露于化疗相关毒性,PANOPTIMOX- PRODIGE 35的II期临床试验中,FOLFIRINOX后5-FU维持治疗或序贯吉西他滨和FOLFIRI 3方案对比连续给予FOLFIRINOX方案直到疾病进展,与连续给予FOLFIRINOX方案相比,序贯吉西他滨和FOLFIRI 3方案疗效欠佳。接受FOLFIRINOX治疗的患者被随机分配到连续治疗6个月或4个月,5-FU维持治疗至疾病进展时再次给予FOLFIRINOX方案,研究的主要终点是6个月的PFS,FOLFIRINOX方案治疗同样的取得6个月PFS和OS。接受5-FU维持治疗的3级和4级神经毒性增加,这可能由奥沙利铂累积剂量的增加导致的。来自德国的单中心回顾性研究显示接受4个月的FOLFIRINOX方案后,给予FOLFIRI维持治疗获得了11个月的PFS。以上研究均证明维持治疗的疗效不差于持续治疗至疾病进展,具有临床可行性。
POLO III期临床研究表明靶向药物维持治疗在生物标记物高度选择PDAC中的疗效。BRCA1或BRCA2突变的转移性PDAC患者一线含铂方案化疗中未进展,随机接受PARP抑制剂奥拉帕利或安慰剂维持治疗,结果表明奥拉帕利维持治疗的中位PFS为7.4个月,对比安慰剂组为3.8个月(HR 0.53),但未改善中位OS。尽管这是首个支持小分子靶向药物治疗PDAC的试验,但由于入组人数少且以非标准治疗作为对照组,因此该研究的临床意义有限。然而,POLO研究结果促使美国FDA批准奥拉帕利用于BRCA胚系突变的PDAC的维持治疗。
责任编辑:Nathan
排版编辑:Nathan
参考文献
Aaron J. Grossberg, Linda C. Chu, Christopher R. Deig, et al. Multidisciplinary Standards of Care and Recent Progress in Pancreatic Ductal Adenocarcinoma. [J] . CA: A Cancer Journal for Clinicians. 2020
转自:良医汇-肿瘤医生APP