国产第二代CDK4/6抑制剂初代数据出炉
4月10日-15日,2021年第112届美国癌症研究协会(AACR)年会虚拟会议线上召开。AACR年会是世界上规模最大最重要的癌症研究会议之一,今年的会议主题为“Discovery Science Driving Clinical Breakthroughs”。
复旦大学附属肿瘤医院胡夕春教授团队联合全国多中心开展了“FCN-437c在中国女性ER+/HER2-晚期乳腺癌(ABC)患者中的I期剂量递增和剂量扩展试验”,该试验结果(摘要号:CT117)在大会上进行壁报展示。

图1 壁报
乳腺癌已成为全世界女性中最常见的威胁生命的恶性肿瘤。已经证明CDK4/6在细胞增殖中起着至关重要的作用,尤其在ER阳性乳腺癌中常常失调。迄今为止,美国食品药品监督管理局(FDA)已经批准了三种口服生物利用的CDK4/6抑制剂哌柏西利(palbociclib)、ribociclib和阿贝西利(abemaciclib)单独给药或与芳香化酶抑制剂(aromatase inhibitor,AI)/氟维司群联合给药治疗ER+/HER2-晚期乳腺癌。
该I期临床试验旨在评估第二代CDK4/6抑制剂FCN-437c单独给药治疗未能达到护理标准的晚期乳腺癌患者(1a期)以及与来曲唑联合给药治疗晚期乳腺癌患者(1b期)的安全性、最大耐受剂量(MTD)、药代动力学(PK)曲线和抗肿瘤活性。此壁报仅展示1a期临床试验结果。
试验设计
该临床试验采用常规的3+3剂量递增设计,起始剂量为50 mg,在28天的周期中,持续给药21天,停药7天。从2019年2月13日至2020年4月15日招募了17位患者,剂量水平分别为:50 mg(n=3)、100 mg(n=3)、200 mg(n=3)、300 mg(n=6)和450 mg(n=2)。
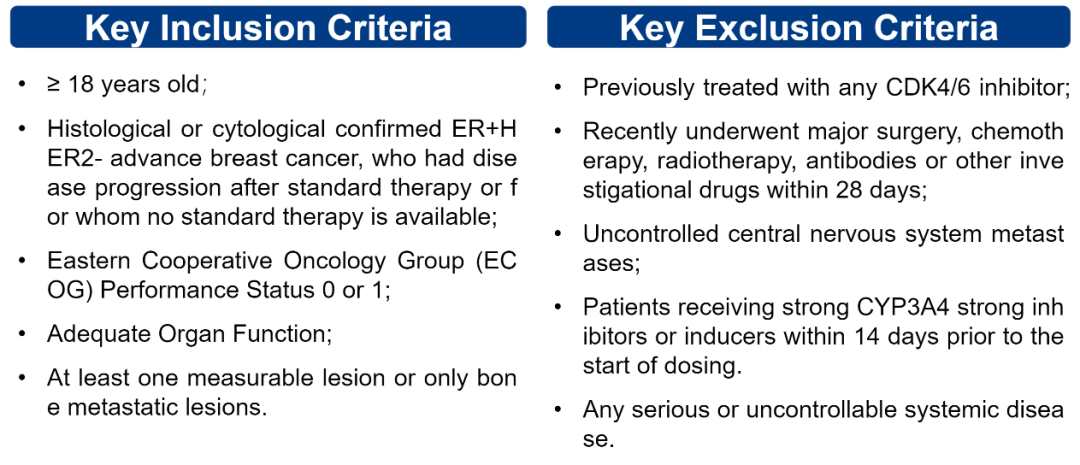
图2 该临床试验的纳入、排除标准
表1 临床试验设计方法

表2 病人基线特征

最大耐受量MTD为300 mg
该临床试验发现,450 mg剂量组中的两名患者分别经历了4级血小板减少症和G4中性粒细胞减少症的剂量限制性毒性(Dose limited toxicity,DLT),在其他剂量水平上均未观察到DLT。因此,MTD为300 mg。
毒性可耐受
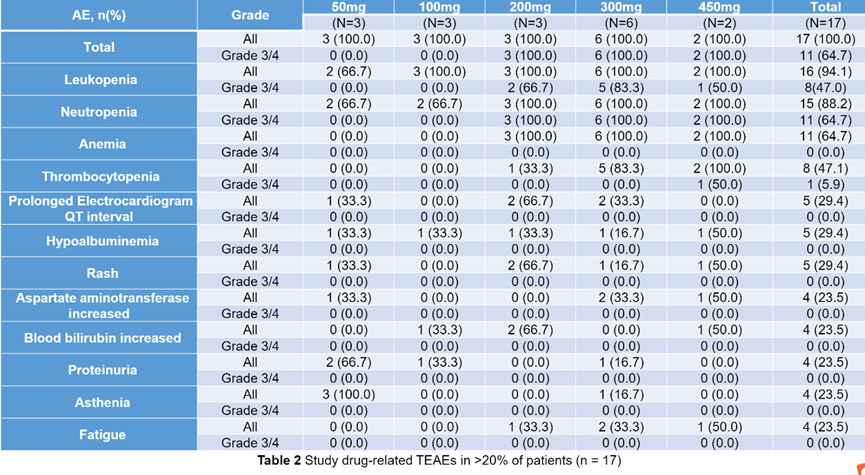
该临床试验主要的不良事件是血液学毒性,报道最多的紧急治疗不良事件TEAEs是白细胞减少症(16/17例,94.1%)、中性粒细胞减少症(15/17例,88.2%)、贫血(11/17例,64.7%)和血小板减少症(8/17例,47.1%)。3-4级主要TEAEs为中性粒细胞减少(11/17例,64.7%)和白细胞减少(8/17例,47.1%)。
表3 不良事件
良好的药代动力学特性
该临床试验的药代动力学结果显示,剂量在50 mg至200 mg间时,暴露量(Cmax、AUC0-∞、AUC0-24、Cav-ss24h)与剂量成正相关,并呈线性关系;剂量在200 mg至450 mg间时,暴露量呈饱和的趋势。
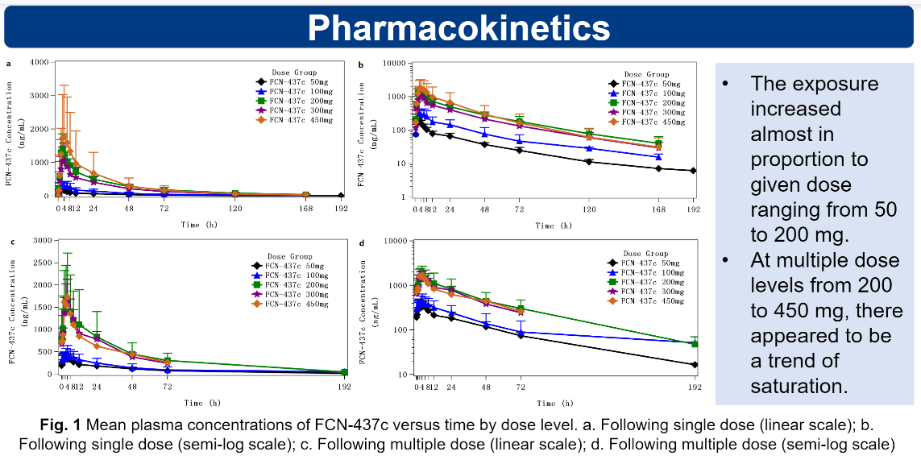
图3 药代动力学
根据对安全性和药代动力学结果的综合评估,确定200 mg为Ⅱ期临床试验的推荐剂量。
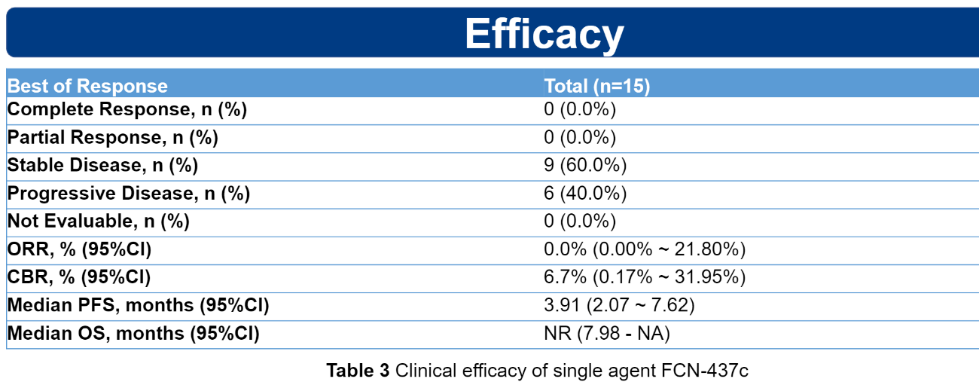
抗肿瘤活性
在15例可评估反应的患者中,有9例(60.0%)患者病情稳定,且病情控制期长。由于随访时间短,无进展生存期(PFS)和总生存期(OS)尚不成熟,无法报告。
表4 单独服用FCN-437c的临床疗效
总之,该I期临床试验发现按21d给药/7d停药口服单一药物FCN-437c的安全性良好,并且毒性通常是可以接受和控制的;最大耐受剂量为300 mg;Ⅱ期临床试验的推荐剂量为200 mg;60%患者病情稳定,且病情控制期长。
FCN-437c与来曲唑或氟维司群联合治疗女性晚期/转移性ER+/HER2-乳腺癌患者的Ⅱ期临床试验目前正在进行。
参考文献:
https://www.abstractsonline.com/pp8/#!/9325/presentation/5188