ARHGAP4通过调控HK2表达促进肝癌细胞生长的研究
ARHGAP4通过调控HK2表达促进肝癌细胞生长的研究
欧阳晓春,邹叶青,李玉梅,丁小兵
1.中国人民解放军联勤保障部队第908医院神经内科,江西 南昌 330006;
2.南昌大学第二附属医院江西省重点分子实验室,江西 南昌 330006;
3.井冈山大学医学部,江西 吉安 343000
原发性肝癌(hepatocellular carcinoma,HCC)是世界上较为常见的肿瘤之一,在中国,其发病率一直居高不下[1-2]。尽管近年来医学临床检验技术及HCC治疗方法取得了巨大进展,然而HCC患者的5年生存率却一直徘徊不前,很多根治性HCC切除术后复发率依旧很高[3],究其原因主要是HCC细胞生长迅速,易发生转移[4],因此,探索HCC细胞生长迅速的机制对于HCC的治疗尤为重要。
Rho GTP酶活化蛋白4(Rho GTPase activating protein 4,ARHGAP4)属于Rho家族蛋白的负调节因子,它可以水解将GTP纳入非活跃GDP并进行负调控[5]。有研究[6]报道,ARHGAP4通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和低氧诱导因子-1&α;(hypoxia inducible factor-1&α;,HIF-1&α;)信号通路调节胰腺癌代谢并进一步促进胰腺癌的生长,另外有研究[7-9]也证实了ARHGAP4在头部和颈部鳞状细胞癌、胶质母细胞瘤、乳腺癌、肺癌、结肠癌和前列腺癌的表达情况,然而在HCC细胞中ARHGAP4的表达及其是否影响HCC生长的情况并不清楚。
糖代谢异常是肿瘤细胞的一个重要特征,赋予肿瘤特异增殖和迁移的能力,糖酵解为细胞提供充足的能量,可显著增强肿瘤细胞对缺血及缺氧的耐受性,能够避免由于氧化磷酸化受抑制而导致细胞的凋亡[10-11]。有研究[12-14]证实,肿瘤细胞中糖酵解增强与糖酵解限速酶活性增强有关,己糖激酶2(hexokinase 2,HK2)作为糖酵解过程中的限速酶,在肿瘤的生长过程中发挥着重要作用,HK2在结肠癌、膀胱癌和多形性胶质母细胞瘤中的表达量均明显升高,且与肿瘤的恶性程度成正比,同时过表达HK2能明显促进肿瘤细胞的增殖、耐药和体内肿瘤的生长。虽然目前已有研究证实了HCC组织中HK2的表达升高[15],但其机制仍有待进一步研究。因此,本研究旨在探讨ARHGAP4及HK2在HCC组织中的表达及对HCC细胞生长的影响并进一步了解两者间的相互作用关系。
1
材料和方法
1.1 主要试剂
胎牛血清(fetal bovine serum,FBS)及DMEM培养基购自美国Gibco公司,胰蛋白酶酶、磷酸盐缓冲液(phosphate-buffered saline,PBS)、青霉素-链霉素(双抗)均购自美国BI公司,RIPA裂解液、二喹啉甲酸(bicinchoninic acid disodium,BCA)及蛋白抽提试剂框均购自上海碧云天生物技术有限公司,ECL发光试剂购自北京全式金生物技术有限公司,凋亡试剂框购自美国BD公司,ARHGAP4、HK2、GAPDH等主要抗体购自英国Abcam公司,LipofectamineTM3000购自美国Thermo Fisher公司,细胞培养所需耗材购自美国Next公司。
1.2 细胞培养及转染
HCC细胞系MHCC97H、HCCLM3均购自中国科学院典型培养物保藏委员会细胞库,所有细胞均置于含有10%FBS的完全培养基中,隔天换液,待细胞生长至80%~90%时给予1∶3传代,培养条件为:37 ℃、CO2体积分数为5%及湿度约为95%的细胞培养箱。
取对数生长的HCC细胞,将细胞以1×106接种于6孔培养板中,待细胞生长至60%~70%时予以无血清的培养基每孔2 mL,以每孔7.5 μL LipofectamineTM3000及shRNA加入含2 mL无血清的培养皿中,于6 h后更换成含有10%FBS的完全培养基,继续于细胞培养箱中培养,24~36 h后提取细胞RNA,48~72 h后提取细胞总蛋白。
1.3 组织标本
经南昌大学医学伦理审查委员会批准,并经过全部患者知情同意后,收集了南昌大学第二附属医院及中国人民解放军联勤保障部队第908医院的62例经HCC切除术标本及其癌旁组织,每例标本都经病理学检查确诊为HCC标本及癌旁组织。
1.4 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
采用TRIzol法提取细胞及组织RNA,通过紫外分光光度计检测各组的RNA浓度,按照宝生物工程(大连)有限公司的反转录试剂框说明要求进行反转录制备cDNA,并进一步进行RTFQ-PCR,每个样品至少设置3个复孔,测定其Ct值并进行计算。
1.5 蛋白质印迹法(Western blot)
收集细胞及组织蛋白质,经RIPA裂解液及蛋白质抽提试剂框分别提取细胞及肿瘤组织总蛋白,经BCA定量后将蛋白质样品于沸水中煮10 min,于10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,孤立的蛋白质条带通过电印迹转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜中,经脱脂牛奶封闭后,与对应的一抗进行杂交温育(4 ℃过夜),并与对应来源性的二抗进行杂交温育(1 h),经ECL发光试剂显影后拍照分析。
1.6 细胞计数试剂框(cell counting kit-8,CCK-8)
取对数生长的HCC细胞MHCC97H及HCC-LM3细胞,经胰蛋白酶消化计数后,接种1×104个细胞于96孔板中,给予对应的处理24 h后,每孔加入CCK-8试剂10 μL,于细胞培养箱中培养2 h,最后置于酶标仪于450 nm波长处测量其吸光度(D)值并分析。
1.7 EdU
细胞处理方法同上,每孔加入100 μL EdU培养基于细胞培养箱中继续培养2 h,随后加入100 μL 4%多聚甲醛溶液固定30 min,每孔加入100 μL甘氨酸,加入100 μL Apollo和100 μL 0.5%Triton-X,100 μL PBS洗两遍,100 μL Hoechst33342避光、室温下脱色摇床30 min,100 μL PBS洗两遍,采用荧光显微镜观察细胞增殖情况并拍照记录分析。
1.8 流式细胞术测定细胞凋亡实验
按照shNC、shARHGAP4进行分组,经胰蛋白酶消化后收集细胞沉淀,2 mL PBS清洗细胞两遍,根据细胞凋亡试剂框步骤说明,分别加入碘化丙啶(propidium iodide,PI)及异硫氰酸荧光素(fluorescein isothiocyanate,FITC)染料,上流式细胞仪检测。
1.9 统计学处理
所有实验数据均采用SPSS 19.0和GraphPad Prism7数据软件进行分析。当两组比较时,采用t检验分析两组间的差异,采用单因素方差分析比较两组间的差异。P<0.05为差异有统计学意义。
2
结 果
2.1 ARHGAP4在HCC中的表达及其与临床预后的关系
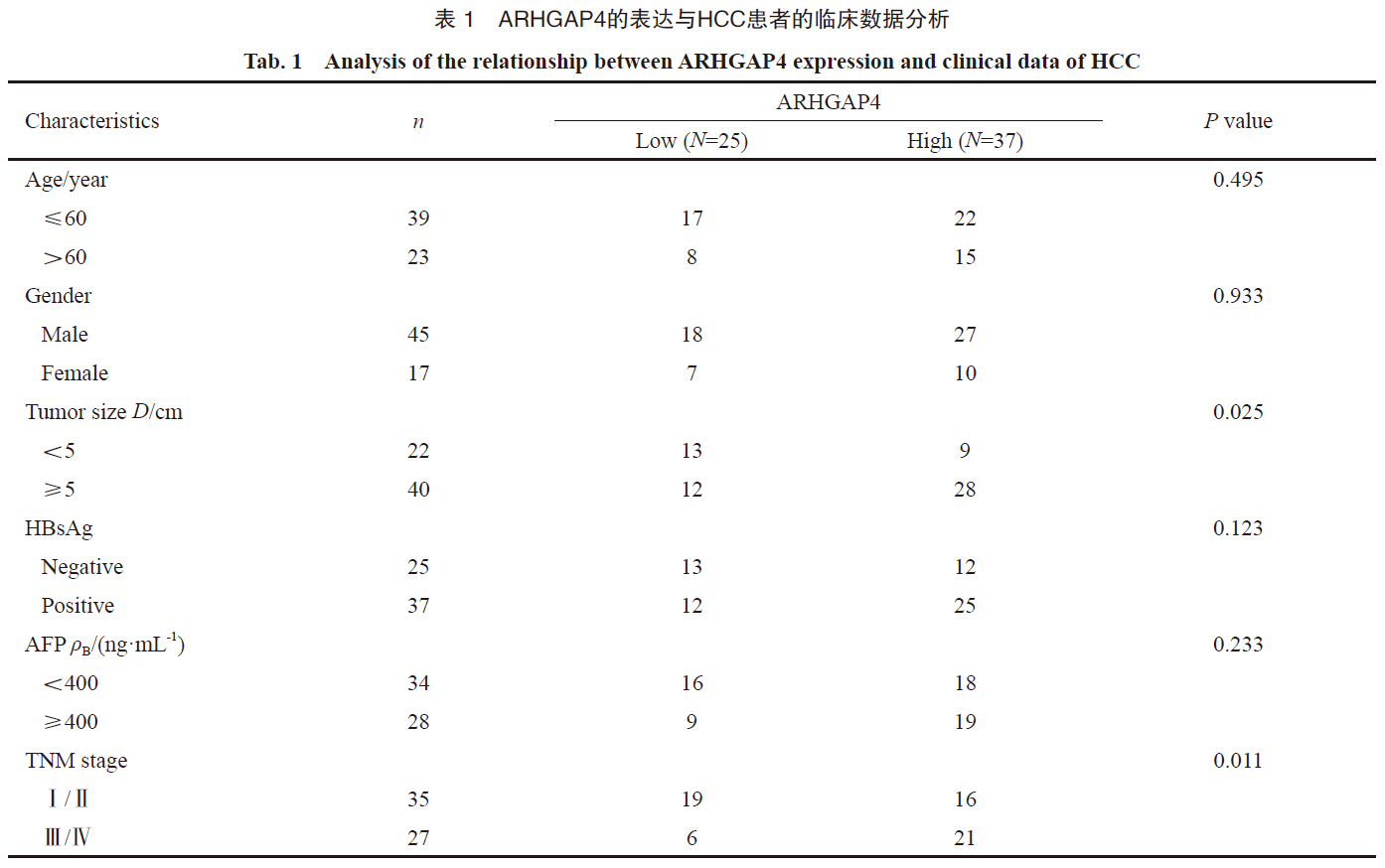
为了检测HCC组织中ARHGAP4的表达情况,我们收集了62例患者HCC组织及其相应的癌旁组织,首先通过RTFQ-PCR分析了HCC组织和癌旁组织中ARHGAP4的mRNA表达,结果显示,HCC组织标本中ARHGAP4的mRNA表达显著提升(P<0.01,图1A),进一步通过Western blot及免疫组织化学法分析了ARHGAP4的蛋白质水平,结果表明,HCC组织标本中ARHGAP4的蛋白质水平显著高于癌旁组织(图1B~C),进一步分析了ARHGAP4的表达与临床病理学特征的关系,结果表明,ARHGAP4高表达与肿瘤大小及TNM分期密切相关(P<0.05,表1),最后通过TCGA数据库分析了ARHGAP4与预后之间的关系,结果表明,高表达ARHGAP4的HCC患者预后差(图1D)。以上结果表明ARHGAP4在HCC组织中高表达且与患者预后密切相关。

图 1 ARHGAP4在HCC中的表达及其与临床预后的关系
Fig. 1 Expression of ARHGAP4 in HCC and its relationship with clinical prognosis
A-B: Quantitative RTFQ-PCR and Western blot were used to analyze the expression level of ARHGAP4 in HCC and adjacent tissues; C: Western blot was used to analyze the expression level of ARHGAP4 in HCC and adjacent tissues; D: The TCGA database was used to analyze the relationship between ARHGAP4 expression and prognosis in HCC. **: P<0.01, compared with each other; T: Tumor; NT: Non-tumor
2.2 抑制HCC细胞中ARHGAP4的表达显著抑制其生长
为了明确ARHGAP4参与HCC细胞的生长调节过程,首先在HCC细胞中沉默ARHGAP4的表达,利用RTFQ-PCR及Western blot证实ARHGAP4下调成功(P<0.01,图2A~B)。然后进行shNC、shARHGAP4分组,利用CCK-8及EdU实验检测了HCC细胞增殖情况。结果显示,沉默HCC细胞中ARHGAP4的表达后,HCC细胞增殖明显减弱(P<0.01,图2C~D)。进一步采用流式细胞术细胞凋亡实验分析下调ARHGAP4后HCC细胞的凋亡情况,结果表明,HCC细胞凋亡比例显著增加(P<0.05,图2E~F)。以上结果表明,沉默ARHGAPE能够显著抑制HCC细胞的生长并促进HCC细胞的凋亡。

图 2 抑制HCC细胞中ARHGAP4的表达显著抑制其生长
Fig. 2 Suppression of ARHGAP4 expression in HCC cells significantly inhibited proliferation of HCC cells
A: RTFQ-PCR detected ARHGAP4 silencing effect; B: Western blot was used to verify ARHGAP4 silencing effect; C: CCK-8 detection after ARHGAP4 down-regulation of cell proliferation; D: EdU cell proliferation was detected after silencing ARHGAP4; E: Flow cytometry was used to detect the apoptotic rate of ARHGAP4 after silencing; F: The expression of apoptosis-related protein 半胱天冬酶-3 was detected by immunoblotting after silencing of ARHGAP4. *: P<0.05, compared with the other group; **: P<0.01, compared with the other group; ***: P<0.001, compared with the other group
2.3 ARHGAP4调控HK2的表达且两者表达呈正相关
首先在HCC细胞中沉默ARHGAP4的表达,结果发现HK2的表达也随之下降,相反过表达ARHGAP4后HK2的表达显著上升(图3A~B,P<0.01)。接下来通过RTFQ-PCR及Western blot证实了HK2在HCC中高表达(图3C~D,P<0.01)。进一步研究发现,ARHGAP4的表达与HK2呈正相关(图3E,P<0.01)。

图 3 ARHGAP4调控HK2的表达且两者表达呈正相关
Fig. 3 ARHGAP4 regulates HK2 expression and expressions of ARHGAP4 and HK2 are positively correlated
A-B: After silencing and overexpressing ARHGAP4, the expression levels of HK2 mRNA and protein in HCC cells were detected by RTFQ-PCR and Western blot; C-D: The expression levels of HK2 in HCC tissues and their adjacent tissues were detected by RTFQ-PCR and Western blot; E: Correlation analysis between ARHGAP4 and HK2 in HCC. **: P<0.01, compared with each other; T: Tumor; NT: Non-tumor
2.4 ARHGAP4调控HCC细胞的生长依赖于HK2的表达
为了进一步明确ARHGAP4调控HCC细胞生长的具体机制,在稳定低表达ARHGAP4的HCC细胞中同时过表达HK2,Western blot结果显示,ARHGAP4表达降低,而HK2表达抑制在过表达HK2后恢复(图4A),同样,HCC细胞的增殖能力同样恢复(图4B)。接下来上调ARHGAP4的表达,HCC的生长能力及HK2的表达显著提升。进一步在过表达ARHGAP4的同时沉默HK2的表达,结果表明,ARHGAP4的蛋白质水平上升,而HK2的表达及HCC细胞生长能力在HK2沉默后被抑制(图4C~D)。以上结果表明,ARHGAP4调控HCC细胞的生长能力依赖于HK2的表达。

图 4 ARHGAP4调控HCC细胞的生长依赖于HK2的表达
Fig. 4 ARHGAP4 regulates the growth of HCC cells via HK2 expression
A: Western blot analysis of the expressions of ARHGAP4 and HK2 in HCC cells. Overexpression of HK2 could restore the inhibition of HK2 by shARHGAP4. B: EdU results showed that overexpression of HK2 could restore the inhibition of proliferation of shARHGAP4 by HCC. C: Western blot analysis of the expressions of ARHGAP4 and HK2 in HCC cells. Silencing HK2 could inhibit the up-regulation of p-ARHGAP4 HCC cells on HK2. D: EdU results confirmed that silencing HK2 could inhibit p-ARHGAP4 to promote the growth of HCC cells. *: P<0.05, compared with the other group; **:P<0.01, compared with the other group
3
讨 论
HCC严重影响人类健康,许多研究者密切关注HCC的发生、发展,目前普遍认为细胞的恶性生长是癌症的必要环节[16]。越来越多的证据表明,HCC细胞的增殖和凋亡与原癌基因和抑癌基因异常表达密切相关[17]。Rho GTP酶活化蛋白基因与肿瘤的发生、发展相关,其中以ARHGAP4尤为重要,目前有研究[18]证实,ARHGAP4在胰腺癌等多种肿瘤中高表达,沉默肿瘤细胞中ARHGAP4的表达后显著抑制肿瘤细胞的增殖能力并诱导细胞周期阻滞,进而促进肿瘤细胞凋亡。另外有研究[18]也报道了ARHGAP4的表达与胰腺癌细胞的糖酵解水平相关。然而在HCC中尚未见报道,本研究检测了ARHGAP4在HCC组织中的表达,并探讨了ARHGAP4的表达与HCC细胞生长的关系。
糖酵解作为肿瘤细胞中大部分的能量来源,已经有越来越多的研究[19-21]证实在不同的肿瘤细胞中存在着糖酵解增强的现象。Lee等[19]研究发现,在HCC中糖酵解增强,且主要与其关键酶HK2的活化相关。Wang等[20]也发现,在膀胱癌中同样存在着HK2高表达,并发现HK2作为孤立影响因子影响着膀胱癌的进展。Lv等[21]研究发现,在肺癌的组织标本中同样存在着HK2表达升高,并且显著影响其生长与转移。本研究数据表明,HK2在HCC组织中高表达,降低HCC细胞中ARHGAP4的表达后HK2表达被抑制,且两者呈正相关。总之,这些数据表明,ARHGAP4可能作为致癌基因发挥重要作用,并可能在HCC的发生、发展中发挥重要作用。虽然本研究观察了ARHGAP4对HCC生长的影响,但并未揭示其调控增殖的具体机制。
综上所述,ARHGAP4能够正向调控HK2的表达进而促进HCC的生长,可望为HCC的靶向治疗提供新的线索。