中国胰腺癌综合诊治指南(2020版)
世界范围内胰腺癌的发病率和死亡率均呈上升趋势。2019年美国癌症协会发布的数据显示,美国胰腺癌新发病例数男性居第10位、女性居第9位,死亡率居恶性肿瘤第3位。中国国家癌症中心最新统计数据亦证实,胰腺癌居中国城市男性恶性肿瘤发病率的第8位,居大城市(如北京、上海)人群恶性肿瘤死亡率的第6位。
目前胰腺癌的诊治现状依然严峻。在肿瘤学新理念的推动下,近年来其临床诊疗水平取得明显进步:
(1)除手术、化疗、放疗等传统治疗外,靶向治疗和免疫治疗在胰腺癌综合诊治中取得进展。如针对胚系BRCA1/2基因突变的晚期胰腺癌患者,可在一线铂类药物有效的基础上采用多聚ADP核糖多聚酶[poly(ADP-ribose) polymerase,PARP]抑制剂进行维持治疗;针对高度微卫星灶不稳定性(microsatelliteinstability-high,MSI-H)或错配修复缺失(deficiency of mismatch repair,dMMR)的晚期胰腺癌患者,在二线治疗中推荐使用免疫检查点抑制剂等。多种治疗方式的联合应用是未来肿瘤治疗的趋势。
(2)多学科协作诊疗(multidisciplinary therapy,MDT)模式广泛普及,并贯穿诊疗全程。围绕根治性手术开展的术前新辅助或转化治疗,已成为交界可切除或局部进展期胰腺癌治疗的常态化选择,并逐渐应用于可切除胰腺癌;而针对晚期胰腺癌的序贯治疗或一线治疗有效后的维持治疗模式,亦在进行探索和尝试中。
(3)临床试验的开展和多中心跨区域合作为胰腺癌新药研发和方案优化提供了高级别的循证医学证据。截至2019年10月,ClinicalTrials.gov官方位点上登记的胰腺癌临床试验超过1 000项,同时Citeline信息平台上公布的胰腺癌新药开发项目达到4 000多项。国内外基于多中心、大数据的临床研究呈显著增多态势。
在上述背景下,中国抗癌协会胰腺癌专业委员会在《胰腺癌综合诊治指南(2018版)》的基础上,结合近年来胰腺癌的诊治进展,更新并颁布《中国胰腺癌综合诊治指南(2020版)》,为我国胰腺癌综合诊治工作提供进一步指导。
胰腺癌的诊断
胰腺癌起病隐匿,早期症状不典型,常表现为上腹部不适、腰背部痛、消化不良或腹泻等症状,易与其他消化系统疾病混淆。患者出现食欲减退、体重下降等症状时多属中晚期表现。
一、胰腺癌危险因素及筛查方法
1.年龄:胰腺癌发病与年龄密切相关。随着世界范围内人口老龄化程度加剧,胰腺癌发病率呈升高态势。
2.吸烟:吸烟是胰腺癌首要的危险因素。
3.遗传及家族史:对(1)存在胰腺癌易感基因,如ATM、BRCA1、BRCA2、CDKN2A、MLH1、MSH2、MSH6、EPCAM、PALB2、STK11、TP53等致病或可能致病的胚系突变;(2)家族内具有胰腺癌病史(一级或二级亲属)的个体,推荐开展早期筛查。
4.其他:高脂饮食、体重指数超标、酗酒、罹患糖尿病或慢性胰腺炎等亦与胰腺癌发病有关。
二、实验室检查
1. CA19-9是目前最常用的胰腺癌诊断标志物,具有以下特点:
(1)血清CA19-9>37 U/ml时,诊断胰腺癌的灵敏度和特异度分别为78.2%和82.8% 。
(2)约10%的胰腺癌患者呈Lewis抗原阴性,该类患者CA19-9不升高,需结合其他肿瘤标志物如CA125和(或)癌胚抗原(carcinoembryonic antigen,CEA)等协助诊断。
(3)血清CA19-9升高者,排除胆道梗阻或胆道系统感染等因素后,应高度怀疑胰腺癌。
2.血糖变化亦与胰腺癌发病或进展有关:
(1)中老年、低体重指数、无糖尿病家族史的新发糖尿病者,应警惕胰腺癌的发生。
(2)既往长期罹患糖尿病、短期出现血糖波动且难以控制者,应警惕胰腺癌的发生。
(3)前瞻性研究结果显示,空腹血糖每升高0.56 mmol/L,胰腺癌发病风险增加14%。
3.近年来诸多新型生物标志物,如外周血microRNA、ctDNA、cfDNA、外泌体内Glypican-1等,被尝试用于胰腺癌的诊断、疗效评估及随访;一些来源于胆汁、胰液、尿液、粪便的生物学标志物亦被证实具有潜在临床应用前景;某些异常微生物如肠道或牙周菌群,被发现与胰腺癌早期发生有关,上述检测手段的效能尚未被高级别证据证实,仍需进一步积累数据及经验。
三、影像学检查
影像学技术诊断胰腺癌的基本原则:
(1)完整(显示整个胰腺);
(2)精细(层厚1~3 mm 的薄层扫描) ;
(3)动态(动态增强、定期随访) ;
(4)立体(多轴面重建,全面了解胰腺周围毗邻关系)。
1.增强三维动态CT薄层扫描是目前诊断胰腺癌最常用的手段,能清晰显示肿瘤大小、位置、密度及血供情况,并依此判断肿瘤与血管(必要时采用计算机断层血管成像)、邻近器官的毗邻关系,评估肿瘤的可切除性及新辅助治疗的效果。
2.MRI除显示胰腺肿瘤解剖学特征外,还可清晰显示胰周淋巴结和肝内有无转移病灶;且在与水肿型或慢性肿块型胰腺炎鉴别方面优于CT检查。磁共振胰胆管造影(magnetic resonance cholaniopancreatography,MRCP)与MRI薄层动态增强联合应用,有助于明确胰腺为囊性还是实性病变(尤其是囊腺瘤、导管内乳头状瘤等的鉴别诊断),并进一步明确胰管、胆管的扩张及受累情况,诊断价值更高。
3.正电子发射断层显像-X线计算机体层成像(positron emission tomography-computed tomography, PET-CT)或PET-MRI可显示肿瘤的代谢活性和代谢负荷,在发现胰外转移、评价全身肿瘤负荷方面具有明显优势。一系列新型正电子放射性药物,如18F-FLT(胸腺嘧啶)、18F-FMISO(乏氧细胞显像剂)、11C-胆碱等可提高肿瘤诊断的特异度,可更早期、更准确地体现肿瘤对治疗的反应性。
4.超声内镜(endoscopic ultrasonography,EUS)及其引导下的细针穿刺活检是目前胰腺癌定位和定性诊断最准确的方法。另外,EUS也有助于判断肿瘤T分期,诊断T1~2期胰腺癌的灵敏度和特异度分别为72%和90%;而诊断T3~T4期胰腺癌的灵敏度和特异度分别为90%和72% 。近年来,基于EUS的肿瘤弹性应变率(strain ratio,SR)检测,可辅助判断胰腺癌间质含量,指导临床药物的选择。
四、病理学检查
组织病理学和(或)细胞学检查是诊断胰腺癌的“金标准”。除拟行手术切除的患者外,其余患者在制订治疗方案前均应尽量明确病理学诊断。目前获得组织病理学或细胞学标本的方法包括:
(1)超声、EUS或CT引导下穿刺活检;
(2)腹水脱落细胞学检查;
(3)腹腔镜或开腹手术下探查活检。
胰腺癌的病理学类型
根据WHO分类,胰腺恶性肿瘤按照组织起源可分为上皮来源和非上皮来源,其中上皮来源者主要包括来自导管上皮、腺泡细胞和神经内分泌细胞的导管腺癌、腺泡细胞癌、神经内分泌肿瘤及各种混合性肿瘤等。本指南内容主要针对导管腺癌[包括腺鳞癌、胶样癌(黏液性非囊性癌)、肝样腺癌、髓样癌、印戒细胞癌、未分化癌、伴有破骨样巨细胞的未分化癌等特殊亚型]和腺泡细胞癌患者的诊治。
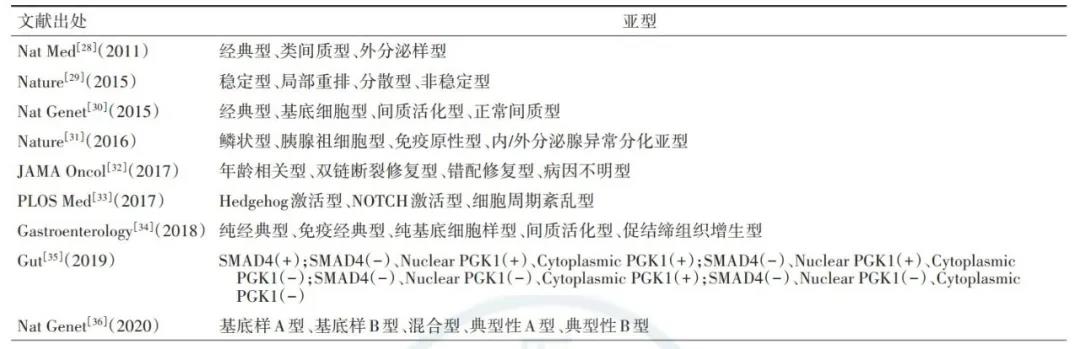
随着一系列高通量分子病理学技术的应用,胰腺癌的分子分型(表1)为临床药物选择提供了一定参考。如基因组不稳定型或合并BRCA通路突变或信号异常,则被认为对铂类药物敏感;而免疫原性型因表达较多的肿瘤特异性抗原及存在相关免疫细胞浸润,可能从免疫治疗中获益。近年来,随着临床转化的加速,可尝试应用基于高通量检测的胰腺癌分子分型和肿瘤细胞分群技术指导临床治疗。
表1 胰腺癌分子分型的研究现状
2019年PARP抑制剂在晚期胰腺癌维持治疗中取得成功,针对BRCA基因突变的研究和干预成为研究热点。国际癌症研究机构/美国医学遗传学与基因组学学会和胚系突变等位基因解读实证联盟将BRCA基因变异按照风险程度由高至低分为5级:
(1)致病性(5级,致病可能性>0.99);
(2)可能致病性(4级,致病可能性为0.95~0.99);(3)意义未明(3级,致病可能性为0.05~0.949);(4)可能良性(2级,致病可能性为0.001~0.049);(5)良性(1级,致病可能性<0.001)。
胰腺癌的分期
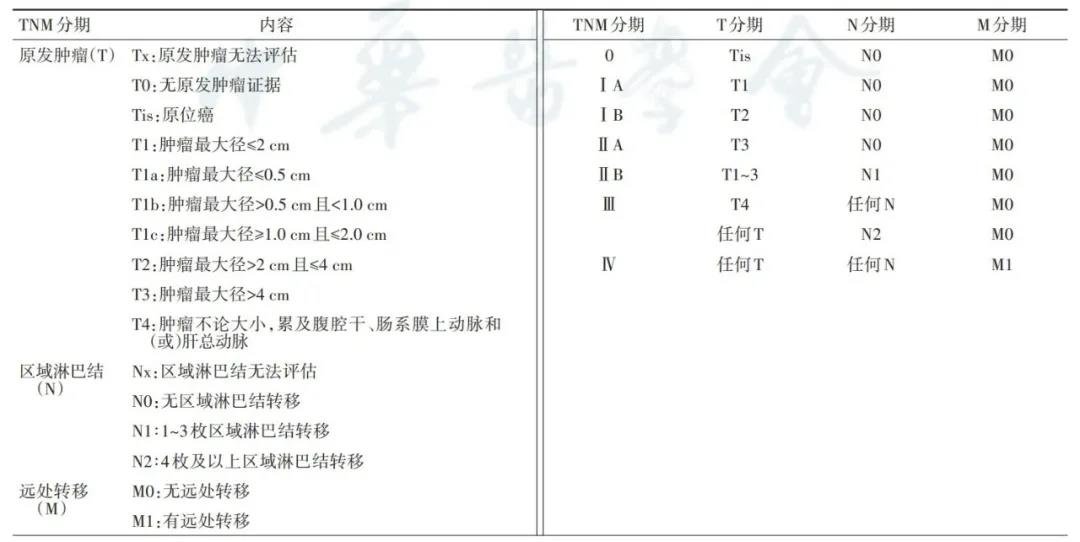
第8版AJCC胰腺癌分期系统的实用性和准确性已在我国多中心研究中获得验证(表2)。但如何更好地平衡肿瘤大小与淋巴结转移的相关性(尤其Ⅲ期患者的设定),如何结合肿瘤生物学因素进行优化等,仍需要更深层次的探讨。
表2 第8版AJCC胰腺癌分期系统
胰腺癌的外科治疗
根治性(R0)切除是目前胰腺癌最有效的治疗方法。术前应开展MDT讨论,依据影像学评估将其分为可切除胰腺癌、交界可切除胰腺癌、局部进展期胰腺癌、合并远处转移的胰腺癌(表3)。
表3 胰腺癌的可切除性评估

一、可切除胰腺癌的手术治疗
1.胰头癌:推荐根治性胰十二指肠切除术。
(1)包括完整切除胰头部及钩突,并行区域淋巴结清扫。要求胆管、胃或十二指肠、胰颈和肠系膜上动静脉环周等切缘阴性,即达到R0切除标准。
(2)腹腔镜及机器人根治性胰十二指肠切除术在手术安全性、淋巴结清扫数目和R0切除率方面与开腹手术相当,但其“肿瘤学”获益有待进一步的临床研究证实,推荐在专业的大型胰腺中心由有经验的胰腺外科医师开展。
2.胰体尾癌:推荐根治性胰体尾联合脾脏切除术。
(1)腹腔镜及机器人胰体尾切除术的手术安全性和根治性与开腹手术相当,已获得较广泛的应用与认可,但其“肿瘤学”获益仍需进一步临床研究证实,推荐在大型胰腺中心由有经验的胰腺外科医师开展。
(2)根治性顺行模块化胰脾切除术在提高肿瘤R0切除率和淋巴结清扫方面具有优势,但其对患者长期生存的影响有待临床研究证实。
3.部分胰腺颈部癌或胰腺多中心病灶的患者,可考虑行全胰腺切除。此类患者的手术操作及围手术期处理更加复杂,推荐在大型胰腺中心由有经验的胰腺外科医师开展。
4.扩大淋巴结清扫或神经丛切除,以及联合动、静脉或多器官切除等的扩大切除术对胰腺癌患者预后的改善存在争论,仍需要临床研究验证(胰腺癌标准根治与扩大切除术的手术范围见表4)。
表4 胰腺癌标准根治术及扩大手术切除范围的比较

二、交界可切除胰腺癌的手术治疗
1.新辅助治疗是目前交界可切除胰腺癌患者的首选治疗方式。目前研究结果证实,新辅助治疗能提高肿瘤的R0切除率、降低淋巴结转移率、减少神经和血管浸润、延长患者无瘤生存时间;但在延长总体生存期方面尚缺乏明确证据。对于新辅助治疗后序贯肿瘤切除的患者,联合静脉切除如能达到R0根治,则患者的生存获益与可切除患者相当。联合动脉切除对患者预后的改善存在争论,尚需前瞻性大样本的数据评价。
2.不推荐对这部分患者行姑息性R2切除手术,特殊情况如止血等挽救生命时除外。
三、局部进展期胰腺癌的手术治疗
1.不推荐局部进展期胰腺癌患者直接接受手术治疗。
2.术前转化治疗(如放化疗)是此类患者的首选治疗方式。转化治疗前需取得明确的病理学检查结果,对CT或EUS引导下反复穿刺活检仍无法明确病理学诊断的局部进展期胰腺癌患者,可行手术(腹腔镜或开腹)探查活检。
3.推荐转化治疗后肿瘤无进展且体能状态良好的患者接受手术探查,以腹腔镜探查为首选。
4.对合并胆道及消化道梗阻的局部进展期胰腺癌患者,推荐在转化治疗前置入胆管支架解除梗阻。当支架置入失败且患者体能状态尚可时,推荐开展胃-空肠吻合术或胆囊(胆管)-空肠吻合术。
5.术中探查发现肿瘤无法切除但存在十二指肠梗阻的患者,应行胃-空肠吻合术;对暂未出现十二指肠梗阻,预计生存时间超过3个月的患者,仍建议行预防性胃-空肠吻合术;肿瘤无法切除且存在胆道梗阻,或预期可能出现胆道梗阻的患者,建议行胆总管(肝总管)-空肠吻合术。
6.术中探查判定肿瘤无法切除的患者,在解除胆道、消化道梗阻的同时,应尽量取得病理学诊断。
四、合并远处转移的胰腺癌的手术治疗
1.不推荐对合并远处转移的胰腺癌患者行减瘤手术。
2.部分合并远处寡转移灶的胰腺癌患者,经过一段时间的系统化疗后,若肿瘤明显退缩且预计手术能达到R0切除,则推荐参加手术切除的临床研究。
3.对于合并胆道及消化道梗阻的有远处转移的胰腺癌患者,优先考虑经内引流支架置入解除梗阻。当支架置入失败且患者体能状态尚可时,可考虑行姑息性旁路手术。
胰腺癌的化疗
理论上胰腺癌化疗前均应获得细胞学或组织病理学证据,并行MDT讨论。化疗策略主要包括:
(1)术后辅助化疗;
(2)新辅助化疗;
(3)局部进展期不可切除或合并远处转移患者的姑息性化疗等。
一、可切除胰腺癌的化疗原则
(1)根治术后的胰腺癌患者如无禁忌证,均推荐行辅助化疗。
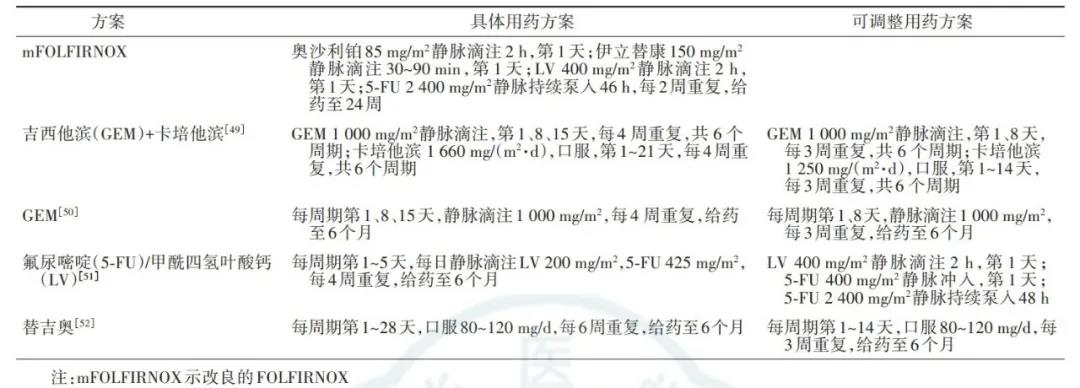
(2)辅助化疗方案推荐以吉西他滨(gemcitabine,GEM)或氟尿嘧啶(5-fluorouracil,5-FU)类药物[包括卡培他滨、替吉奥及5-FU/甲酰四氢叶酸钙(calcium leucovorin,LV)]为主的联合化疗。常用方案见表5。其中,对于切缘阴性(R0)的术后患者,推荐以5-FU或口服替吉奥为基础的辅助化疗方案;对于切缘阳性(R1)的患者,建议以GEM为基础的辅助化疗方案。但这一推荐仍需更高级别的循证医学证据来证实。
(3)术后体能状态恢复较好的患者,辅助化疗起始时间尽可能控制在术后8周内;体能状态差的患者,辅助化疗时间可以延至术后12周,但需完成足够疗程(6~8个疗程)(4)对于合并以下危险因素的可切除胰腺癌患者,建议开展术前新辅助化疗:①较高水平的血清CA19-9;②较大的胰腺原发肿瘤;③广泛的淋巴结转移;④严重消瘦和极度疼痛等。2016年中国抗癌协会胰腺癌专业委员会多学科临床研究协作学组(Chinese Study Group For Pancreatic Cancer,CSPAC)专家共识推荐术前“CEA(+)、CA125(+)、CA19-9 ≥1 000 U/ml”的可切除胰腺癌患者接受2~4个疗程的新辅助化疗。
(5)新辅助化疗后接受序贯根治手术且术后无复发或转移证据的可切除胰腺癌患者,建议经MDT评估后继续开展辅助化疗,参考前期新辅助化疗的效果或临床研究结论制定化疗方案。
表5 胰腺癌术后辅助化疗的常用方案及具体用药剂量
二、交界可切除胰腺癌的化疗原则
1.交界可切除胰腺癌患者的治疗策略,目前缺乏大型临床研究数据,建议开展相关临床研究。
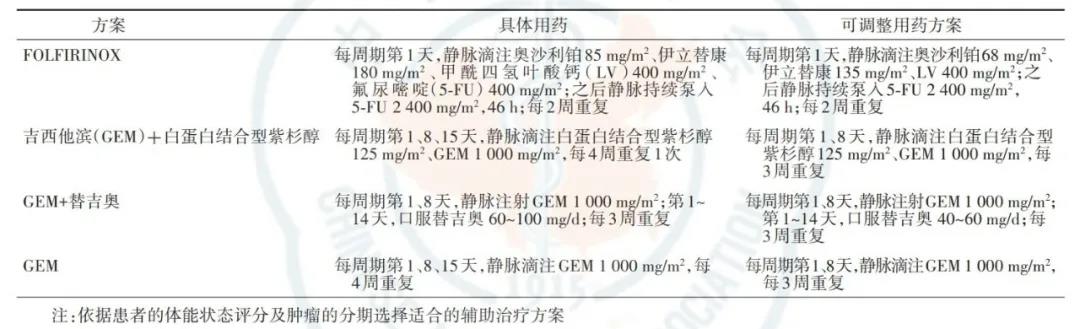
2.推荐体能状态良好的交界可切除胰腺癌患者开展术前新辅助治疗;术后经MDT评估后再决定是否追加辅助化疗。辅助化疗方案参考对新辅助化疗的效果或临床研究结论制定。依据患者体能状态选择新辅助化疗常用方案(表6)。对于EUS下肿瘤SR≥35.00的患者,推荐GEM+白蛋白结合型紫杉醇方案,但尚需高级别证据证实。
表6 胰腺癌新辅助化疗常用方案及用药方法
3.经新辅助治疗后进展或仍无法根治性切除的患者,依据不可切除胰腺癌的化疗原则继续化疗(表7)。
表7 不可切除的局部进展期或合并远处转移的胰腺癌患者的一、二线化疗方案
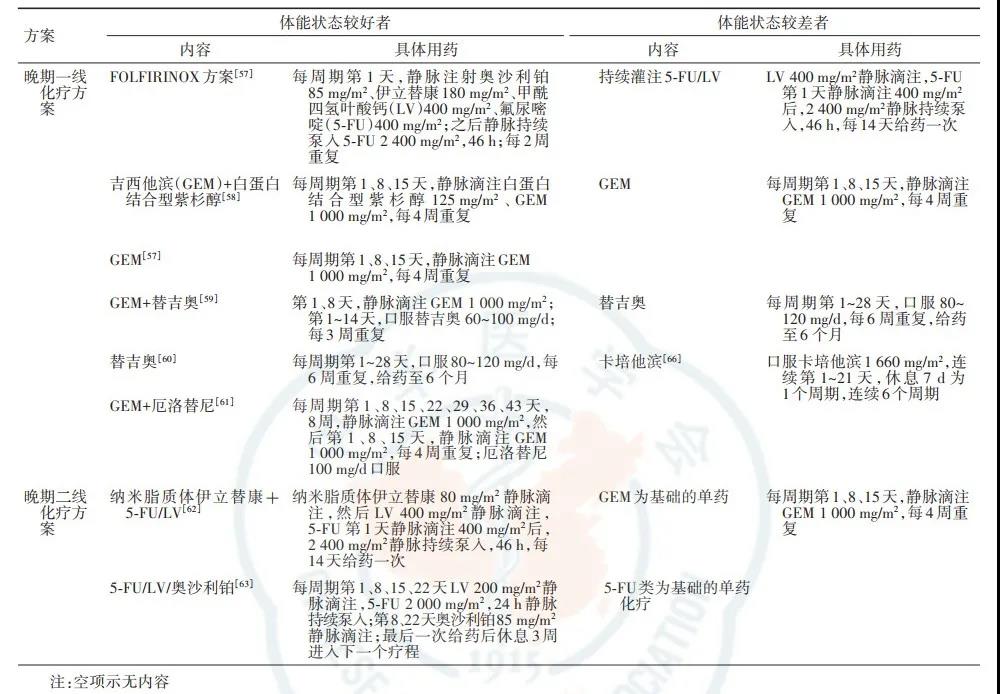
三、不可切除的局部进展期或合并远处转移的胰腺癌的化疗原则
1.局部进展期或合并远处转移的胰腺癌总体治疗效果不佳,建议开展相关临床研究。
2.局部进展期或合并远处转移的胰腺癌患者,依据体能状态选择一线化疗方案开展化疗(表7)。对携带胚系BRCA1/2或PALB2基因突变的患者,首选mFOLFIRINOX、FOLFIRINOX或GEM联合顺铂等含铂方案。
3.一线化疗无进展的晚期胰腺癌患者,若体能状态良好,可以考虑维持治疗。维持治疗的药物选择和治疗时间需经临床进一步探索验证。目前对携带胚系BRAC基因突变的晚期胰腺癌患者,经含铂方案一线化疗(≥16周)无进展后,推荐采用PARP抑制剂奥拉帕尼维持治疗。
4.一线化疗后进展的胰腺癌可依据已使用过的药物、患者体能状态评分、合并症及不良反应等选择非重叠药物开展二线化疗(表7)。二线化疗比支持治疗更有效。对于有MSI-H或dMMR特征的胰腺癌,在二线治疗中可考虑联合使用程序性死亡受体1(programmed death-1,PD-1)抗体。
5.目前对于一、二线化疗方案失败后的胰腺癌患者是否继续开展化疗存在争议,尚无明确化疗方案,建议开展临床研究。
胰腺癌的放疗
一、基本共识
1.胰腺癌患者是否接受放疗需要由MDT综合评估后决定。由于胰腺癌对X线的放射抵抗性较高,且其毗邻的空腔器官不能耐受高剂量照射,因此,对大多数胰腺癌患者而言,放疗是一种辅助性或局部姑息治疗(除非有特殊说明,本节所提到的“放疗”均为X线放疗)。
2.放疗必须与化疗联合使用:放疗前强烈建议进行2~4个疗程的诱导化疗,以抑制潜在转移灶;并作为筛选患者的手段,排除恶性程度高且已发生远处转移的患者,避免不必要的放疗。诱导化疗后重新对肿瘤进行评价,如果未发生远处转移,则进行放疗。放疗期间常用GEM或氟尿嘧啶类药物作为放射增敏剂。在放疗后继续序贯化疗。
3.新辅助放化疗:对于可切除或交界可切除胰腺癌,新辅助放化疗可提高手术的R0切除率,并可能使患者生存获益。
4.术后辅助放疗:目前对于术后辅助放疗的应用仍有争议。对于术后有肿瘤残留或有淋巴结转移的患者,建议术后行辅助放疗。虽然尚无高级别循证医学证据支持,但多项回顾性大样本病例对照研究结果显示,对于存在高危因素(如R1切除、淋巴结阳性或淋巴血管侵犯之一)的患者,术后放疗可获得生存获益。
5.局部进展期胰腺癌患者的放疗:虽然尚无前瞻性随机对照研究证实其生存获益,但能使肿瘤局部控制率提高,已被业界多数学者推荐。基于图像引导和呼吸运动管理的现代放疗技术,如X线的立体定向放疗(stereotactic body radiation therapy,SBRT)和质子重离子放疗,可提高放疗的生物学剂量,有望改善疗效。EUS引导下的胰腺癌瘤体内放射性粒子植入的内照射技术,对于镇痛有一定效果,但能否使患者生存获益尚未被证实。
6.手术后局部和(或)腹膜后淋巴结复发:如果无法再次手术且可排除远处转移,放疗应作为首选的局部治疗方法。
7.姑息镇痛治疗:肿瘤引起的腹背疼痛,不管是否有远处转移或有转移灶引起的疼痛,放疗均可作为姑息治疗,缓解疼痛。
8.推荐采用调强适形放疗(intensity modulated radiation therapy,IMRT),有条件的放疗中心可考虑使用SBRT或质子重离子放疗技术。
二、放疗原则
1.可切除和交界可切除胰腺癌的新辅助化放疗:(1)因体能状态不佳或合并症等暂时不能耐受手术的患者;或预计手术创伤可能导致辅助治疗困难或延迟的患者,MDT讨论后可考虑先行新辅助化放疗,以提高手术切除率(2)新辅助化放疗目前仅推荐用于交界可切除胰腺癌,不常规推荐用于可切除胰腺癌。新辅助化放疗指征:①肿瘤浸润至胰腺被膜外;②肿瘤侵犯大血管;③CA19-9明显升高(≥1 000 U/ml)等。推荐在GEM为基础的诱导化疗后给予新辅助放疗。同步化疗建议使用GEM或氟脲嘧啶类化疗药物。新辅助化放疗后4~8周,评价肿瘤无进展后考虑手术,但放疗所致的纤维化会增加手术难度。新辅助放化疗中的放疗尚无标准方案,常用总剂量为45.0~50.4 Gy,1.8~2.0 Gy/次,每周照射5次。亦可采用总剂量36 Gy,2.4 Gy/次,每周5次照射。
2.胰腺癌的术后放疗:(1)指征:①区域淋巴结转移(N1~2期),特别是淋巴结包膜外浸润;②切缘阳性(R1);③局部有病灶残留(R2切除);④淋巴血管侵犯或神经侵犯(2)照射范围:尚无明确的定论。美国肿瘤放疗协会建议照射范围包括肿瘤床、胰肠吻合口及邻近淋巴结引流区(腹腔干、肠系膜上动脉、门静脉和腹主动脉周围)。但近年来多项基于术后局部复发部位的研究建议缩小照射靶区,仅需照射腹腔干和肠系膜上动脉起始段周围的高危复发区域,并避免照射胆肠吻合口和胰肠吻合口。放疗总剂量为45.0~50.4 Gy,分割剂量1.8~2.0 Gy/次,高危复发部位可加量5.0~9.0 Gy。
3.局部进展期胰腺癌的同步化放疗:(1)指征:①局部进展期胰腺癌;②一般情况好[美国东部肿瘤协助组(Eastern Cooperative Oncology Group,ECOG)评分0~1级];③主要器官功能好;(2)强烈建议在3~6个月诱导化疗后进行;(3)同步化放疗的化疗建议:卡培他滨或替吉奥联合放疗;(4)照射靶区:一般建议仅照射临床可见肿瘤。采用SBRT技术时,可依据影像学图像中可见肿瘤范围进行非均匀外扩,形成计划靶区,可能获得更好的局控效果;(5)放疗剂量:常规分割放疗,总剂量为45.0~54.0 Gy,1.8~2.0 Gy/次,每周5次。如果肿瘤远离消化道,在不超过消化道耐受剂量的前提下,放疗总剂量可相应提高。如肿瘤未侵犯消化道,或距消化道大于1 cm,可以采用SBRT技术,目前推荐的分割剂量为25.0~45.0 Gy/3~5次(6)合并梗阻性黄疸的患者,放疗开始前需予减黄治疗,待黄疸消退后再开始放疗。
4.手术后局部肿瘤和(或)区域淋巴结复发的化放疗:对既往未接受过放疗的患者,建议化疗后行同步放化疗。放疗的靶区和剂量同“局部进展期胰腺癌的同步化放疗”。
5.减症放疗:(1)腹背疼痛:对原发病灶进行放疗,放疗剂量为25.0~36.0 Gy,分割剂量为2.4~5.0 Gy/次(2)对转移性病变(如骨转移)进行放疗,总剂量为30.0 Gy/10次照射,或SBRT单次8.0 Gy照射,或分次SBRT治疗。
6.再程放疗:(1)对于已行IMRT或SBRT但出现局部复发的患者,若无法二次手术切除,可以选择性地实施再程放化疗。但需要高级别循证医学证据来证实其疗效(2)再程放疗前,需谨慎评估治疗的安全性,并选择合适的患者。有研究结果表明,可根据肿瘤分期及首次放疗的效果筛选可能获益的患者,但需要高级别循证医学证据来证实(3)再程放疗的剂量必须根据两次放疗的间隔时间、第一次放疗时的处方剂量和正常组织受照剂量来决定,原则上再程放疗总剂量不超过首次放疗剂量。
其他治疗
一、动脉内灌注化疗
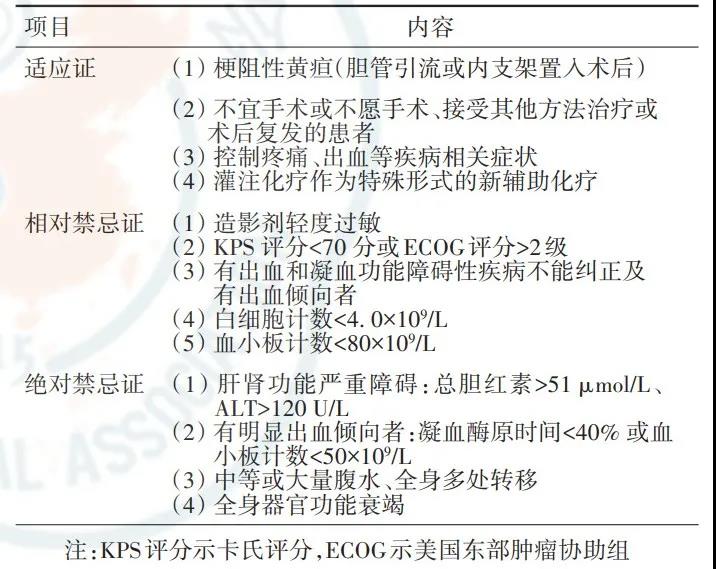
采用动脉内灌注化疗治疗胰腺癌的效果存在争议,建议开展临床研究。但需注意其适应证和禁忌证(表8)。临床操作中建议:(1)若见肿瘤供血动脉,超选后行灌注化疗;(2)若未见肿瘤供血动脉,建议胰头、胰颈部肿瘤经胃十二指肠动脉灌注化疗;而胰体尾部肿瘤则根据肿瘤范围、血管造影情况,经腹腔动脉、肠系膜上动脉或脾动脉灌注化疗;(3)对于伴有肝转移者经肝固有动脉灌注化疗,若造影见肝内转移灶血供丰富,可联合栓塞治疗。
表8 胰腺癌动脉灌注化疗的适应证和禁忌证
二、支持治疗
改善胰腺癌患者的生活质量是支持治疗的重要目的。最佳支持治疗应贯穿胰腺癌治疗始终,尤以终末期患者为主:对ECOG评分3~4级的胰腺癌患者推荐首选支持治疗;围手术期及胰腺癌系统治疗期间亦需选择合适的支持治疗。
1.疼痛管理在胰腺癌支持治疗中尤为重要,需要MDT讨论后按照癌痛治疗的三阶梯方法开展。阿片类制剂是胰腺癌疼痛治疗的基石,若阿片类药物不能控制疼痛或导致不能耐受的不良反应,推荐使用神经丛切断、EUS引导或CT引导下的神经丛消融术或无水酒精注射等。疼痛管理应达到“4A”目标,即充分镇痛、最优生存、最小不良反应、避免异常用药。
2.营养不良甚至恶液质在终末期胰腺癌患者中较常见。首先应对患者进行恶液质的诊断与分期;其次在判定全身营养状况和患者胃肠道功能状况的基础上制订营养治疗计划:(1)生命体征平稳但自主进食障碍者,推荐营养支持治疗(2)生命体征不稳定和多器官功能衰竭者,原则上不考虑系统性营养支持治疗(3)酌情选用能够逆转恶液质异常代谢的代谢调节剂,目前使用的药物包括ω-3多不饱和脂肪酸和沙利度胺等。
3.对于严重癌性腹水的患者,推荐腹腔置管引流;同时可以尝试腹腔热灌注治疗。
4.对于胰腺外分泌功能不全,进而引起营养物质吸收障碍者,可用胰酶替代治疗。
三、中医中药治疗
中医药治疗胰腺癌的循证医学证据不多,需要积极开展临床多中心研究。
四、其他治疗及其进展
主要包括去间质治疗、分子靶向治疗、免疫治疗等,目前多在临床试验阶段,可以进行临床研究。
1.去间质治疗:包括透明质酸酶抑制剂、Hedgehog信号阻断剂、基质金属蛋白酶抑制剂及肿瘤相关成纤维细胞去除剂等,目前均处于临床试验阶段,且多数研究失败。
2.靶向治疗:目前推荐使用厄洛替尼联合GEM进行局部进展或合并远处转移胰腺癌的系统治疗,但临床效果不佳。对EGFR扩增并KRAS基因野生型的局部进展或合并远处转移的胰腺癌患者,尼妥珠单抗联合GEM能延长总体生存时间。对不可切除的局部进展期或合并远处转移胰腺癌患者,最新推荐进行基因检测,存在NTRK融合基因的患者建议使用拉罗替尼或恩曲替尼治疗;存在胚系,甚至包括体系在内的BRCA1/2基因突变患者,可以在铂类药物有效后的维持治疗阶段使用奥拉帕尼;对于未检测到胚系BRCA1/2基因突变的患者,铂类药物有效后也可考虑在维持治疗阶段使用奥拉帕尼,但尚需高级别证据。
3.免疫治疗:胸腺法新是一种广泛使用的免疫增强剂,同时与放化疗连用,具有增敏作用。免疫检查点抑制剂,如PD-1单克隆抗体帕博利珠单抗,推荐用于具有MSI-H或dMMR分子特征的转移性胰腺癌患者。新型嵌合抗原受体T细胞和个性化肿瘤疫苗是胰腺癌免疫治疗的新方向,而免疫联合疗法(如联合放疗、化疗、靶向治疗等,以及多种免疫药物的联合)是未来胰腺癌治疗的主流趋势。
4.不可逆性电穿孔(又称纳米刀):该技术2011年被美国食品药品监督管理局批准应用于临床,主要针对局部进展期胰腺癌患者。2015年在中国获批用于胰腺癌和肝癌的治疗。该技术的安全性和有效性尚需临床研究证实。
胰腺癌患者的全程管理
1.临床怀疑胰腺癌,但难以与自身免疫性胰腺炎、慢性胰腺炎等疾病鉴别时,应对患者进行密切随访。随访项目包括CT、MRI等影像学检查和CA19-9、CA125、CEA等血清肿瘤标志物检查,必要时可重复行EUS穿刺活检和(或)PET-CT检查。推荐随访时间为每2~3个月1次。
2.接受手术治疗后的胰腺癌患者,术后第1年,建议每3个月随访1 次;第2~3年,每3~6个月随访1 次;之后每6个月随访1次。随访项目包括血常规、血生化、CA19-9、CA125、CEA等血清肿瘤标志物,超声、X线、胸部薄层CT扫描、全腹部(包括盆腔)增强CT等检查。建议终身随访。怀疑肝转移或骨转移的患者,加行肝脏MRI和骨扫描。
3.局部进展期或合并远处转移的晚期胰腺癌患者,在治疗过程中应至少每2~3个月随访1 次。随访包括血常规、血生化、CA19-9、CA125、CEA等血清肿瘤标志物,胸部CT、腹盆部增强CT等检查,必要时复查PET-CT。
随访的目的是综合评估患者的营养状态和肿瘤进展情况等,及时调整综合治疗方案。
胰腺癌综合诊治的若干热点问题
一、推荐对以下具有高危因素的人群定期开展胰腺癌筛查
1.存在已知的胰腺癌易感基因,如ATM、BRCA1、BRCA2、CDKN2A、MLH1、MSH2、MSH6、 EPCAM、PALB2、STK11、TP53等致病和(或)可能致病胚系突变,以及存在与胚系致病或可能致病突变来自同一方的具有胰腺癌家族史(一级或二级亲属)的人群。
2.家族内有2名及以上一级亲属罹患胰腺癌的人群(即使没有已知致病或可能致病的胚系变异)。
3.家族内有3名及以上一级和(或)二级亲属罹患胰腺癌的人群(即使没有已知致病或可能致病胚系变异)。
4.推荐在具有丰富临床经验及研究条件的大型胰腺中心开展胰腺癌筛查。
5.筛查方式及间隔:每年进行一次增强CT、MRI、MRCP和(或)EUS检查;对筛查发现可疑个体,可以缩短筛查间隔时间。
6.筛查起始年龄:(1)对于携带STK11或CDKN2A致病或可能致病胚系突变的个体,筛查年龄提早为30~40岁(同时具有明确家族史的个体,将家族中最早诊断胰腺癌的年龄提前10年,两者中选取更年轻的成员开始胰腺癌筛查)(2)对于携带其他胰腺癌易感基因,如ATM、BRCA1、BRCA2、MLH1、MSH2、MSH6、EPCAM、PALB2、TP53等致病或可能致病胚系变异的个体,筛查初始年龄一般定为50岁(同时具有明确家族史的个体,从家族中最早诊断胰腺癌的年龄提前10年,两者中选取更年轻的成员,开始胰腺癌筛查)。
二、胰腺癌诊治开展MDT的重要性
原则上,胰腺癌患者诊治的各个阶段均应开展MDT讨论,由多学科专家(胰腺外科、消化内科、肿瘤内科、放疗科、影像科、病理科、疼痛科、介入科、营养科等)共同制定诊治方案并贯彻始终。
三、胰腺癌病理学诊断过程中如何对活检部位进行选择
1.无远处转移病灶的“胰腺占位”,病理取材部位为胰腺原发病灶。
2. 高度怀疑合并远处转移的“胰腺占位”,取材部位可选转移病灶,如肝脏病灶。
四、基因检测在胰腺癌诊治过程中是否必要?
1.对于任何确诊的胰腺癌患者,推荐使用全面的遗传性肿瘤基因谱进行胚系突变的检测。
2.对于致病性突变检测阳性或具有明确家族史的患者,推荐开展深入的遗传分析评估(如详细调查疾病家族史等)。
3.对于接受治疗的局部进展期或转移性胰腺癌患者,推荐开展基于肿瘤组织样本的体细胞基因谱分析;对于无法获得组织样本的病例,可行外周血cfDNA的检测。
五、关于胰腺癌临床诊断标准的制定
鉴于胰腺特殊的解剖位置和胰腺癌特殊的生物学性状,部分高度怀疑胰腺癌却未能获取细胞学或组织学诊断的患者,经MDT讨论后,可以慎重做出临床决策,开展合理治疗。推荐做到以下几点。
1.具有完善的临床资料,包括全面、多次的血清学和各项高质量影像学检查。
2.专业的介入科或内镜科医师反复穿刺活检,并由经验丰富的多名病理科医师集中会诊。
3.与患者及家属多次沟通治疗风险,签署知情同意书。
4.由MDT专家共同制定最终决策,治疗过程中严密监测。
六、如何对胰腺癌可切除性进行评估
1.胰腺癌可切除性的判断需要MDT专家讨论后决定。
2.推荐三维CT薄层增强扫描甚至EUS评估胰腺癌局部侵犯血管程度。
3.推荐CT和(或)MRI评估肿瘤远处转移。
4.临床高度怀疑远处转移但CT和(或)MRI未证实的患者,推荐PET-CT或PET-MRI扫描,或可疑转移灶活检,必要时行腹腔镜探查。
七、在专业大型胰腺中心进行胰腺癌根治术的必要性
与小型中心相比,大型中心实施的胰腺癌根治术具有更低的手术并发症发生率和围手术期死亡率,同时,大样本回顾性资料显示,在大型中心接受根治手术的患者具有相对长的无病生存时间和总体生存时间。因此,推荐由大型中心经验丰富的医师主持开展胰腺癌根治术及相关诊疗措施,特别是接受新辅助治疗或转化治疗后的交界可切除和局部进展期胰腺癌患者,应到专业中心进行根治手术。
八、胰腺癌根治术前是否需要减黄治疗
1.术前进行胆道引流解除梗阻性黄疸的必要性存在争论,尚无明确的术前减黄指标,推荐经MDT 讨论后综合判断。
2.高龄或体能状态较差的患者,若梗阻性黄疸时间较长,合并肝功能明显异常、发热及胆管炎等感染表现,推荐术前行减黄治疗。
3.术前拟行新辅助治疗的梗阻性黄疸患者,推荐首先进行减黄治疗。
九、如何选择合理有效的减黄方式
1.拟行开腹手术的患者推荐经内镜逆行性胰胆管造影(endoscopic retrograde cholangiopan- creatography,ERCP)下置入鼻胆管或塑料支架,或行经皮经肝胆管引流(percutaneous transhepatic cholangial drainage,PTCD);拟行腹腔镜胰十二指肠切除术的患者,推荐通过PTCD减黄。
2.对于局部进展期不可切除胰腺癌或合并远处转移者,推荐ERCP下置入金属支架术减黄。
3.合并上消化道狭窄、梗阻等不能开展ERCP下支架置入的梗阻性黄疸患者,或ERCP下支架减黄失败、反复胆道感染的患者,推荐经PTCD减黄或行胆道旁路手术。
十、腹腔镜和机器人手术在胰腺癌中的应用
1.腹腔镜和机器人胰十二指肠切除术手术安全性不断提高,但作为一种复杂、高风险手术,需要强调较长时间的学习曲线和专业训练。与开放手术相比,其“微创”优势已获证实,但“肿瘤学”效应获益仍需进一步验证。推荐开展临床研究或在大型专业中心由有经验的胰腺外科医师实施此类手术。
2.腹腔镜和机器人胰体尾切除术的微创优势明显,在国内外广泛应用,但其肿瘤学获益仍需高级别循证医学证据证实。推荐参加临床研究或在大型专业中心由有经验的胰腺外科医师实施手术。
3.对存在明显胰外侵犯的胰腺癌开展腹腔镜和机器人手术尚有争议,需进一步总结。
4.对可疑局部进展和(或)远处转移的胰腺癌患者,推荐开展腹腔镜探查。腹腔镜探查可发现腹膜和肝脏等表面微小转移,并可切取活检,弥补目前影像学检查分期的不足,具有诊断和更精确的分期价值,推荐在开放手术前积极开展。结合腹腔镜超声检查可有助于详细了解肿瘤与血管的关系,进一步判断肿瘤的可切除性。
十一、如何对手术标本或手术切缘进行标记和取材
1. 应在术者或第一助手的指导下完成标本淋巴结的获取、命名和分装。
2.应由术者和病理科医师共同完成对标本各切缘的标记和描述。如术中联合门静脉或肠系膜上静脉切除,则应对静脉受累部位分别取材送检,并据静脉浸润深度做详细分类(表9)。
表9 胰腺癌手术切缘描述和静脉浸润深度的鉴定
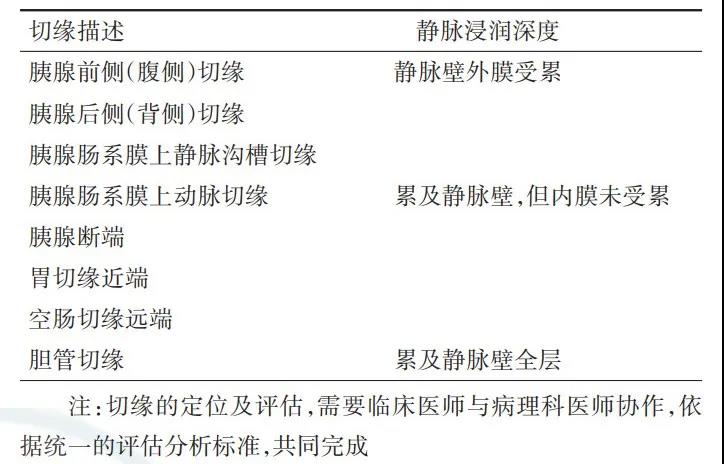
3.推荐将距切缘1 mm内无肿瘤细胞浸润定义为R0切除;距切缘1 mm组织内有肿瘤细胞浸润定为R1切除;肉眼可见的肿瘤残留定义为R2切除。
十二、扩大切除能否提高胰腺癌手术效果
1.目前尚无胰腺癌扩大切除的明确指征,推荐开展多中心临床研究。
2.扩大切除的基本要求是做到R0或R1切除,不推荐开展R2切除术。
3.推荐开展能达到R0切除标准的联合门静脉或肠系膜上静脉切除,否则不建议实施这一扩大手术方式。
4.扩大淋巴结清扫或神经丛切除对患者长期生存的影响存在争论,尚需临床研究证实。
5.针对交界可切除和局部进展期患者,新辅助治疗或转化治疗后扩大切除较姑息性治疗更能带来生存获益。
十三、胰腺癌根治术后是否需要常规留置腹腔引流管
与胰十二指肠切除术相比,随机对照试验研究结果显示,胰体尾切除术后无需留置腹腔引流管,但该观点仍有争议。临床应用中多依据胰腺质地、患者全身状况、术者经验综合评估。
1. 提倡开展胰体尾切除术后腹腔引流管留置与否的多中心临床研究,获得国人数据。
2.推荐胰十二指肠切除术后常规放置腹腔引流管,但可视引流物性状、流量及淀粉酶浓度等早期拔除。
3.提倡开展随机对照试验研究,制定胰十二指肠切除术后早期拔除引流管的标准,评价其安全性及可行性。
十四、胰十二指肠切除术后常规留置鼻胃管的必要性
1.不推荐胰十二指肠切除术后常规或长期留置鼻胃管;即使术后留置,亦建议早期拔除。
2.留置鼻胃管并不能预防胃排空延迟。
十五、胰腺术后是否需要应用生长抑素及其类似物
理论上,生长抑素及其类似物可以减少消化液的分泌,降低胰腺癌术后胰瘘的发生率,但大样本量的随机对照试验研究并未获得一致性的结论。目前不推荐胰腺癌术后常规使用生长抑素及类似物预防胰瘘;但对于胰腺质软、胰管细及体重指数高的肥胖患者,建议预防性应用。
十六、血清肿瘤标志物能否预测胰腺癌手术切除率并判断预后
血清肿瘤标志物,如CA19-9可以在影像学检查基础上提示并预测手术效果,但其准确性仍需要大规模临床研究来证实。目前证据表明:
(1)术前血清CA19-9水平越高,胰腺癌手术切除率越低。
(2)手术前后血清CA19-9变化与患者术后生存密切相关。术后CA19-9水平对手术效果的预测较术前CA19-9水平更有价值,术后CA19-9降至正常范围的患者预后较好(3)血清肿瘤标志物CA125和胰腺癌转移密切相关,对胰腺癌可切除性的预测有重要价值。
(4)对Lewis抗原阴性和CA19-9不表达的胰腺癌患者,CA125联合CEA有助于预测这部分患者的预后。
十七、可切除胰腺癌患者是否推荐接受术前新辅助治疗
1.可切除胰腺癌开展新辅助治疗仍存在争议,建议开展临床研究。
2.推荐具有如下高危因素的患者接受新辅助治疗:(1)较高水平的血清CA19-9;(2)较大的胰腺原发肿瘤;(3)广泛淋巴结转移;(4)严重消瘦和极度疼痛等的患者进行新辅助治疗。2016年CSPAC专家共识推荐具有CEA+、CA125+、CA19-9≥1 000 U/ml血清学特征的患者首选新辅助治疗。
3.新辅助治疗以化疗为主导,放疗的效果仍存在争议。对于体能状态好的患者,目前推荐方案:(1)FOLFIRINOX或mFOLFIRINOX,序贯加或不加放化疗;(2)GEM联合白蛋白结合型紫杉醇,序贯加或不加放化疗。
4.对于携带BRCA1/2基因突变的患者,推荐:(1)FOLFIRINOX或mFOLFIRINOX,序贯联合或不联合放化疗;(2)GEM联合顺铂,序贯加或不加放化疗。
十八、RECIST 1.1标准是否能在胰腺癌根治术前反映新辅助治疗效果
1.由于胰腺癌富含间质,基于影像学RECIST标准的术前评估不能全面反映胰腺癌新辅助治疗效果。
2.新辅助治疗前后血清CA19-9的变化对提示新辅助治疗效果具有重要价值。另外,基于液体活检的各种指标(如循环血游离癌细胞、ctDNA、cfDNA、外泌体、microRNA等)也具有极大的临床实用性,期待临床试验证实。
3.新辅助治疗后门静脉、肠系膜上静脉、肠系膜上动脉、肝总动脉周围软组织影的轻度增加,不作为手术探查的禁忌证。
十九、哪些接受新辅助治疗和(或)转化治疗后的胰腺癌患者应进行手术探查
1.新辅助治疗后,原发肿瘤稳定且无远处转移的患者均推荐积极手术探查。
2.对于接受新辅助治疗的可切除和交界可切除患者,只要影像学检查结果提示局部肿瘤无明显进展,同时CA19-9水平稳定或降低,均推荐手术探查。
3.对于术前接受转化治疗的局部进展期胰腺癌患者,治疗后CA19-9下降幅度超过50%,全身情况如体能状态评分、疼痛缓解度、体重及营养状态等改善后,亦推荐积极手术探查。
4.推荐腹腔镜探查作为主要的手术探查方式。
5.这部分患者的手术应该在大型专业中心由有经验的医师开展。
二十、RECIST1.1标准是否反映免疫治疗疗效
1.RECIST1.1标准不适合评判免疫治疗效果。因为:(1)免疫治疗(尤其肿瘤疫苗)的长时性可能不会导致肿瘤体积的缩小,却能有效延长患者的无病进展期(2)免疫治疗过程中出现如假性进展或反应不一致等现象,虽有违RECIST 1.1疗效判断标准,但一定程度上可能提示肿瘤治疗有效。
2.特异性评判免疫治疗效果的iRECIST标准见表10,仍需要进一步完善。
表10 RECIST和iRECIST的比较

二十一、血清或组织学分子标记能否预测胰腺癌化疗疗效
1.血清CA19-9水平及其变化对化疗疗效的预测有重要价值,但还需要更高级别的循证医学证据。目前几项研究结果可以作为参考:
(1)术后血清CA19-9<90 U/ml的胰腺癌患者辅助化疗后无瘤生存时间显著延长,而术后血清CA19-9水平>90 U/ml的患者不能从辅助化疗中获益。
(2)接受新辅助化疗的交界可切除患者,新辅助化疗后血清CA19-9≤40 U/ml者术后可获得较长的生存时间。
(3)晚期胰腺癌患者,排除黄疸等影响后的治疗前血清CA19-9水平可以孤立判断预后。
2.检测根治术后胰腺癌组织样本内的人类平衡型核苷转运载体1(human equilibrative nucleoside transporter 1,hENT1)表达水平,可预测术后GEM辅助化疗的效果,hENT1高表达者对GEM更加敏感,治疗后中位生存时间较低表达者显著延长。
3.检测新辅助治疗前胰腺癌组织内羧酸酯酶2表达,或者治疗前后血浆内miR-181a-5p变化可预测交界可切除患者对新辅助FOLFIRINOX方案的敏感性。
4.近年来证实肿瘤内某些微生物的存在与胰腺癌耐药有关,有望成为预测胰腺癌化疗敏感性的靶标,期待临床研究证实。
二十二、“维持治疗”在胰腺癌综合诊治中的价值
1.一线治疗无进展的晚期胰腺癌患者(包括①转移性胰腺癌系统化疗后或②局部进展期胰腺癌同步化放疗后),若体能状态良好,可以考虑维持治疗。
2.目前推荐的维持治疗方案,仅针对携带胚系BRCA基因突变的转移性胰腺癌患者。经一线含铂方案化疗16周后肿瘤无进展,且体能状态评分良好的患者,用PARP抑制剂奥拉帕尼维持治疗。另外,在临床上尝试的其他维持方案有:(1)FOLFIRINOX方案后选择FOLFIRI或FOLFOX方案维持治疗;(2)FOLFIRINOX方案后用5-FU/LV或卡培他滨维持治疗;(3)GEM联合白蛋白结合型紫杉醇后选择单药GEM维持治疗;(4)白蛋白结合型紫杉醇联合替吉奥后采用替吉奥维持治疗。但以上方案尚需高级别的临床试验结果证实。
3.维持治疗的时间定义为持续至疾病进展或不良反应难以耐受。
二十三、“序贯治疗”新理念在胰腺癌中的尝试
1.序贯治疗对提高胰腺癌的疾病控制率、延长无病进展时间和总体生存时间方面可能有效,但需要高级别临床研究证据来证实。
2.目前尚无推荐的胰腺癌序贯治疗方案,2018年两项法国多中心的二期临床研究结果提示,以下序贯方案能提高转移性胰腺癌的疾病控制率,并延长患者的无病生存时间:(1)白蛋白结合型紫杉醇联合GEM(2个月)序贯 FOLFIRI(2个月),相互交替(试验项目:PRODIGE37-FIRGEMAX随机对照二期临床研究);(2)白蛋白结合型紫杉醇联合GEM(1个周期)序贯FOLFIRINOX(2个周期),相互交替。上述方案或新方案的选择需要更高级别的循证医学证据来证实。
二十四、一线或二线化疗失败后的胰腺癌患者是否继续开展系统性治疗?
推荐一线或二线化疗失败后体能状态较好的局部晚期、复发性或合并远处转移的胰腺癌患者继续接受系统性治疗。建议参加临床研究或通过基因检测为临床用药提供参考。
二十五、如何定义晚期胰腺癌中化疗应用的时限
推荐将化疗持续应用于不可切除(包括肿瘤局部进展不可切除、复发性或合并远处转移)胰腺癌,除非肿瘤明显进展或药物毒性限制其继续使用。
二十六、放化疗结合是否能提高局限期胰腺癌的疗效
1.对于根治术后具有高危因素的胰腺癌(如①区域淋巴结转移,特别是淋巴结包膜外浸润;②切缘阳性;③局部有病灶残留;④淋巴血管侵犯或神经侵犯),推荐4~6个疗程的全身化疗后,评估疾病状态。对于未发生远处转移的患者,进一步序贯同期放化疗。
2.对于局部进展期不可切除的胰腺癌,推荐全身化疗后续贯5-FU、GEM为基础的同步放化疗方案。
二十七、胰腺癌患者治疗过程中是否推荐术中放疗
术中放疗尚未被证实能提高胰腺癌患者生存率。不推荐在胰腺癌根治术中同期开展术中放疗,该方面的研究应在有条件的医院进行临床试验。
本指南旨在为胰腺癌临床规范化诊治提供参考及指导,指南内容不可能涵盖所有临床现象,鉴于胰腺癌生物学行为的复杂性,治疗方案与治疗效果之间存在不确定性,临床实践中应据患者的具体情况,在前述原则与框架内个体化选择具体治疗方案,最大限度改善患者预后。
本指南撰写和审定委员会成员名单
组长:赵玉沛(中国医学科学院 北京协和医学院 北京协和医院)
组员(按姓氏汉语拼音排序):白永瑞(上海交通大学医学院附属仁济医院)、陈汝福(中山大学孙逸仙纪念医院)、窦科峰(陆军军医大学西京医院)、达明绪(甘肃省人民医院)、傅德良(复旦大学附属华山医院)、郝继辉(天津医科大学肿瘤医院)、蒋国梁(复旦大学附属肿瘤医院)、金政锡(黑龙江省医院)、李宏为(上海交通大学医学院附属瑞金医院)、李升平(中山大学附属肿瘤医院)、廖泉(中国医学科学院 北京协和医学院 北京协和医院)、刘颖斌(上海交通大学医学院附属仁济医院)、刘续宝(四川大学华西医院)、蒋奎荣(南京医科大学第一附属医院)、晋云(云南省第一人民医院)、牟一平(浙江省人民医院)、倪泉兴(复旦大学附属肿瘤医院)、全志伟(上海交通大学医学院附属新华医院)、秦仁义(华中科技大学同济医学院附属同济医院)、邵成浩(海军军医大学长征医院)、沈柏用(上海交通大学医学院附属瑞金医院)、孙志为(云南省第一人民医院)、孙备(哈尔滨医科大学附属第一医院)、田伯乐(四川大学华西医院)、仵正(西安交通大学第一附属医院)、吴文铭(中国医学科学院 北京协和医学院 北京协和医院)、王春友(华中科技大学同济医学院附属协和医院)、王理伟(上海交通大学医学院附属仁济医院)、王巍(复旦大学附属肿瘤医院)、杨尹默(北京大学第一医院)、虞先濬(复旦大学附属肿瘤医院)、张火俊(海军军医大学长海医院)、章真(复旦大学附属肿瘤医院)、张艳桥(哈尔滨医科大学附属肿瘤医院)、朱雄增(复旦大学附属肿瘤医院)
执笔专家:刘亮(复旦大学附属肿瘤医院)、王文权(复旦大学附属肿瘤医院)、高鹤丽(复旦大学附属肿瘤医院)、虞先濬(复旦大学附属肿瘤医院)