聊聊火热的溶瘤病毒抗癌疗法
▉ 溶瘤病毒到底是个啥
首先看一下字面意思,“溶瘤病毒”-可以把肿瘤给“溶”了,意思就是病毒把肿瘤给干掉了,原本“有毒”的病毒,去干掉“有毒”的肿瘤,颇有一种以毒攻毒的意味。其实这里的病毒不是一种特定的病毒,而是可为我们所用的病毒的总称。A病毒可杀灭肿瘤,B病毒也可杀灭肿瘤。那么A和B都叫做溶瘤病毒。但是A和B都有相同的特征,即:都倾向于感染肿瘤细胞(注意:也会感染正常细胞,但是毒性相对于肿瘤细胞弱得多)。以前都是用自然界存在的活病毒,比如什么肝炎病毒,乌干达病毒直接上人体试验,想想还是蛮可怕的。目前大多数的都是转基因病毒,比如敲除毒性基因,更安全。比如给病毒加上更加能识别肿瘤的蛋白,更有选择性。比如给病毒转入一些能够刺激机体产生免疫的基因,更加有效。
看下图,药学速览讲一下机理:黄颜色的溶瘤病毒可以感染蓝色的正常细胞和紫色的肿瘤细胞,但是不会在正常细胞内复制,正常细胞不会被伤害,但是可以选择性的在肿瘤细胞内复制,最终造成肿瘤细胞裂解,裂解的后果是释放的病毒再去感染其他的肿瘤细胞,同时裂解的肿瘤碎片(抗原)会引起机体免疫反应,加快对肿瘤的清除。

▉ 溶瘤病毒如火如荼
2015年FDA批准了T-VEC(一种改良型单纯孢疹病毒,其失去在正常细胞中的复制能力,而只在癌细胞中大量复制,从而起到杀灭癌细胞的作用。并且在感染癌细胞后能合成并释放出一种名为人粒细胞巨噬细胞集落刺激因子(GM-CSF)的蛋白。这种蛋白能够重新激发人体的免疫反应,调动免疫系统进一步杀灭其他癌细胞。)作为溶瘤病毒免疫疗法来治疗癌症。如今5年也过去了,我们回头看,至今还是只有这一种溶瘤病毒免疫疗法被FDA批准上市,但是溶瘤病毒的研发依然如火如荼。在这里,我们通过一个圆饼图观测目前在研的溶瘤病毒药物。这个图来源于OvirusTdb,该位点存储和管理有关24种病毒,427种细胞系,22种模型生物的信息,并包括5927条溶瘤病毒记录。

目前在研的溶瘤病毒药物
我们可以在全球布局上可以看出,腺病毒的研发依旧处于统治地位,单纯孢疹病毒和牛孢疹病毒也势头正猛,其他种类的病毒也正在布局。目前的状况来看,虽然进入三期临床的溶瘤病毒药物并不多,而且单药的给药方式效果并不好,但是联药给药的方式却能够有着良好的效果,比如前几个月美国希望之城癌症治疗中心通过溶瘤病毒递送至实体肿瘤表达CD19靶标,联合CAR-T疗法以治疗实体瘤。所以,未来是光明的(个人认为,这里挖个坑)。今天要给大家介绍的这篇文章发表在 《Nature reviews drug discovery》,这篇文章发表在2015年,主要介绍了溶瘤病毒对癌症治疗的机理以及未来开发药物的可行性,在这篇文章发表之前,T-VEC还没有上市(T-VEC于2015年10月27日上市,用于治疗黑色素瘤,给药方式为瘤内注射),但是本文为今后开发溶瘤病毒提供了前瞻性的策略。

▉ 溶瘤病毒抗肿瘤机制介绍
首先,作者提出了至今仍被人欣赏的观点,溶瘤病毒来介导抗肿瘤活性主要通过两个方式:1、选择性在肿瘤细胞内复制,导致肿瘤裂解。2、通过肿瘤细胞的坏死来破坏肿瘤微环境,通过生物体的免疫系统介导,来诱导全身抗肿瘤免疫反应。
下面我们简要介绍一下溶瘤病毒的病毒学特性,众所周知,病毒简单的可以分为RNA病毒和DNA病毒,文章通过两张简单的图表向我们展示了目前能够开发成溶瘤病毒的病毒。
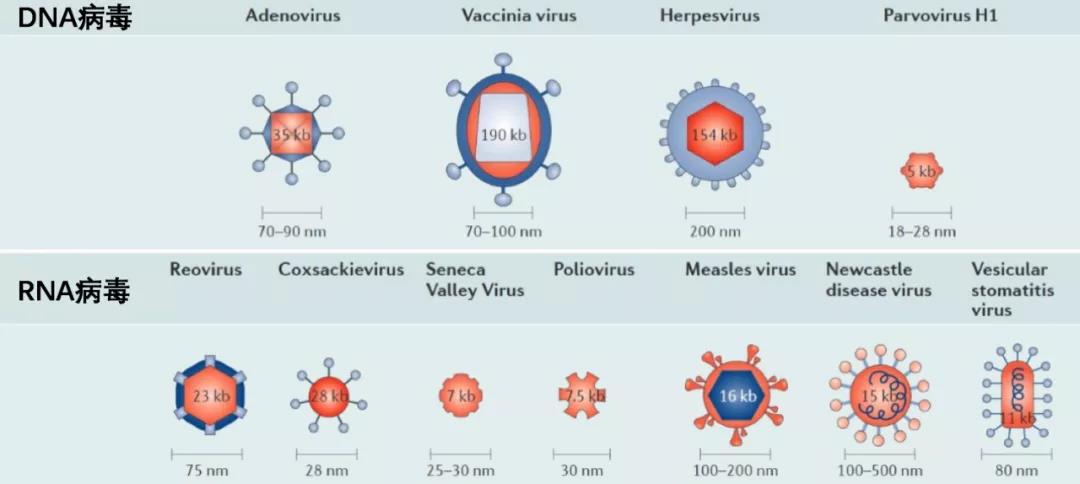
从这里我们可以看出,腺病毒属于双链DNA病毒,他的复制大部分在宿主的细胞核内,他的病毒体几乎是裸露的,所以我们可以在这里得出,腺病毒的改造可能比其他的病毒体被蛋白质衣壳包裹的病毒容易许多,这应该也是为什么腺病毒在研究中广受青睐的一些原因。由于RNA病毒的变异较为广泛,而且对抗病毒药物基本没有响应,所以其体内毒性很难预测,导致开发较为缓慢。
接下来,我们来聊一聊关于溶瘤病毒的免疫机制。在谈免疫机制之前,我们先需要明白 Cell antiviral response elements(细胞抗病毒反应元素),我这里把element翻译成元素,其实也就是细胞内外各种受体、因子来触发抗病毒反应的。这些靶点、受体、因子包括:PKR(蛋白激酶R)、TLRs(Toll样受体)、RIG-1(维甲酸诱导基因1), danger-associated molecular pattern signals(DAMPs)、heat shock proteins(HSPs), pathogen-associated molecular patterns(PAMPs)。关于这些受体靶点以及细胞因子的各自作用可以查阅相关文献。下面我们就开始重磅部分了!坐好小板凳。
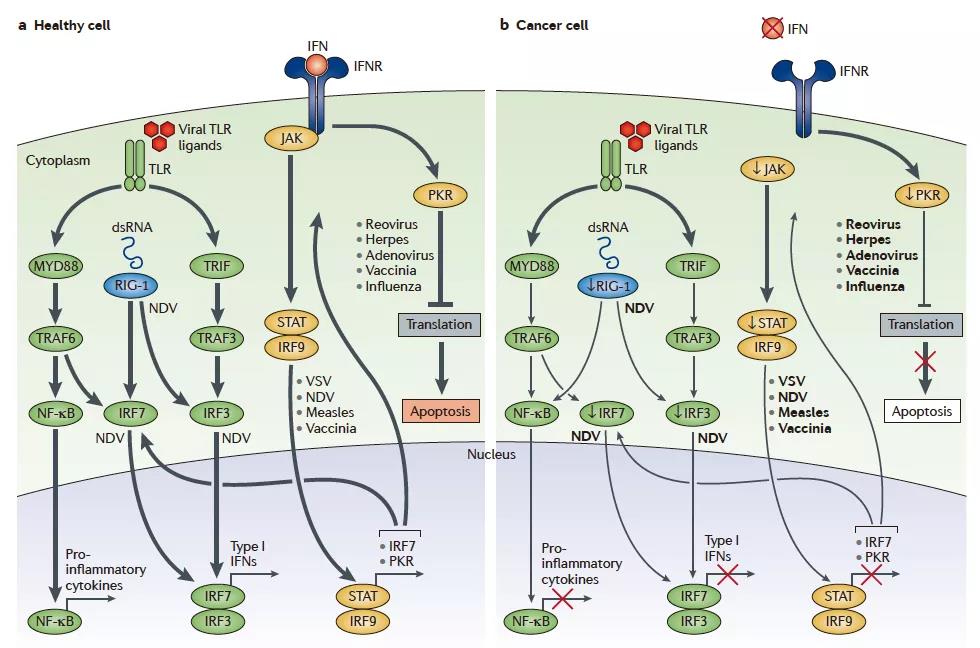
溶瘤病毒利用癌症免疫逃逸的途径
这段文字可能有些枯燥,觉得太枯燥可直接跳至下一段科普版。
病毒感染后,大多数正常细胞会激活抗病毒途径,从而遏制病毒感染。可以通过激活Toll样受体(TLR)的病毒病原体相关分子模式(PAMP)或通过视黄酸诱导基因1(RIG-1)检测病毒核酸来触发抗病毒机制。一旦检测到病毒,通过多个I型干扰素(IFN)元件(Janus激酶(JAK),信号转导和转录激活因子(STAT)和干扰素调节因子9(IRF9))的信号级联会导致程序化的转录途径限制了病毒的遗传,并且可以使感染的细胞进行凋亡或坏死。由对病毒感染的先天免疫应答诱导的局部IFN产生也可能通过IFN受体(IFNR)促进抗病毒活性。TLR通过髓样分化初级反应蛋白MYD88,含TIR域的衔接子诱导IFN&β;(TRIF),IRF7,IRF3和核因子-κB(NF-κB)发出信号,从而诱导促炎性细胞因子和I型IFN的产生。I型IFN通过JAK–STAT信号通路进行信号传导,从而导致细胞周期调节剂(例如蛋白激酶R(PKR)和IRF7)的上调,它们通过与病毒颗粒结合并触发I型IFN转录途径来限制病毒的遗传,促进感染细胞的流产凋亡和细胞因子的产生,从而提醒免疫系统存在病毒感染。然而,在癌细胞中,该过程被破坏。癌细胞可能会下调先天信号通路中的关键信号成分,包括RIG-1,IRF7和IRF3。这限制了通过TLR和RIG-1对病毒颗粒的检测,从而使癌细胞更易于病毒复制。此外,癌细胞可能下调I型IFN信号通路的关键组成部分,从而限制I型IFN的促凋亡和细胞周期调控作用。
科普版
看完这一段话,如果不太了解信号通路的人,估计会彻底懵逼了,如果把所有的信号通路都看懂,几天是不能完成的事情,其实只要把病毒在细胞中做了些啥搞懂就行了啊!其实整个原理很简单,介绍一下:病毒找到了正常细胞,悄摸摸的进去了,细胞觉得不对,自己不是那么回事儿了,感觉有东西搞进来了啊,完事启动TLR和RIG-1去找病毒,找到后JAK-STAT通路开始干活了,通过这个通路形成自身的程序化转录,不让病毒用自身的模板,完事儿如果还没防住病毒,咋办,自己整死自己也不能让病毒活着再繁殖——启动自身凋亡,完事还产生细胞因子,提醒周围免疫环境,进来病毒了哈,注意点,加紧巡逻。但是对于癌细胞来说,癌细胞还忙着繁殖呢,顾得上你这小东西呢么,所以他下调了JAT-STAT信号通路,下调了TLR和RIG-1,这些因子都被下调了,那病毒的复制和繁殖受到的限制就少多了啊,病毒一看,这地方好啊,繁殖复制都这么舒服,搁这呆着好啊,所以病毒在肿瘤部位存留较多。

但是溶瘤病毒怎么能够根除体内的肿瘤呢?这个问题要回到咱们开头说的了,在开头我们讲过,溶瘤病毒介导抗肿瘤活性的第二个方法:通过肿瘤细胞的坏死来破坏肿瘤微环境,通过生物体的免疫系统介导,来诱导全身抗肿瘤免疫反应。当肿瘤细胞被溶瘤病毒“融化”掉以后,我们可以看到因为肿瘤细胞不是启动程序化凋亡死掉的,而是坏死死掉的,所以在死掉的过程中还会释放细胞因子或者产生与肿瘤相关的抗原来促进适应性免疫活动。病毒天然诱导宿主抗病毒免疫反应的能力可能会通过中和抗病毒抗体和/或细胞毒性T细胞介导的免疫反应来清除病毒。病毒中和影响肿瘤免疫诱导的程度是复杂的,并且可能受许多变量影响,最显着的是病毒和肿瘤微环境的特征。
但是溶瘤病毒发挥作用也有诸多限制,比如基质细胞(例如与癌症相关的成纤维细胞)可能被溶瘤病毒感染,但不允许病毒复制。因此,成纤维细胞成为了充当溶瘤病毒的诱饵库,减少传染性病毒粒子向癌细胞的传递。另一种机制是癌细胞对凋亡的敏感性,这可能是由病毒感染或其他因素引起的。如果细胞凋亡速度过快,这将减少病毒复制和繁殖的时间,并减少肿瘤中活性病毒的量,最终限制肿瘤内活性剂量。
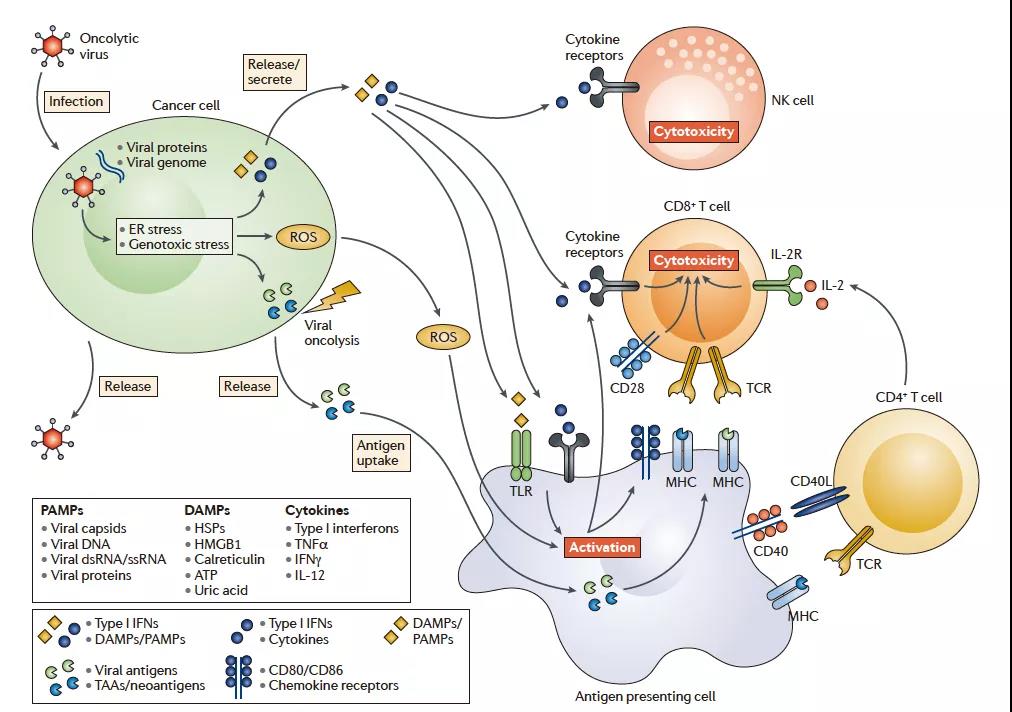
溶瘤病毒诱导局部和全身抗肿瘤免疫
这段要边看上图边读文字
溶瘤病毒的治疗功效取决于直接的癌细胞裂解作用和抗肿瘤免疫应答的间接激活作用。溶瘤病毒感染后,癌细胞会发起由内质网(ER)和遗传毒性应激组成的抗病毒反应。这种反应导致活性氧(ROS)的上调和抗病毒细胞因子产生的开始。ROS和细胞因子,特别是I型干扰素(IFN),从被感染的癌细胞中释放出来并刺激免疫细胞(抗原呈递细胞,CD8 + T细胞和自然杀伤(NK)细胞)。随后,溶瘤病毒引起溶瘤,释放病毒后代,病原体相关分子模式(PAMP),危险相关分子模式信号(DAMPs)和肿瘤相关抗原(TAA),包括新抗原。病毒后代的释放遗传了溶瘤病毒的感染。PAMP(由病毒颗粒组成)和DAMP(由宿主细胞蛋白组成)通过触发诸如Toll样受体(TLR)的激活受体来刺激免疫系统。在由此产生的免疫刺激环境中,TAA和新抗原被抗原呈递细胞释放并吸收。这些事件共同导致针对病毒感染的癌细胞的免疫反应的产生,以及针对未感染癌细胞上展示的TAA /新抗原的从头免疫反应。
▉ 溶瘤病毒成药策略介绍
溶瘤病毒靶向癌细胞的策略
1:溶瘤病毒对癌细胞异常表达的细胞表面蛋白具有天然趋向性(tropism)。对于这种情况,我们直接通过病毒对不同类型的癌细胞的选择使用不同类型的病毒作为载体即可。
2:设计为直接靶向癌细胞表达的独特细胞表面受体。腺病毒Ad5/3-&δ;24,其经过修饰可与在卵巢癌细胞上高表达的整联蛋白结合。在经过修饰以后在高表达特定的信号使其对癌细胞表面的受体高度亲和,从而做到靶向癌细胞。
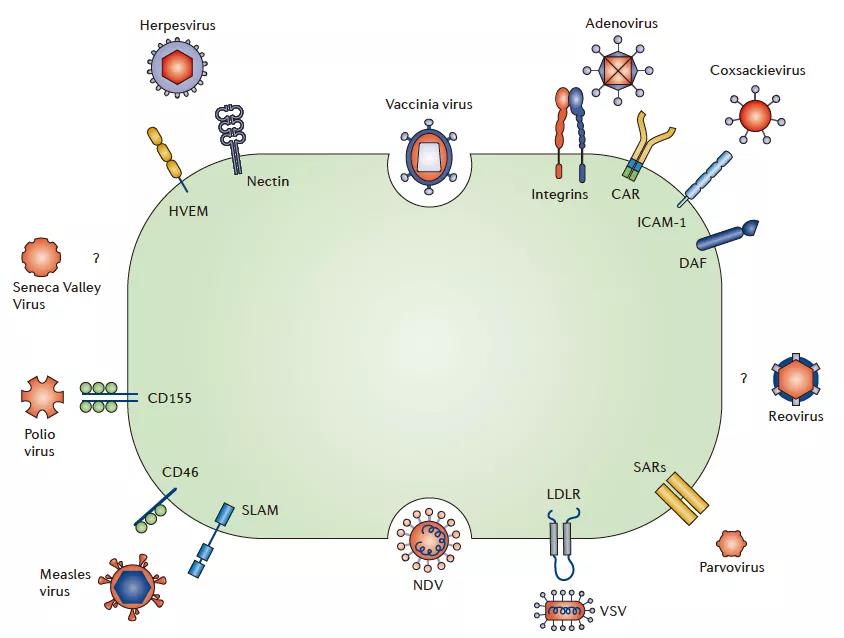
不同病毒进入癌症细胞的方式
减轻病毒的发病机理
因为溶瘤病毒疗法作为活病毒给药,导致机体发生免疫原性反应与个人的免疫系统相关,可能会产生不同的效果,虽然临床试验中很少有报道严重的不良事件,但是以活病毒给药还是要重视其风险性。
工程化减毒溶瘤病毒的一个例子是基于HSV-1的T-VEC。已知HSV-1会引起神经毒力和潜伏感染。毒性由病毒基因产物ICP34.5介导。ICP34.5在T‑VEC中被删除,这意味着它不应在神经元内生长或介导潜伏感染。迄今为止,还没有任何关于T-VEC或其他减毒HSV-1载体潜在感染的报道。

增加抗肿瘤的免疫原性(最大程度刺激机体对肿瘤的免疫反应)
例如,促炎性细胞因子和/或T细胞共刺激分子的病毒表达可以增强抗肿瘤免疫反应。对于诸如HSV-1,腺病毒和牛痘病毒等病毒,已经很好地描述了这种策略。小鼠HSV-1研究表明,只有将GM-CSF(一种促进树突状细胞蓄积和成熟的细胞因子)设计到病毒基因组中,才能排斥对侧未注射的肿瘤。
▉ 总结
溶瘤病毒在某些方面与标准药物不同。它们是活病毒,经临床给药后会繁殖。这可能导致有效剂量可变。目前,关于将病毒剂量与体内复制潜力和治疗反应相关的数据很少。在相关的临床前模型和临床试验中,有关病毒复制和临床反应的进一步研究对于建立安全有效的剂量指导方针很重要。
溶瘤病毒不会因细胞代谢或与循环蛋白结合而被清除;相反,它们会遭受宿主抗病毒免疫反应。在这方面,需要考虑多个因素,包括预先存在的中和抗体滴度,病毒特异性记忆T细胞反应,通过血凝素结合而使某些病毒丧失能力的可能性以及某些病毒逃避免疫检测的先天能力。此外,许多肿瘤微环境具有高度的免疫抑制作用,这可能会限制宿主的免疫反应。进一步研究评估既存的抗病毒免疫力和诱导针对病毒载体和肿瘤相关抗原的治疗后免疫应答的方法,对于更好地了解癌症患者溶瘤病毒如何清除和控制的动态将是重要的。
参考文献:
https://www.nature.com/articles/nrd4663