地舒单抗助力外科手术降期 为GCTB患者保驾护航
骨巨细胞瘤(GCTB)是一种局部侵袭性、以溶骨性破坏为主的交界性原发骨肿瘤。外科手术是其标准的治疗手段,但部分患者可能因病变切除术造成潜在功能缺陷或严重并发症。目前,核因子κB受体活化因子配体(RANKL)抑制剂地舒单抗已在我国获批上市,用于治疗不可手术切除或手术切除可能导致严重功能障碍的GCTB,开启了GCTB靶向治疗新篇章,为广大GCTB患者带来了治疗新希望。本期将分享一例地舒单抗在GCTB新辅助治疗中应用的病例。
本期专家

郑炳鑫
青岛大学附属医院骨肿瘤科,医学博士
毕业于北京大学医学部
主要从事骨肿瘤的外科治疗及相关基础研究。
以第一作者发表SCI论文4篇
累计IF大于25分,单篇最高IF 11.059
基本情况
一般情况:患者,男性,28岁。
主诉:左踝关节疼痛半年余。
现病史:患者半年前无明显诱因出现左踝关节疼痛不适,无肢体麻木感,无肢体肿胀,无皮肤感觉障碍,于当地医院就诊,行左踝关节MR平扫示左侧胫骨内侧髁关节面下占位性病变,考虑肿瘤可能性大。患者来我院求进一步诊治,门诊以“肢体肿物(左胫骨远端)”收入院。患者自发病以来,精神可,饮食可,睡眠可,大小便正常,体重无明显增减。
既往史:无特殊。
个人史:吸烟史4年,每天10支左右,偶尔饮酒,其余无特殊。
家族史:无特殊。
体格检查:左踝未扪及明显肿物,左踝关节活动部分受限,无肢体红肿,无皮肤感觉障碍,左下肢肌力正常,余肢体无明显异常。
辅助检查:左踝MRI(2020-09-03):左侧胫骨内侧髁关节面下见团块状T1WI等信号、T2压脂不均匀高信号影,内见多发囊腔;病变大小约为27 mm(前后)×39 mm(左右)×45 mm(上下),边界清楚,病变后缘向后膨隆,周围软组织见条片状压脂高信号影(T2WI脂肪抑制序列病变周边高信号),环绕胫骨下端周长2/3。左侧胫骨内侧髁关节面下占位性病变,考虑骨巨细胞瘤可能性大(图1~3)。

图1:左踝MRI(2020-09-03)

图2:左踝MRI(2020-09-03)

图3:左踝MRI(2020-09-03)
临床诊断:1.骨巨细胞瘤(左胫骨远端,Campanacci 三期);2.无肺转移。
治疗经过
01
第一阶段 | 术前新辅助治疗:功不可没——地舒单抗实现外科手术降期
术前给予地舒单抗(120 mg,ih,术前第0、8、15天)新辅助治疗,进行外科手术降期,便于术中肿瘤刮除时保留关节面功能。
疗效评价
地舒单抗治疗后,复查左踝MRI提示:左侧胫骨内侧髁关节面下占位性病变,与2020-09-03 MRI对比,胫骨远端病变内T2WI高信号范围减小(图4~6)。

图4:左踝MRI(地舒单抗治疗后)

图5:左踝MRI(地舒单抗治疗后)

图6:左踝MRI(地舒单抗治疗后)
进一步完善CT检查提示:胫骨远端病变内不规则高密度影,成骨明显(图7~9)。

图7:左踝CT(地舒单抗治疗后)

图8:左踝CT(地舒单抗治疗后)

图9:左踝CT(地舒单抗治疗后)
接受地舒单抗治疗后,患者疼痛症状明显缓解,随访临床关键指标显示,疼痛指趾评分(NRS)稳定下降(图10),血钙、肌酐均在正常范围内波动良好(图11~12)。治疗过程中患者耐受性良好,无明显不良反应。

图10:NRS评分变化曲线
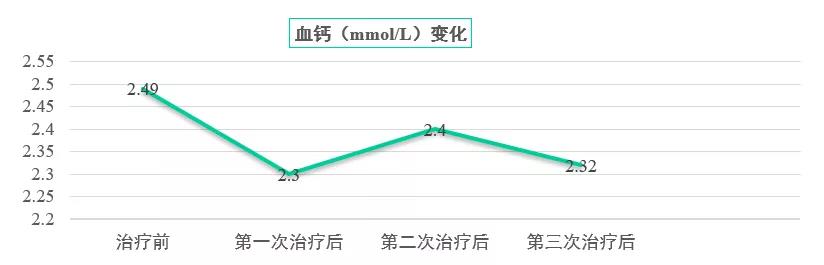
图11:血钙水平变化曲线(单位:mmol/L)
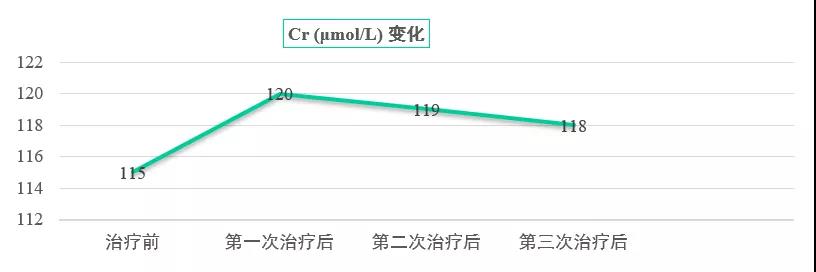
图12:肌酐水平变化曲线(单位:μmol/L)
02
第二阶段 | 外科手术治疗:不负众望——成功保留踝关节功能
术中探查见髓腔内灰白色肿瘤组织,质地较软,局部成骨硬化。
肿瘤组织送术后病理学检查示:(左踝关节肿瘤)镜下见肿瘤构成于短梭形细胞,成骨明显,新生骨小梁间见较密集的梭形细胞增生,未见确切多核巨细胞;结合临床病史、影像学资料及免疫组化结果,符合骨巨细胞瘤(地舒单抗治疗后改变)。
免疫组化:H3.3G34W(+),H3K36M(-),P63(+),CD68(组织细胞+),Ki-67阳性率约5%,SATB2(+),S-100(-),CK(-)。
病例总结
本例患者为年轻男性,确诊为左侧胫骨远端GCTB。患者病灶范围较大,且累及后踝关节面,胫骨后侧皮质膨胀破坏变薄,应首选保关节的治疗方案,保留踝关节功能。
术前应用地舒单抗三次(120mg,ih,q1w),疗效显著,复查MRI提示胫骨远端病变内T2WI高信号范围减小;CT提示病变内不规则高密度影,成骨明显。
治疗后患者疼痛症状明显缓解,随访临床关键指标显示,NRS评分稳定下降,血钙、肌酐均在正常范围内波动良好。同时患者耐受性良好,无明显不良反应。
患者随后接受降期手术,同时术中探查见髓腔内灰白色肿瘤组织,质地较软,局部成骨硬化;术后病理显示肿瘤构成于短梭形细胞,成骨明显,新生骨小梁间见较密集的梭形细胞增生,未见确切多核巨细胞。
地舒单抗新辅助治疗为GCTB患者带来显著获益,不仅抑制肿瘤生长,减少骨破坏;而且促进新生骨形成,使肿瘤边界硬化清晰,便于术中肿瘤刮除,降低复发几率;同时成功保留了关节面功能,为 GCTB患者的健康保驾护航。
专家点评

岳斌 副主任医师
青岛市医学会骨科学分会骨肿瘤学组主任委员
山东省医学会骨科学分会骨肿瘤青年委员会副主任委员
青岛市医学会骨科学分会副主任委员
青岛市医学会骨科青年委员会副主任委员
山东省医学会骨科学分会骨肿瘤学组委员
山东省医师学会骨科学分会骨肿瘤学组委员
国家医师学会骨肿瘤学组委员
中国整形美容协会肿瘤整形分会委员
中国医药教育协会骨与软组织肿瘤专业委员会委员
中国生物材料学会骨再生材料学组委员
残疾人保肢协会关节学组委员
中国老年学和骨质疏松学会骨肿瘤学组委员
GCTB是一种具有局部侵袭性的原发良性骨肿瘤,约占所有原发骨肿瘤的5%,占良性骨肿瘤的20%1,以溶骨性破坏为主,个别病例具有转移和恶变的潜能2。手术是GCTB的主要治疗手段,但难治性特殊部位如脊柱、骨盆等,术后局部复发率高,且常因解剖复杂、术中出血多等原因而无法行手术治疗;同时,广泛切除术在去除肿瘤、降低局部复发风险的同时,可能引起功能障碍和严重并发症,影响患者身心健康,降低患者生活质量3-4。
GCTB主要包括破骨细胞样巨细胞和单核基质细胞两种成分,破骨细胞样巨细胞过度表达RANK,单核基质细胞表达高水平的RANKL5。其中,RANKL是启动破骨进程的关键因子6,通过与RANK结合,在破骨细胞的形成、功能及存活中发挥重要作用,从而导致GCTB破骨细胞活性增强,产生溶骨性病变7-8。
地舒单抗是RANKL的全人源单克隆抗体,通过靶向结合RANKL并抑制其活性,阻止RANKL介导的破骨细胞和破骨细胞样巨细胞的形成和活化,从而抑制肿瘤细胞生长,减少骨质破坏9。地舒单抗治疗GCTB的两项关键临床试验——Study 20040215(NCT00396279)10和Study 20062004(NCT00680992)11均发表于国际顶级肿瘤学期刊《柳叶刀·肿瘤学》(Lancet Oncol)上,研究一致证实了地舒单抗能够有效控制GCTB进展,改善患者疼痛。
同时,地舒单抗还能促进新生骨形成,使病灶边界硬化5,10,术前进行地舒单抗新辅助治疗能够有效减小肿瘤体积,使肿瘤边界更清晰,降低病灶部位血运,降低手术难度,实现外科手术降级,减少肿瘤残留,降低复发几率12-14。针对Study 20062004的回顾性分析显示,对于可行手术切除的GCTB患者,接受地舒单抗新辅助治疗后,38%的患者实现了手术降期治疗,其中包括80%原计划行半骨盆切除的患者,以及80%计划截肢的患者;并且有48%的患者避免了手术治疗15。一项探索GCTB手术保留关节策略的研究也证实,接受地舒单抗新辅助治疗后90%(18/20)的患者成功保留了关节16。
目前,地舒单抗(商品名:安加维®)已在我国获批用于治疗不可手术切除或手术切除可能导致严重功能障碍的GCTB。2020中国临床肿瘤学会(CSCO)《GCTB诊疗指南》明确将地舒单抗作为Ⅰ级推荐用于不可切除GCTB的治疗;同时作为Ⅱ级推荐用于可切除GCTB的术前用药。本例患者为年轻男性,确诊左侧胫骨远端GCTB,给予地舒单抗新辅助治疗后,成功实现了外科手术降期,保留了关节功能;并且地舒单抗治疗期间,患者疼痛明显缓解,NRS评分稳定下降,血钙、肌酐水平正常,无不良反应发生;同时,地舒单抗治疗后随访影像学显示病灶缩小,成骨明显,术中见病灶局部成骨硬化,证实了地舒单抗在GCTB中减少骨质破坏,促进新生骨形成的显著疗效;此外,地舒单抗通过皮下注射,给药方便,极大提高了患者的治疗依从性。
综上所述,在临床实践中,尤其是对于近关节面、脊柱或骨盆的GCTB,给予地舒单抗新辅助治疗,实现外科手术降期,能够减少或避免手术可能造成的潜在功能障碍或严重并发症,在切实延长患者生存的同时,最大程度改善患者的生活质量。
参考文献
1.Niu X, Yang Y, Wong KC, Huang Z, Ding Y, Zhang W. Giant cell tumour of the bone treated with denosumab: How has the blood supply and oncological prognosis of the tumour changed? J Orthop Translat. 2018 Nov 7;18:100-108.
2.Dominkus M, Ruggieri P, Bertoni F, Briccoli A, Picci P, Rocca M, Mercuri M. Histologically verified lung metastases in benign giant cell tumours--14 cases from a single institution. Int Orthop. 2006 Dec;30(6):499-504.
3.Khalil el SA, Younis A, Aziz SA, El Shahawy M. Surgical management for giant cell tumor of bones. J Egypt Natl Canc Inst. 2004 Sep;16(3):145-52.
4.Rastogi S, Prashanth I, Khan SA, Trikha V, Mittal R. Giant cell tumor of bone: Is curettage the answer? Indian J Orthop. 2007 Apr;41(2):109-14.
5.Mak IW, Evaniew N, Popovic S, Tozer R, Ghert M. A 转录 Study of the Neoplastic Cells of Giant Cell Tumor of Bone Following Neoadjuvant Denosumab. J Bone Joint Surg Am. 2014 Aug 6;96(15):e127.
6.Huang L, Xu J, Wood DJ, Zheng MH. Gene expression of osteoprotegerin ligand, osteoprotegerin, and receptor activator of NF-kappaB in giant cell tumor of bone: possible involvement in tumor cell-induced osteoclast-like cell formation. Am J Pathol. 2000 Mar;156(3):761-7.
7.Atkins GJ, Kostakis P, Vincent C, Farrugia AN, Houchins JP, Findlay DM, Evdokiou A, Zannettino AC. RANK Expression as a cell surface marker of human osteoclast precursors in peripheral blood, bone marrow, and giant cell tumors of bone. J Bone Miner Res. 2006 Sep;21(9):1339-49.
8.Cowan RW, Singh G. Giant cell tumor of bone: a basic science perspective. Bone. 2013 Jan;52(1):238-46. doi: 10.1016/j.bone.2012.10.002. Epub 2012 Oct 9.
9.Dufresne A, Derbel O, Cassier P, Vaz G, Decouvelaere AV, Blay JY. Giant-cell tumor of bone, anti-RANKL therapy. Bonekey Rep. 2012 Sep 5;1:149.
10.Thomas D, Henshaw R, Skubitz K, Chawla S, Staddon A, Blay JY, Roudier M, Smith J, Ye Z, Sohn W, Dansey R, Jun S. Denosumab in patients with giant-cell tumour of bone: an open-label, phase 2 study. Lancet Oncol. 2010 Mar;11(3):275-80.
11.Chawla S, Henshaw R, Seeger L, Choy E, Blay JY, Ferrari S, Kroep J, Grimer R, Reichardt P, Rutkowski P, Schuetze S, Skubitz K, Staddon A, Thomas D, Qian Y, Jacobs I. Safety and efficacy of denosumab for adults and skeletally mature adolescents with giant cell tumour of bone: interim analysis of an open-label, parallel-group, phase 2 study. Lancet Oncol. 2013 Aug;14(9):901-8.
12.杨勇昆,黄真,丁宜,张文,徐海荣,刘巍峰,牛晓辉.术前应用地舒单抗对骨巨细胞瘤瘤体血运的影响[J].中国骨与关节杂志,2019,8(9):667-671.
13.杨毅,郭卫,杨荣利,汤小东,燕太强,姬涛,梁海杰,陈忠岩. 地诺单抗联合手术治疗桡骨远端骨巨细胞瘤——外科降级及预后[J]. 骨科,2018,01:1-6.
14.van der Heijden L, van de Sande MA, Hogendoorn PC, Gelderblom H, Dijkstra PD. Neoadjuvant denosumab for extensive giant cell tumor in os ischium: a case report. Acta Orthop. 2015 Jun;86(3):393-5.
15.Rutkowski P, Ferrari S, Grimer RJ, Stalley PD, Dijkstra SP, Pienkowski A, Vaz G, Wunder JS, Seeger LL, Feng A, Roberts ZJ, Bach BA. Surgical downstaging in an open-label phase II trial of denosumab in patients with giant cell tumor of bone. Ann Surg Oncol. 2015 Sep;22(9):2860-8.
16.Traub F, Singh J, Dickson BC, Leung S, Mohankumar R, Blackstein ME, Razak AR, Griffin AM, Ferguson PC, Wunder JS. Efficacy of denosumab in joint preservation for patients with giant cell tumour of the bone. Eur J Cancer. 2016 May;59:1-12.