3岁女童因罕见眼癌去世!如何挽救?“黑科技”质子治疗及CAR-T疗法力挽狂澜
早在2017年9月,网上就在疯传3岁的王凤雅小朋友因视网膜母细胞瘤逝世的消息。关于其母诈捐、虐待、重男轻女等是长短非也不竭反转,到如今还是一场罗生门。
然而小编今天要讲的并不是这则新闻,而是这个确诊仅8个月就扼杀了小凤雅生命的罪魁祸首——视网膜母细胞瘤。
俗称“猫眼”的恶性肿瘤,早期治疗效果极佳
视网膜母细胞瘤,是儿童最常见的眼部恶性肿瘤,每15000个新生儿中会有1个罹患视网膜母细胞瘤,平均发病年龄在2岁左右。
视网膜母细胞瘤长在视网膜上,来源是视网膜母细胞。这种胎儿的原始细胞,本来可以分化发育成成熟的视网膜细胞,从而拥有感受光线、形成视力的能力,但由于生殖细胞RB1抑癌基因突变,导致视网膜母细胞失去了分化成视网膜细胞的能力,成为迅速分裂增殖、不受控制的癌细胞。
起初,视网膜母细胞瘤在早期很难被家长发现,往往会在照相打光时发现孩子的一个瞳孔有异常的黄白色反光,专业上的说法叫做“黑矇猫眼”。若在此时采取治疗措施,患儿的5年生存率相当高(在发达国家,视网膜母细胞瘤的5年生存率达到95%,我国患儿5年生存率偏低,大约在63%),而且眼球的视力大多能够保护下来。
众多疗法中对放射线较敏感,建议首选质子治疗
目前,能够保留视网膜母细胞瘤患儿眼球的治疗方式包括冷冻消融术、激光治疗、化疗及放疗等。此病属于放射敏感性肿瘤,放疗通常作为挽救性治疗方式,但是常规的光子束治疗会升高放射诱导性第二恶性肿瘤发生风险,尤其是携带遗传性RB基因突变的儿童。
此外,常规的放疗会产生长期的毒性反应,主要包括结膜炎、角膜混浊、白内障、青光眼、玻璃体出血、视网膜病变、视神经病变以及眼眶发育不全等。
多种适形放疗技术(立体定向放疗、调强放疗、质子治疗)已经应用于视网膜母细胞瘤的治疗,以保护危及器官并减少放疗相关毒性反应。有研究表明,质子治疗是目前用于视网膜母细胞瘤的高度适形性外照射放疗选择。
儿童眼癌的新选择——质子治疗
质子治疗已经是传统放疗的一个公认的替代方案,并且能够降低对邻近组织如脑、视神经,以及正在生长的面部和眼眶骨骼造成损伤的风险。在某些情况下,质子治疗与化疗联合能够避免眼球摘除的风险。质子治疗所传递的聚焦放射剂量对于那些具有经辐射诱发的继发性肿瘤遗传倾向的儿童视网膜母细胞瘤患者非常重要。

质子疗法治疗视网膜母细胞瘤示意图
1
实锤1:局部控制率高、副作用小
为了探究经质子治疗后视网膜母细胞瘤患儿的长期疾病和毒性结果,一项回顾性研究对1986~2012年间接受质子治疗的49例视网膜母细胞瘤患者进行了分析。84%的患者得的是双侧性视网膜母细胞瘤,并且有几乎一半的患者接受过化疗。

中位随访时间8年,质子治疗后无眼球摘除生存率为81.6%,特别是那些早期患者。质子治疗后的眼科随访结果表明61%(30/49)的患者保留了眼球,47%的患者恢复了视觉灵敏度,并且没有患者罹患继发性肿瘤。
对接受质子治疗的视网膜母细胞瘤患者的长期随访结果阐明了质子治疗的局部控制率高,甚至是对晚期病例,同时保留了大部分患者的有用视力。治疗相关的眼部副作用并不常见,也没有发生放疗诱导的恶性肿瘤。
2
实锤2:最佳靶区覆盖率和最大眶骨保留
无论是局部或是全眼治疗,质子治疗都是视网膜母细胞瘤患者的一个不错的治疗选择。来自MD安德森癌症中心的一项回顾性研究中,对全视网膜和玻璃体腔给予36Gy/18F的放射剂量能为患者提供最佳的靶区覆盖率和最大的眶骨保留。

研究表明,在提供100%的靶区覆盖的同时,当照射剂量≥5Gy时,质子能够将受到照射的平均眼眶体积限制在10%左右,而三维适行放射治疗(3D-CRT)为25%,调强适形放射治疗(IMRT)为69%。
综上所述,在视网膜母细胞瘤中,质子治疗能够提供最佳的靶标覆盖率和最多的眶骨保留,这样的低剂量足以潜在地降低眶骨生长缺陷的可能性。
3
实锤3:辐射剂量较低,保证眼功能最大化
一项关于质子束放射治疗(PBRT)6例眼内肿瘤患者的临床研究中,共有3例视网膜母细胞瘤患者。

研究结果显示,与传统的光子放射疗法(EBRT)相比,PBRT具有物理优势。在下图的典型病例示意图中,传统光子治疗在眼内靠近肿瘤的部位剂量较大,而且后眼眶和脑内肿瘤远端的剂量也明显高于质子治疗。

研究表明,在维持眼球的情况下,质子束具有比常规光子束更低的辐射剂量,而且最终可以使眼功能最大化。
质子治疗对于儿童肿瘤适应症更为广泛
室管膜瘤、颅咽管瘤、髓母细胞瘤、横纹肌肉瘤、神经母细胞瘤、视网膜母细胞瘤、视神经脑膜瘤、PNET/低级别胶质瘤次全切除术后;
质子可减少认知功能损伤、减少耳蜗剂量、减少听力损伤;
脑和脑干高级别胶质瘤,可用质子,但难以达到真正肿瘤边界,难以实现适形。
CAR-T疗法与水凝胶联手抗眼癌疗效显著,且不损视力
除了上面所说的质子治疗外,针对视网膜母细胞瘤,CAR-T疗法国际上有最新研究。10月12日,在国际知名医学杂志《Nature Cancer》上发表了一篇新的研究成果,来自美国北卡罗来纳大学Lineberger综合癌症中心的研究学者发现,靶向神经节苷脂GD2的CAR-T细胞在结合IL-15的局部释放和可注射水凝胶使用时,可以成功消除视网膜母细胞瘤细胞,且不会损伤小鼠的视力。

人视网膜母细胞瘤中表达神经节苷脂GD2,但正常人视网膜中并不表达这种物质。虽然GD2 CAR-T在某些神经母细胞瘤患者中具有良好的耐受性并产生了临床益处,但是靶向GD2是否能安全消除眼内肿瘤的可能性尚不清楚。
为了测试靶向GD2的安全性和益处,研究人员将GD2 CAR-T注入了视网膜母细胞瘤异种移植小鼠模型的视网膜中,结果显示肿瘤的发展被延缓,但未能消除肿瘤。
随后研究人员构建了能分泌IL-15的CAR-T细胞。结果表明,添加IL-15不会导致使用CD19 CAR-T治疗的小鼠视网膜母细胞瘤消退,但表达IL-15的GD2 CAR-T具有显著改善的抗肿瘤作用,其中60%的治疗组小鼠直到第70天仍保持无瘤。
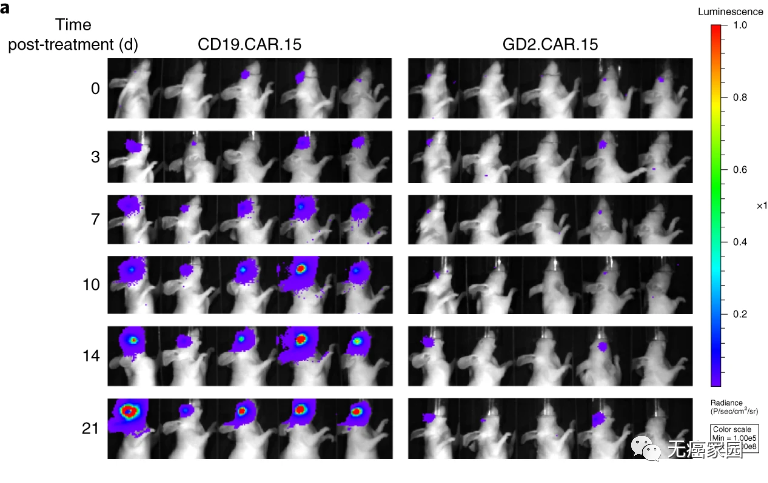
为了增强CAR-T细胞在肿瘤细胞中的持久性,研究人员选择了壳聚糖-聚乙二醇(PEG)热敏水凝胶,作为在眼睛内递送CAR-T的最佳可注射水凝胶。
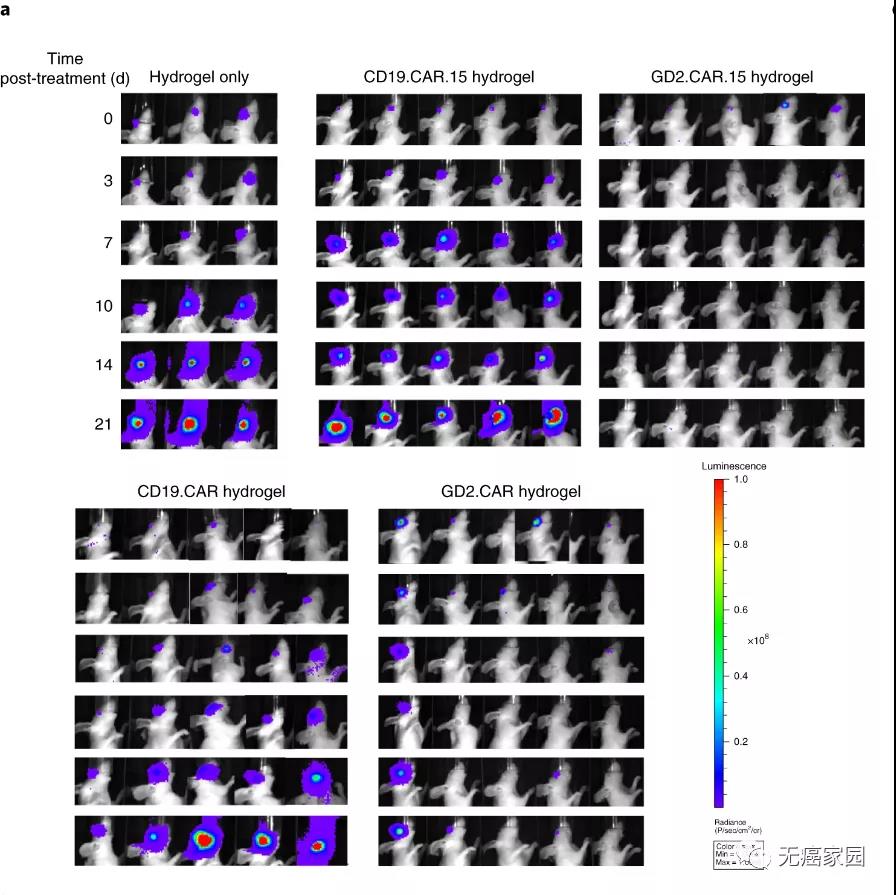
这种水凝胶可显著改善GD2 CAR-T的抗肿瘤作用,不仅可以完全控制肿瘤生长和预防肿瘤复发,还可以改善视网膜的结构恢复。
目前,这种凝胶封装疗法正在神经母细胞瘤儿童中进行临床试验。目前国内正在积极开展实体瘤的CAR-T临床研究。若想若想参加可以咨询无癌家园申请参与CAR-T实体肿瘤的临床试验。
小编有话说
除了采用建议用质子治疗罕见眼癌外,近年来,科学家们已经做出了相当大的努力来开发新的方法攻克实体瘤的障碍,并采用优化策略用于针对这些特定适应症的CAR-T疗法。我们期待着,越来越多的临床前/临床试验数据能够拼凑出一幅完整的拼图,充分展示CAR-T细胞疗法治疗实体瘤的真正实力。
参考文献
1.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6935184/#CR18
2.https://www.redjournal.org/article/S0360-3016(05)00289-0/fulltext
3.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5897156/
4.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4253018/
5.https://www.floridaproton.org/cancers-treated/pediatric-cancer/retinoblastoma
6.https://www.nature.com/articles/s43018-020-00119-y