K药突破乳腺/结肠癌瓶颈 癌症疫苗GX-188E显疗效, 未来可期!
免疫疗法开启了肿瘤治疗的新纪元。其中,最闪耀的明星药物之一——帕博利珠单抗(Pembrolizumab,K药),是最早在欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)获批的PD-1抑制剂,也是截止到目前获批适应证最多的PD-1抑制剂。
2020年接近尾声,而帕博利珠单抗的喜报却接连传来。国际最顶级医学期刊《柳叶刀》和《新英格兰医学杂志》分别报道了帕博利珠单抗单用或者联合治疗在晚期三阴性乳腺癌和MSI-H/dMMR型晚期结直肠癌的最新抗癌效果!
01
K药联合化疗显著提高PD-L1高表达晚期三阴性乳腺癌患者无进展生存期
三阴性乳腺癌是乳腺癌中最难治疗的亚型,目前大多数患者仍以化疗为主。然而接受化疗的患者也容易复发,总体治疗效果一般。
近期《柳叶刀》上发表的KEYNOTE-355研究报告,比较了帕博利珠单抗+化疗或者安慰剂+化疗一线治疗局部复发不可手术或远处转移三阴性乳腺癌的抗肿瘤活性和安全性。
2017年1月9日-2018年6月12日,该国际多中心、双盲、随机对照III期临床研究入组了来自29个国家地区209家医院的847例患者,按2∶1随机分为两组:帕博利珠单抗+化疗组566例(白蛋白结合型紫杉醇、紫杉醇或吉西他滨+卡铂);安慰剂+化疗组281例(本文为中期分析,对PFS进行最终评定;OS随访仍在继续。)
结果显示:截至2019年12月11日中期分析时,总体的两组中位随访时间分别为25.9个月和26.3个月。在根据PD-L1表达分类(CPS分数)的不同人群中,帕博利珠单抗+化疗组和与安慰剂组的治疗效果如下:
CPS≥10:9.7个月 vs 5.6个月(HR:0.65,95%CI:0.49-0.86,单侧P=0.0012,达到主要终点);
CPS≥1:7.5个月 vs 5.6个月(HR:0.74,95%CI:0.61-0.90,单侧P=0.0014,不显著);
意向治疗人群:7.6个月 vs 5.6个月(HR:0.82,95%CI:0.69-0.97,未检验)。
该研究结果还表明,帕博利珠单抗的治疗效果随着PD-L1表达水平增加而提高。因此对于PD-L1高表达的晚期三阴性乳腺癌患者,帕博利珠单抗+化疗与化疗相比PFS有显著改善。
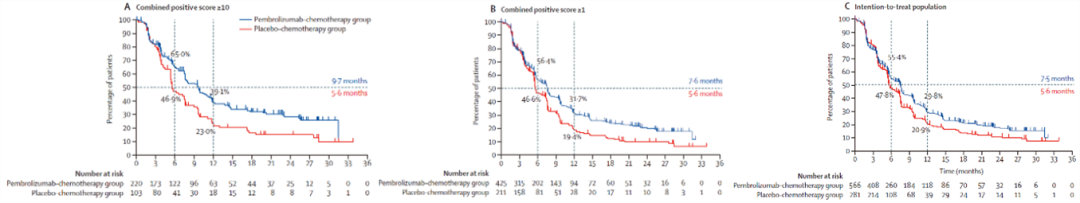
帕博利珠单抗+化疗VS安慰剂+化疗的无进展生存期:(A)PD-L1阳性CPS≥10;(B) PD-L1阳性CPS≥1;(C)意向治疗人群
02
一线用药,K药治疗MSI-H/dMMR型晚期结直肠癌效果优于化疗
近期《新英格兰医学杂志》发布了帕博利珠单抗(K药)治疗(MSI-H/dMMR)结直肠癌的KEYNOTE-177研究的第二次中期分析结果,直接比较了一线PD-1治疗和化疗在这类癌症患者中的疗效。
这项III期试验共纳入307例既往未接受过治疗的MSI-H/dMMR转移性结直肠癌患者,随机分为帕博利珠单抗或化疗组。
经过32.4个月的中位随访时间,帕博利珠单抗组的中位无进展生存期(PFS)远超化疗组达到两倍(16.5 vs 8.2个月,HR 0.60,P=0.0002)!
从总体缓解率(ORR)来看,帕博利珠单抗组合化疗组ORR分别为43.8%和33.1%。在总体缓解(OR)的患者中,帕博利珠单抗组有83%的患者在24个月内都有持续缓解,化疗组则只有35%。
此外帕博利珠单抗组的3级及以上治疗相关不良事件的发生率为22%,而化疗组的发生率为66%。
综上所述,帕博利珠单抗一线治疗MSI-H-dMMR转移性结直肠癌展现出PFS和ORR双获益,并且毒副作用低于常规化疗。基于该研究结果,美国食品药品监督管理局(FDA)已经批准了相应的适应证,特定的晚期结直肠癌人群一线治疗喜迎免疫治疗新方案。
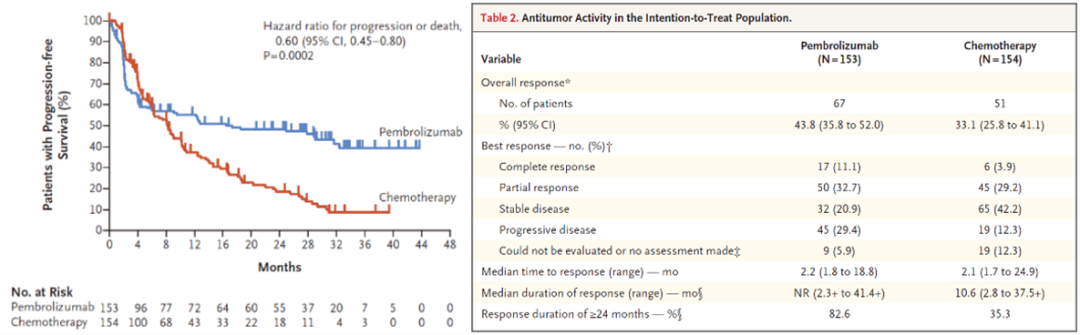
左:晚期结直肠癌的PFS;右:意向治疗人群的抗肿瘤活性比较
03
K药联合治疗性DNA疫苗GX-188E,为晚期宫颈癌患者带来新的可能性
上周我们介绍了新型肿瘤疫苗GP2实现乳腺癌患者术后5年无复发的神奇效果,为患者带来福音。详情参考:突发!新型肿瘤疫苗GP2实现癌症患者5年无一例复发,乳腺癌迎来治愈新曙光
其实不仅是HER2阳性乳腺癌,近期肿瘤疫苗在其它癌症类型中也有重大突破。
复发或晚期宫颈癌患者的生存结局很不理想。帕博利珠单抗(K药)已被美国FDA批准用于治疗复发或转移性宫颈癌,在其关键临床试验中的总缓解率为14.3%。而早期研究中,治疗性DNA疫苗GX-188E已经证明可以在癌前病变患者中诱导特异性T细胞应答,并缓解宫颈病变。
近期《柳叶刀-肿瘤学》的一项临床研究探索了GDX-188E联合K药在HPV-16或HPV-18阳性的晚期宫颈癌中治疗效果。
这项单臂II期试验共入组36例复发或晚期无法手术的宫颈癌成人患者,这些患者接受了GDX-188E和帕博利珠单抗的组合治疗。在中期分析时,共有26例患者的数据可供评估。截至2020年3月30日,中位随访时间为6.2个月。
联合疗法显示出初步的抗肿瘤活性:在治疗24周时,26例患者中有11例(42%)达到了缓解,包括4例(15%)完全缓解,7例(27%)部分缓解。这一总缓解率高于帕博利珠单抗单药治疗的缓解率。11例缓解患者中,有10人为PD-L1阳性;PD-L1阳性患者的总缓解率为50%。
试验疗法总体安全性良好,治疗相关的不良事件可控。没有报告治疗相关死亡。这项临床研究仍在继续,期待有更好的消息。
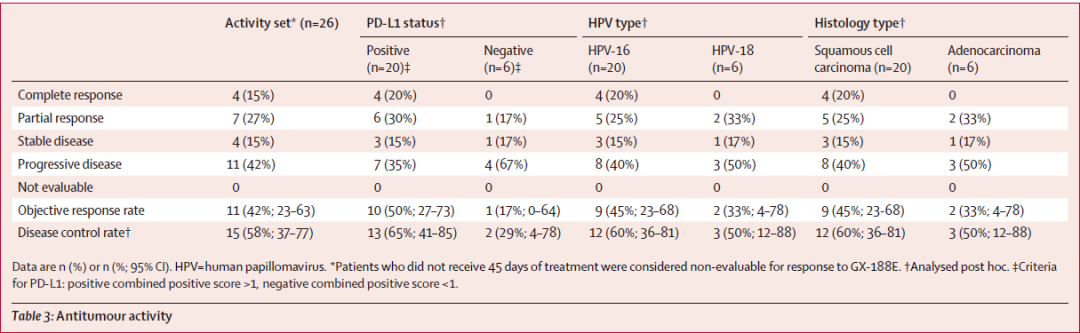
GX188E联合K药抗肿瘤反应
04
微卫星不稳定肿瘤的共有移码突变为癌症疫苗设计提供新思路
微卫星不稳定是一种细胞DNA错配修复缺陷所导致的微卫星区域DNA序列发生插入或缺失的现象,主要发生在结直肠癌和子宫内膜癌,也散发于其它癌症。发生在微卫星区域的DNA碱基插入或缺失一些情况下经过转录和翻译会产生移码突变的蛋白产物。
近期发表在《细胞》的一项研究发现,这种移码突变在不同的高微卫星不稳定(MSI-H)肿瘤能够产生“共有的”具有高度免疫原性的抗原表位,根据这些表位设计的癌症疫苗在体外能够诱导T细胞免疫反应。
通过分析TCGA数据库中的肿瘤全外显子测序结果,来自美国西奈山伊坎医学院的Nina Bhardwaj团队发现高微卫星不稳定的子宫内膜癌、结直肠癌以及胃癌患者具有大量移码突变。他们进一步分析在三种癌症中分别找到了9、37和23个共有并且具有多抗原表位的突变,值得一提的是其中有5个突变是所有患者都共有的。
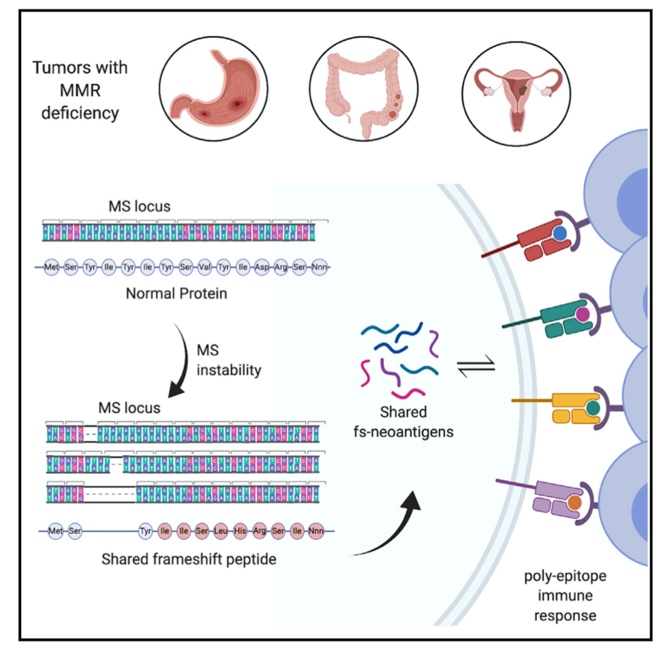
MSI-H胃癌、结直肠癌和子宫内膜癌由于微卫星不稳定产生“共有的”多抗原表位移码突变
为了确定这些突变能够作为癌症疫苗的靶点,他们检测了这些突变的表达和抗原可递呈性,结果表明这些共有突变确实能够被肿瘤细胞表达并递呈到表面。最后他们根据这些突变设计了多肽疫苗,体外实验表明这种疫苗能够诱导健康人和癌症患者外周血单核细胞产生CD8 T细胞免疫反应。
该团队表示,这种疫苗能够为MSI-H癌症患者带来更好的免疫治疗效果,也可以作为如Lynch综合征患者的高风险人群的癌症预防手段。
参考文献:
[1]. Cortes J, Cescon DW, Rugo HS,et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy forpreviously untreated locally recurrent inoperable or metastatic triple-negativebreast cancer(KEYNOTE-355): a randomised, placebo-controlled, double-blind,phase 3 clinical trial. Lancet. 2020;396(10265):1817-1828.
[2]. André T, Shiu KK, Kim TW, etal. Pembrolizumab in Microsatellite-Instability-High Advanced ColorectalCancer. N Engl J Med. 2020;383(23):2207-2218.
[3]. Youn JW, Hur SY, Woo JW, et al.Pembrolizumab plus GX-188E therapeutic DNA vaccine in patients withHPV-16-positive or HPV-18-positive advanced cervical cancer: interim results ofa single-arm, phase 2 trial. Lancet Oncol. 2020;21(12):1653-1660.
[4]. Roudko,V. et al. Shared ImmunogenicPoly-Epitope Frameshift Mutations in Microsatellite Unstable Tumors. Cell, doi:10.1016/j.cell.2020.11.004(2020).